強直性脊柱炎患者MMP-3、MMP-9表達及臨床意義
張莉
強直性脊柱炎(ankylosing spondylitis,AS)是一種主要累及脊柱、骶髂關節和外周關節的全身慢性炎性疾病,其發病與遺傳、自身免疫、感染等相關,患者主要表現為外周關節炎癥狀、腰背痛、發僵、活動受限等,該病有一定的自限性,一般預后較好,但部分患者可出現迅速骨損及其他嚴重并發癥,影響患者的生存質量,甚至危及生命[1,2]。基質金屬蛋白酶(matrix metalloproteinases,MMPs)是一組幾乎參與所有細胞外基質水解的內源性蛋白水解酶,代表性分子包括MMP-3、MMP-9[3],目前相關研究認為,MMPs 不僅直接參與骨基質成分降解,同時介導成熟破骨細胞活化、遷移等過程,其異常表達可能在AS 病理機制中占重要地位[4]。本研究通過分析AS 患者血清MMP-3、MMP-9 表達情況及其與骨代謝指標相關性,探討檢測MMP-3、MMP-9 的臨床意義。
1 材料與方法
1.1 一般資料以我院2017年1月~2019年3月收治的146 例AS 患者為研究對象(AS 組),納入標準:符合2009年國際AS 工作組(ASAS)中推薦的AS 診斷標準[5],入院前未接受抗風濕藥及相關生物制劑治療,配合相關檢查、臨床評估,簽署知情同意書。排除標準:存在累及脊柱、關節的其他疾病,患有惡性腫瘤、嚴重肝腎功能不全、內分泌系統疾病、感染性疾病、血液系統疾病等,處于妊娠期、哺乳期、絕經期,長期服用激素類藥物、影響骨代謝藥物,精神異常,無法取得檢查配合。146 例患者中,男119 例,女27 例,年齡20~47 歲,平均(29.35±8.42)歲,病程1~20年,平均(8.06±4.37)年,入院時Bath 強直性脊柱炎疾病活動性指數(BASDAI)≥6 者83 例,<6 者63 例;Bath 強直性脊柱炎功能指數(BASFI)≥6 者78 例,<6 者68 例;另按同年齡段、同性別比選取我院同期100 例健康體檢者作為對照組,男81 例,女19 例,年齡20~50歲,平均(30.06±9.14)歲,體檢者無明顯器質性疾病、自身免疫性疾病,自愿接受相關檢查,并簽署知情同意書。
1.2 方法所有患者入院24h 內完成清晨空腹靜脈血標本采集,離心后(2 000r/min,10min)分裝,于-50℃條件下保存待測,檢測指標包括:紅細胞沉降率(ESR)、C 反應蛋白(CRP)、25 羥維生素D(25-OH-D)、血清Ca、MMP-3、MMP-9、骨堿性磷酸酶(BALP)、血漿抗酒石酸酸性磷酸酶(TRACP-5b)水平,上述指標的檢驗試劑盒出自上海森雄科技有限公司,均采用雙抗體夾心法檢測,檢查步驟嚴格按試劑盒操作。患者入院時分別采用BASDAI、BASFI 量表[6]評價患者的癥狀及功能狀態,其中BASDAI 含晨僵(時間及程度)、脊柱痛、外周關節痛、局限性壓痛、疲勞5 個癥狀共6 項內容,根據程度,采用0~10 分計分法,所得總分除以項目數即BASDAI 值,該值越高,癥狀越嚴重;BASFI 包括10 項功能評估內容,也采用0~10 分計分法,所得總分除以項目數即BASFI 值,該值越高,功能越差。采用美國Hologic 全身雙能X 線骨密度儀檢測患者股骨近端、腰椎前后位骨密度(BMD)值,其中任何部位BMD 較同性別、同種族健康人骨峰值降低≥2.5 個標準差視為骨質疏松癥,降低1~2.4個標準差視為骨量減少,降低不足1 個標準差視為正常。
1.3 統計學分析采用SPSS 19.0 軟件,計量資料用均數±標準差(±s)表示,先經單樣本Kolmogorov-Smirnov 檢驗正態性,符合正態分布的計量資料組間比較行獨立樣本t檢驗,多組比較采用重復測量方差分析,組內兩兩比較行q檢驗;采用Pearson 進行相關性分析,P<0.05 表示差異有統計學意義。
2 結果
2.1 AS 組與對照組一般資料比較AS 組與對照組性別、年齡、體質指數、血清Ca、血清BALP 水平比較差異無統計學意義(P>0.05),但AS 組ESR、血清CRP、TRACP-5b 水平均顯著高于對照組,腰椎BMD 顯著低于對照組(P<0.05),見表1。
2.2 AS 組與對照組MMP-3、MMP-9 表達水平比較AS 組血清MMP-3、MMP-9 水平均顯著高于對照組(P<0.05),見表2。
表1 AS 組與對照組一般資料比較(±s)
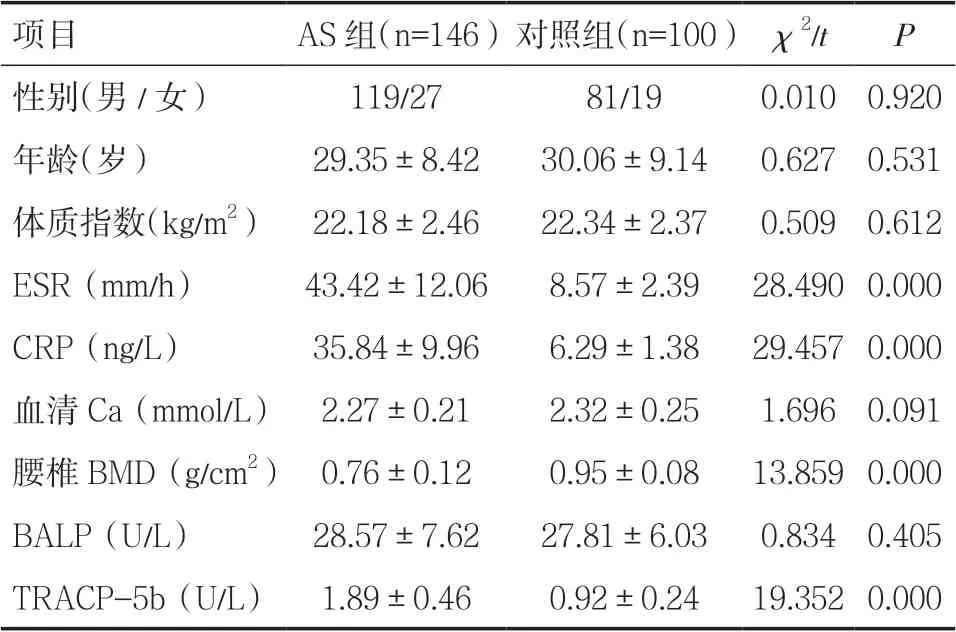
表1 AS 組與對照組一般資料比較(±s)
項目 AS 組(n=146)對照組(n=100) χ2/t P性別(男/女) 119/27 81/19 0.010 0.920年齡(歲) 29.35±8.42 30.06±9.14 0.627 0.531體質指數(kg/m2) 22.18±2.46 22.34±2.37 0.509 0.612 ESR(mm/h) 43.42±12.06 8.57±2.39 28.490 0.000 CRP(ng/L) 35.84±9.96 6.29±1.38 29.457 0.000血清Ca(mmol/L) 2.27±0.21 2.32±0.25 1.696 0.091腰椎BMD(g/cm2) 0.76±0.12 0.95±0.08 13.859 0.000 BALP(U/L) 28.57±7.62 27.81±6.03 0.834 0.405 TRACP-5b(U/L) 1.89±0.46 0.92±0.24 19.352 0.000
表2 AS 組與對照組血清MMP-3、MMP-9 表達 水平比較(±s,ng/ml)
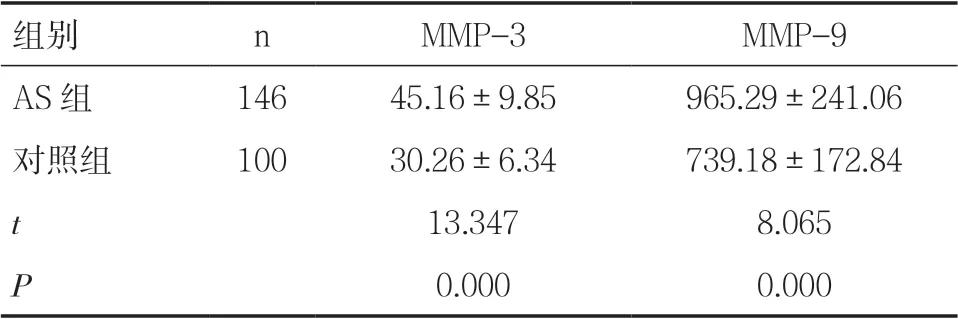
表2 AS 組與對照組血清MMP-3、MMP-9 表達 水平比較(±s,ng/ml)
組別 n MMP-3 MMP-9 AS 組 146 45.16±9.85 965.29±241.06對照組 100 30.26±6.34 739.18±172.84 t 13.347 8.065 P 0.000 0.000
2.3 不同癥狀嚴重程度AS 患者MMP-3、MMP-9 表達水平比較BASDAI ≥6 組血清MMP-3、MMP-9水平均顯著高于BASDAI<6 組(P<0.05),見表3。
表3 不同癥狀嚴重程度AS 患者血清MMP-3、MMP-9 表達水平比較(±s,ng/ml)
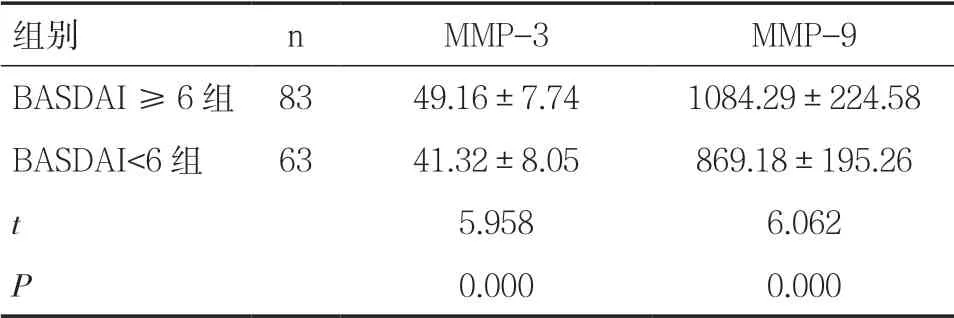
表3 不同癥狀嚴重程度AS 患者血清MMP-3、MMP-9 表達水平比較(±s,ng/ml)
組別 n MMP-3 MMP-9 BASDAI ≥6 組 83 49.16±7.74 1084.29±224.58 BASDAI<6 組 63 41.32±8.05 869.18±195.26 t 5.958 6.062 P 0.000 0.000
2.4 不同功能狀態AS 患者MMP-3、MMP-9 表達水平比較BASFI ≥6 組血清MMP-3、MMP-9 水平均顯著高于BASFI<6 組(P<0.05),見表4。
表4 不同功能狀態AS 患者血清MMP-3、MMP-9 表達水平比較(±s,ng/ml)
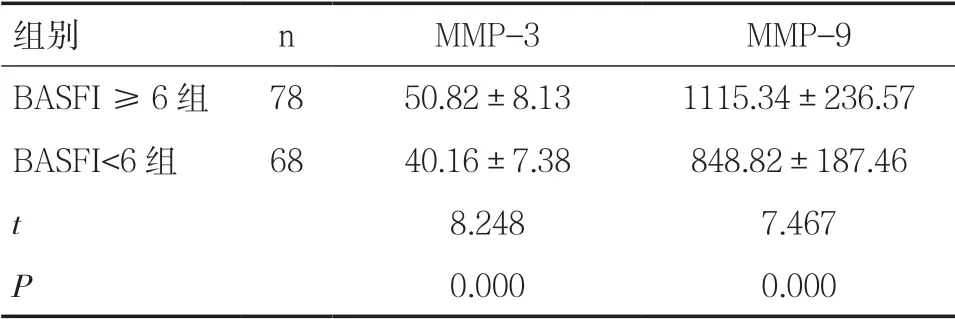
表4 不同功能狀態AS 患者血清MMP-3、MMP-9 表達水平比較(±s,ng/ml)
組別 n MMP-3 MMP-9 BASFI ≥6 組 78 50.82±8.13 1115.34±236.57 BASFI<6 組 68 40.16±7.38 848.82±187.46 t 8.248 7.467 P 0.000 0.000
2.5 不同骨密度AS 患者MMP-3、MMP-9 表達水平比較不同骨密度AS 患者MMP-3、MMP-9 表達水平差異有統計學意義(P<0.05),且骨量減少組、骨質疏松癥組MMP-3、MMP-9 表達水平顯著高于骨量正常組(P<0.05),見表5。
表5 不同骨密度AS 患者MMP-3、MMP-9 表達水平比較 (±s,ng/ml)
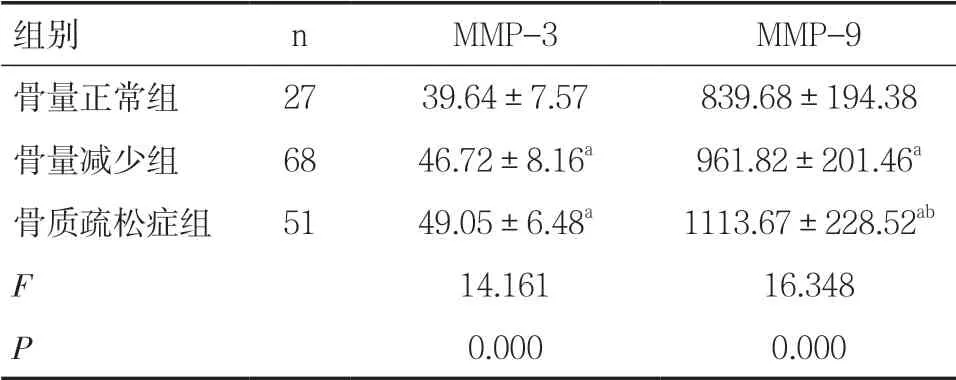
表5 不同骨密度AS 患者MMP-3、MMP-9 表達水平比較 (±s,ng/ml)
注:與骨量正常組比較,aP<0.05;與骨量減少組比較,bP<0.05
組別 n MMP-3 MMP-9骨量正常組 27 39.64±7.57 839.68±194.38骨量減少組 68 46.72±8.16a 961.82±201.46a骨質疏松癥組 51 49.05±6.48a 1113.67±228.52ab F 14.161 16.348 P 0.000 0.000
2.6 AS 患者MMP-3、MMP-9 表達水平與骨代謝指標相關性分析Pearson 相關性分析顯示,AS 患者血清MMP-3、MMP-9 表達水平均與ESR、CRP、BASDAI、BASFI、TRACP-5b 呈正相關(P<0.05),與BMD 呈負相關(P<0.05),見表6。

表6 AS 患者MMP-3、MMP-9 表達水平與骨代謝指標相關性分析(r)
3 討論
AS 以附著點炎和滑膜炎為病理特點,前者初期以淋巴細胞、漿細胞、多核白細胞浸潤為主,進而造成附著點侵蝕、血管翳形成,后者表現為滑膜細胞增生、肥大,伴明顯淋巴細胞、漿細胞浸潤,這些病理過程進展會對關節軟骨及骨質造成嚴重破壞,晚期則造成關節纖維性強直、骨性強直[7]。AS 上述病理過程實際上被認為是間質成分被水解蛋白酶消化的過程。研究指出,MMPs 作為一組以降解細胞外基質為主要功能的水解蛋白酶,其在關節軟骨、骨組織的降解、破壞、再塑中扮演重要角色,監測其水平變化,在骨關節炎性疾病中受到重視[8]。
根據MMPs 結構及底物特異性不同,MMPs 主要可分為間質膠原酶、Ⅳ型膠原酶、基質溶解素、膜型MMPs,其中MMP-3 屬于基質溶解素系列,主要由各種結締組織細胞、巨噬細胞產生,主要作用底物為基質中糖蛋白、蛋白多糖,被認為是最重要的降解軟骨基質蛋白酶[9]。研究認為,MMP-3 不僅介導成纖維細胞增生,也參與間質膠原酶激活,后者則直接參與Ⅱ型膠原降解,此外,MMP-3 也參與炎癥反應。有研究顯示,下調MMP-3 水平能降低致炎因子釋放,對調整AS 異常基質降解、改善血管翳形成有積極作用,進而發揮改善患者癥狀、抑制骨質及軟骨破壞作用[10]。MMP-9 屬于明膠酶系列,在結締組織細胞、破骨細胞、巨噬細胞胞漿中均有表達,其中在破骨細胞中呈特異性高表達,可特異性降解非礦化軟骨,同時促進與細胞外基質結合的血管內皮生長因子釋放,起到趨化破骨細胞效應,進而參與骨破壞[11]。本研究結果顯示,AS 組MMP-3、 MMP-9 水平均顯著高于對照組,且不同癥狀嚴重程度、不同功能狀態AS 患者血清MMP-3、MMP-9 水平表達差異有統計學意義,表現為BASDAI ≥6 組高于BASDAI<6 組、BASFI ≥6 組高于BASFI<6 組,提示MMP-3、MMP-9 可能參與了AS 發病機制,且在AS 病情進展中起重要作用。ESR、血清CRP 是常見反映AS 活動程度的指標,BASDAI、BASFI 可用來判斷AS 癥狀嚴重程度及功能狀態,本研究經相關性分析發現,AS 患者MMP-3、MMP-9 均與ESR、CRP、BASDAI、BASFI 呈正相關,進一步證實了AS 患者血清MMP-3、MMP-9 水平與病情活動性密切相關。既往有研究顯示[12],AS 患者經抗腫瘤壞死因子治療后,血清MMP-3、MMP-9 明顯下調,且下降水平與患者臨床活動性指標有相關性,也提示MMP-3、MMP-9 參與AS 發病機制及疾病進展,可作為監測患者病情的指標,支持本研究 結果。
骨代謝指成骨細胞形成新骨、破骨細胞吸收舊骨過程,而患者骨量水平取決于新骨形成與舊骨吸收平衡。有數據顯示,AS 患者中50%~92%患者存在骨量減少或骨質疏松,因此在AS 患者治療干預中,有必要了解患者骨代謝狀況[13]。血清Ca、BMD 是評估骨代謝常用指標,BALP、TRACP-5b 是相對較新的骨代謝指標,其中BALP 由成骨細胞分泌,通過水解多種磷脂酸酶可在成骨過程中為羥基磷灰石沉積提供所需磷酸,且BALP 對焦磷酸鹽有水解作用,可減輕其對骨礦化的抑制作用,對骨形成有積極意義,目前BALP 定量檢測是觀察成骨細胞活性的重要標志;TRACP-5b 主要來源于破骨細胞,其水平上升,表明破骨細胞活性增強,可作為骨吸收的標志物[14]。本研究結果顯示,AS 組與對照組血清Ca、BALP 水平比較差異無統計學意義,但AS 組血清TRACP-5b 水平顯著高于對照組,BMD顯著低于對照組,提示AS 患者骨代謝表現出骨吸收增強狀態,可以解釋AS 患者易發生骨量減少或骨質疏松的原因。且在本研究相關性分析中顯示,MMP-3、MMP-9 均與TRACP-5b 呈正相關,與BMD 呈負相關,提示AS 患者MMP-3、MMP-9 與骨代謝關系密切。既往也有研究指出,MMP-9 參與破骨細胞遷移,并通過降解細胞外基質促進破骨細胞骨吸收,而抑制MMP-9 生成,可一定程度上抑制破骨細胞骨吸收過程,有利于控制骨量減少情況[15]。還有學者報道[16],骨質疏松患者MMP-3、MMP-9 等基質金屬蛋白酶表達明顯高于健康人群,且骨質疏松程度越高,其表達水平越高,也證實了MMP-3、MMP-9 對骨代謝有較大影響,上述研究結果與本研究結果相符。
綜上所述,AS 患者血清MMP-3、MMP-9 呈高水平表達,且與患者病情活動性、骨代謝密切相關,監測血清MMP-3、MMP-9 水平可為判斷AS 患者病情、骨質破壞提供依據,而給予MMPs 抑制劑或許能為AS 治療提供新思路,值得臨床進一步研究。

