長薄鰍惡臭假單胞菌的分離鑒定及其感染的病理損傷
白明煥,耿 毅,*,鄧龍君,甘維熊,周 劍,黃小麗,陳德芳,歐陽萍,趙若璇,諶冰潔
(1.四川農業大學 動物醫學院,四川 成都 611130; 2.雅礱江流域水電開發有限公司,四川 成都 610056; 3.四川省農業科學院 水產研究所,四川 成都 611731)
惡臭假單胞菌(Pseudomonasputida)屬假單胞菌科(Pseudomonadaceae)、假單胞菌屬(Pseudomonas),革蘭陰性桿菌,廣泛分布于土壤、水體中,是一種條件致病菌,可感染兩棲類、魚類和甲殼類等多種水生動物。現已有大鯢(Andriasdavidianus)[1]、歐洲鰻鱺(Anguillaanguilla)[2]、中華絨螯蟹(Eriocheirsinensis)[3]、條石鯛(Japaneseparrotfish)[4]、三疣梭子蟹(Portunustrituberculatus)[5]、羅氏沼蝦(Macrobrachiumrosenbergiideman)[6]、黑鯛(Sparusmacrocephlus)[7]、雜交鱘(hybrid sturgeon)[8]、雜交鲇(hybrid catfish)[9]、大黃魚(Larimichthyscrocea)[10]及虹鱒(Oncorhynchusmykiss)[11]等感染,并引起全身多器官出血、壞死,甚至死亡的報道。
長薄鰍(Leptobotiaelongata)為鯉形目(Cypriniformes)、鰍科(Cobitidae)、薄鰍屬(Leptobotia)魚類,俗名花鰍、紅沙鰍鉆等,是中國的特有物種,主要分布于長江宜賓江段及其臨近水域。魚體兩側有鮮艷的花斑,具有極高的觀賞價值,同時其肉富含蛋白質、脂肪、必需氨基酸以及人體所需的鈣磷等常量元素[12],是觀賞和食用價值兼備的名貴魚類。隨著長江流域的過度捕撈以及大量水利工程的修建,導致長薄鰍的棲息地環境遭到破壞,其資源量和漁獲量不斷下降,已被列入《中國瀕危動物紅皮書》和《中國物種紅色名錄》。近年來,隨著長薄鰍人工繁殖的成功,其養殖逐漸興起,并被列為重要的增殖放流對象。2017年8月,四川省西昌市某養殖場的長薄鰍陸續出現發病死亡,主要表現為體表潰爛、出血等癥狀,為明確其病因,本研究從自然發病魚體內進行了病原菌的分離,并通過表型特性測定、16S rRNA和gyrB基因序列分析確定其病原為惡臭假單胞菌(Pseudomonasputida),同時進行了病理損傷觀察,以期為長薄鰍疾病的診斷和防控提供參考。
1 材料與方法
1.1 材料
患病魚,體質量355.3~426.8 g,采自四川省西昌市某養殖場;健康魚,體質量112.7~131.6 g,購于四川省宜賓市某養殖場。
1.2 主要試劑
LB培養基、細菌基因組提取試劑盒、藥敏紙片、細菌生化微量鑒定管、PCR Master Mix、DL2000 DNA Marker、細菌基因組DNA提取試劑盒、PCR產物純化試劑盒。
1.3 剖檢變化與組織病理學觀察
對病魚進行系統解剖,對各組織、器官的病理損傷觀察,并取鰓絲、鰭條以及體表黏液進行寄生蟲檢查。同時取患病魚的心、肝、脾、腎等組織,4%的甲醛固定,脫水、透明、石蠟包埋、切片、HE染色,光學顯微鏡觀察其組織學損傷。
1.4 病原菌分離及形態觀察
無菌條件下,從病魚的肝、脾與腎等取樣,LB平板上畫線,于28 ℃恒溫培養24~48 h。挑取形狀、大小、顏色均勻一致的優勢單個菌落再次接種LB平板進行純化培養,并觀察菌落與細菌形態特征。獲得純化后的菌株4 ℃保存備用。
1.5 生理生化測定及藥敏試驗
生理生化特性采用微量生化法參照《常見細菌系統鑒定手冊》[13]進行。藥敏試驗采用K-B法進行,將新鮮菌液用無菌棉簽均勻涂布于MH平板,28 ℃培養24 h測定抑菌圈的直徑并判定結果,敏感度根據杭州微生物試劑有限公司提供的標準進行判定。
1.6 人工感染試驗
將分離菌接種于LB肉湯,28 ℃振蕩培養24 h后用麥氏比濁法將菌液濃度調至3.0×108、3.0×107、3.0×106和3.0×105CFU·mL-1,健康長薄鰍于水溫(20±1)℃中暫養7 d后,腹腔注射菌液0.2 mL·尾-1,每組20尾;對照組注射等量的生理鹽水。接種后每天觀察魚的臨床表現及死亡情況,試驗期14 d。對感染后的病死魚及時進行解剖,并進行細菌的分離鑒定。
1.7 16S rRNA和gyrB基因序列測定及系統進化分析
取對數生長期新鮮菌液,按照細菌基因組DNA提取試劑盒提取DNA。采用16S rRNA的通用引物[14]與gyrB基因的通用引物[15](表1)分別進行PCR擴增。PCR反應程序:95 ℃ 10 min;94 ℃ 2 min,55 ℃ 1 min,72 ℃ 1 min 30 s,共35次循環;最后,72 ℃延伸10 min。PCR擴增產物經1.5%的瓊脂糖凝膠電泳檢測,將純化回收的PCR產物送成都擎科梓熙生物技術有限公司測序。將獲得的分離菌16S rRNA與gyrB基因序列和已知GenBank數據庫中進行Blast比對,使用MEGA 7.1用Neighbor-Joining法構建系統進化樹。
表1細菌16S rRNA和gyrB基因引物序列
Table1Primer sequence of bacterial 16S rRNA andgyrBgene
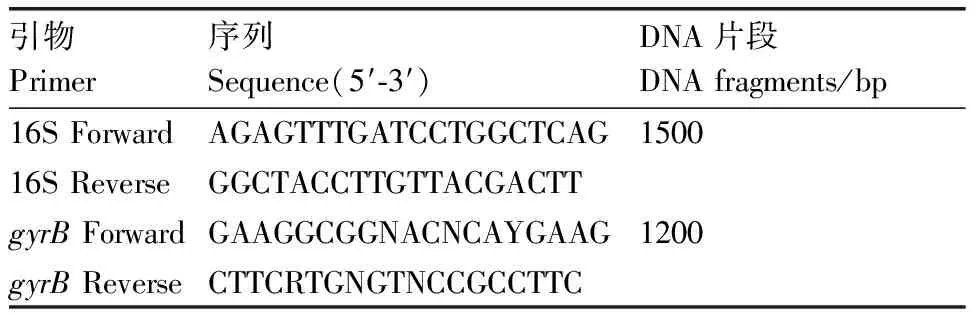
引物Primer序列Sequence(5′-3′)DNA片段DNA fragments/bp16S ForwardAGAGTTTGATCCTGGCTCAG150016S ReverseGGCTACCTTGTTACGACTTgyrB ForwardGAAGGCGGNACNCAYGAAG1200gyrB ReverseCTTCRTGNGTNCCGCCTTC
2 結果與分析
2.1 臨床癥狀與剖檢變化
發病長薄鰍表現為食欲不振,游動緩慢,常浮于水面。病魚的鰓蓋邊緣及胸鰭基部出血及潰瘍灶,胸腹部點狀出血,體表尤其是尾部見大小不等的潰爛,病程長的病例在潰瘍灶可見水霉著生(圖1-A)。剖檢見鰓絲充血、腫脹,呈深紅色;肝淤血、腫大,質脆,呈花斑狀(圖1-B),脾與腎腫大,呈暗紅色;胃腸道空虛,腸腔內充有較多的黏液。鰓絲壓片與體表黏液涂片鏡檢,未發現寄生蟲。
2.2 病原菌分離及形態觀察
從發病長薄鰍肝、腎與脾內分離獲得3株優勢菌(BMH170819、BMH170820、BMH170821),28 ℃培養24 h后,在LB培養基上形成表面濕潤光滑,微隆起,邊緣整齊,直徑1.5~2.5 mm的淡黃色半透明的菌落。3株菌經革蘭氏染色均呈G-桿菌,大小為0.5~1.0 μm×1.5~4.0 μm(圖2)。
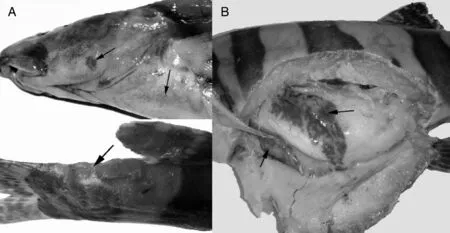
A,鰓蓋邊緣潰瘍,胸鰭基部與胸部出血;B,肝淤血,腫大。A, Ulcers were on the edge of the operculum and punctate hemorrhage were at the base of the pectoral fin and the breast; B, Congestion and swelling of liver.圖1 患病長薄鰍的剖檢變化Fig.1 Gross lesions of diseased Leptobotia elongate
2.3 分離菌生理生化特性及藥敏試驗
分離菌的主要生理生化特性見表2,3株分離菌的主要生化特性相同且與惡臭假單胞菌(Pseudomonasputida)的生理生化特性基本一致,初步判定其為P.putida。藥敏試驗發現,3株菌均對新霉素、慶大霉素、四環素、諾氟沙星、強力霉素等敏感,對氨芐西林、阿莫西林、林可霉素、氟苯尼考、克林霉素等耐藥,詳見表3。

圖2 分離株革蘭氏染色形態Fig.2 Micrograph of strain in Gram staining
2.4 分離菌人工感染試驗
由于3株分離菌的生理生化特性及藥物敏感性完全一致,故選其中一株(BMH170820)進行人工感染試驗。攻毒24 h后,細菌濃度為3.0×108、3.0×107CFU·mL-1試驗組的長薄鰍出現采食量下降、游動無力等臨床癥狀,濃度為3.0×106、3.0×105CFU·mL-1的長薄鰍陸續從注射后的3~4 d開始出現臨床癥狀。隨著病情的發展,發病長薄鰍的體表開始出現出血點、潰瘍、爛斑、鰭條出血等。濃度為3.0×108CFU·mL-1的試驗組,從第3天開始出現死亡,其余組則在感染后4~5 d開始出現死亡,到試驗結束時,各感染組的死亡率分別為85%、65%、30%和10%;而對照組的長薄鰍在試驗期間無異常。從人工感染發病死亡的長薄鰍體內再次分離細菌,獲得與感染接種菌形態、理化特性及16S rRNA基因序列一致的菌株。
2.5 16S rRNA和gyrB基因序列測定及系統進化分析
采用擴增16S rRNA基因和gyrB基因的通用引物,分別擴增得到1 500、1 200 bp的片段,純化測序后將序列提交NCBI獲得GenBank登錄號分別為MH155971和MH396435。將獲得的16S rRNA和gyrB基因序列與GenBank中已有的序列進行Blast比對,結果顯示,菌株BMH170820與數據庫中的惡臭假單胞菌同源性最高。在基于分離菌的16S rRNA和gyrB序列與GenBank中已有的假單胞菌屬細菌16S rRNA及gyrB基因序列建立的系統進化樹上(圖3),該分離菌株與P.putida聚為一族。
表2分離株BMH170819-BMH170821生理生化特性
Table2Biochemical and physiological characteristics of isolated strain BMH170819-BMH170821

試驗項目ItemsBMH170819-BMH170821P. putida[13]P. putida[9]運動性 Motility++N/A精氨酸雙水解酶 Arginine dihydrolase+++鳥氨酸脫羧酶 Ornithine decarboxyla---賴氨酸脫羧酶 Lysin decarboxylase---接觸酶 Catalase++N/A脲酶 Urease--+氧化酶 Oxidase+++H2S 產生 H2S production---檸檬酸鹽 Citrate+++吲哚反應 Indole test---甘露醇Mannitol---明膠 Gelatin---硝酸鹽還原 Nitrate reduction+++V-P 試驗 V-P test---半乳糖ONPG-N/A-葡萄糖產氣 Glucose gas--N/A甲基紅 Methyl red---麥芽糖 Maltose---木糖 Xylose--+果糖 Fructose++N/A
+,陽性反應;-,陰性反應;N/A,未測定。
+, Positive; -, Negative; N/A, No determination.
表3分離株BMH170819-BMH170821的藥敏試驗結果
Table3Antibiotics sensitivities of the isolated strain BMH170819-BMH170821
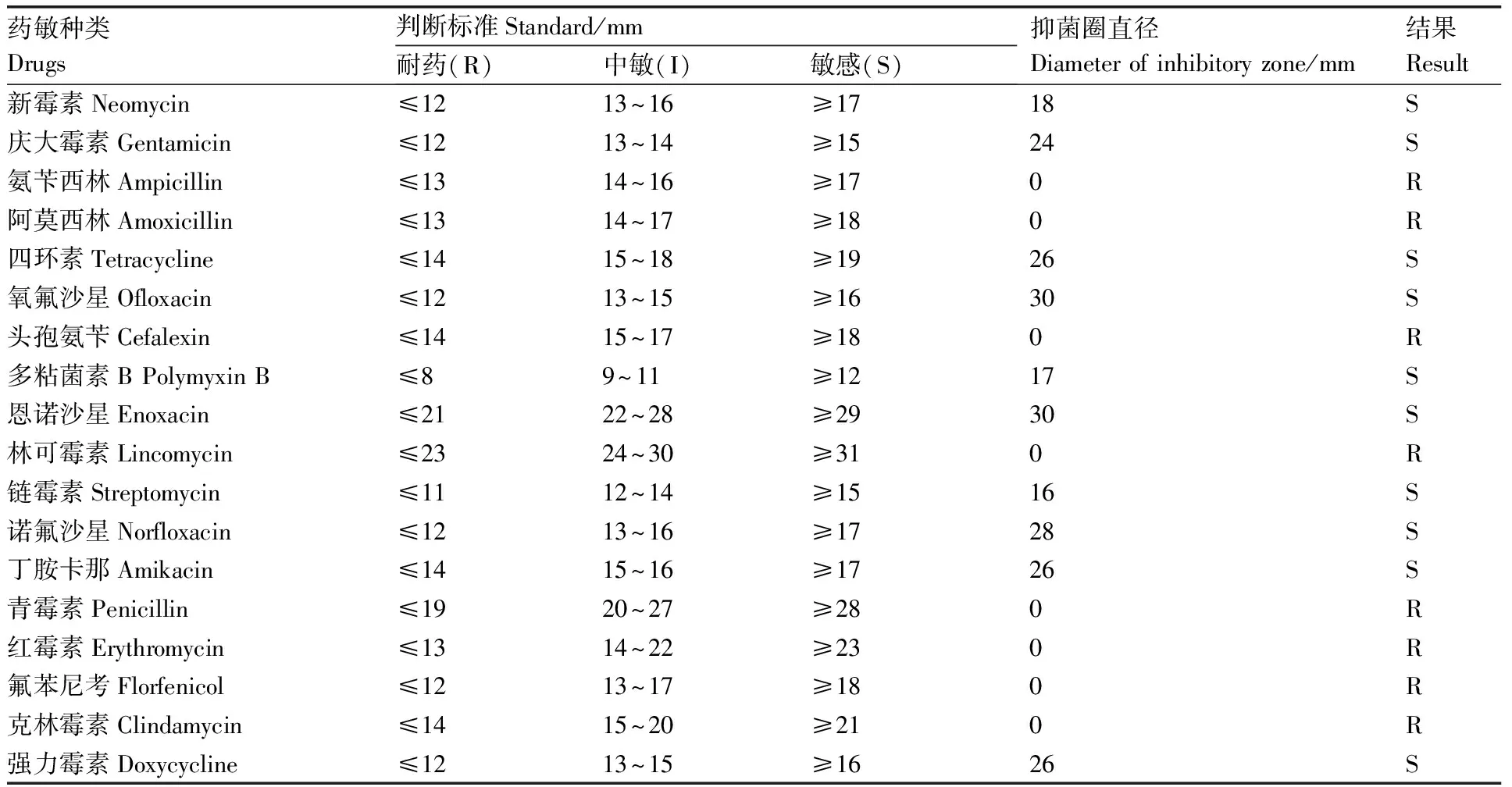
藥敏種類Drugs判斷標準Standard/mm耐藥(R)中敏(I)敏感(S)抑菌圈直徑Diameter of inhibitory zone/mm結果Result新霉素Neomycin≤1213~16≥1718S慶大霉素Gentamicin≤1213~14≥1524S氨芐西林Ampicillin≤1314~16≥170R阿莫西林Amoxicillin≤1314~17≥180R四環素Tetracycline≤1415~18≥1926S氧氟沙星Ofloxacin≤1213~15≥1630S頭孢氨芐Cefalexin≤1415~17≥180R多粘菌素B Polymyxin B≤89~11≥1217S恩諾沙星Enoxacin≤2122~28≥2930S林可霉素Lincomycin≤2324~30≥310R鏈霉素Streptomycin≤1112~14≥1516S諾氟沙星Norfloxacin≤1213~16≥1728S丁胺卡那Amikacin≤1415~16≥1726S青霉素Penicillin≤1920~27≥280R紅霉素Erythromycin≤1314~22≥230R氟苯尼考Florfenicol≤1213~17≥180R克林霉素Clindamycin≤1415~20≥210R強力霉素Doxycycline≤1213~15≥1626S
S,敏感;I,中度敏感;R,耐藥。
S, Sensitive; I, Moderately sensitive; R, Resistant.
2.6 組織病理損傷觀察
肝竇淤血,肝細胞索排列紊亂,肝細胞顆粒變性,細胞體積顯著增大,胞漿淡染,局部肝細胞空泡變性(圖4-A);鰓小片上皮細胞壞死并脫落,鰓小片間有大量淡紅染的滲出物與炎癥細胞(圖4-B);腸道黏膜上皮細胞壞死脫落,碎片散落于腸腔(圖4-C),固有膜內炎癥細胞浸潤;心肌纖維排列紊亂,橫紋消失,顆粒變性,甚至溶解壞死,肌間隙內炎癥細胞浸潤(圖4-D);脾臟明顯淤血、出血,黑色素巨噬細胞中心擴大,數量增多,淋巴細胞顯著減少,大量黃鐵血黃素沉著(圖4-E);腎小管上皮細胞顆粒變性,甚至壞死,管腔內見均質紅染的蛋白或脫落的上皮細胞形成的管型,腎間質大量淋巴細胞、巨噬細胞與中性白細胞浸潤(圖4-F)。
3 討論
假單胞菌屬(Pseudomonas)細菌廣泛分布于土壤、淡水、海水中,其中的部分種類對水生動物的致病性逐步被發現,已有熒光假單胞菌(Pseudomonasfluorescens)感染錦鯉[16]、鱖[17],銅綠假單胞菌(Pseudomonasaeruginosa)感染河豚[18],惡臭假單胞菌感染雜交鱘[8]、雜交鲇[9]、大黃魚[10, 19]以及三疣梭子蟹[5]等的報道,尤其是惡臭假單胞菌具有較為廣泛的感染宿主,已受到人們的高度關注。長薄鰍作為我國特有的瀕危物種,其保護與開發受到了社會的高度重視,相繼開展了馴化、人工繁殖與養殖等研究與實踐工作,但對于其疾病的研究還相當缺乏。本研究從患病長薄鰍體內分離出菌株BMH170820,經人工感染確定該分離菌的病原性,并通過16S rRNA和gyrB基因測序分析,結合菌落和細菌形態以及生理生化特性鑒定其為惡臭假單胞菌。由此可見,惡臭假單胞菌自然情況下也可感染長薄鰍致死亡,因此,在長薄鰍的養殖中應重視該病的危害。

圖3 基于16S rRNA基因序列(A)與gyrB基因序列(B)構建的菌株BMH170820與相關菌株的系統發育樹Fig.3 Phylogenetic trees based on 16S rRNA (A) and gyrB gene (B) sequence of the isolated strain BMH170820 and other related species in Pseudomonas genus
據報道,歐洲鰻鱺[2]和羅氏沼蝦[6]感染時病變主要集中在鰓,表現為鰓絲潰爛;中華絨螯蟹[3]感染時主要表現為腳爪無力,容易脫落;而三疣梭子蟹[5]感染時表現為內臟和肌肉組織溶解為乳白色的液體;以及黑鯛[7]和雜交鱘[8]主要表現為腸炎等。本研究中惡臭假單胞菌感染長薄鰍主要表現為體表潰瘍、出血,以及對肝、脾、腎,鰓和心等多組織器官的損傷。可見,惡臭假單胞菌感染不同的宿主可能具有不同的臨床特征與病理損傷特點,造成這種差異的原因是與宿主種屬特性有關,還是與菌株的差異有關值得進一步研究。此外,該菌對人體的感染率也呈上升趨勢,能引起葡萄球菌樣燙傷性皮膚綜合征[20]、敗血癥[21]、食物中毒[22-23]、傷口感染[24-25]等。因此,惡臭假單胞菌不僅對水產養殖危害嚴重,而且對人類健康也構成威脅,應給予高度重視。
隨著抗生素的廣泛應用,惡臭假單胞菌的耐藥率也有上升的趨勢,耐藥菌株感染也越來越多,給治療帶來困難[26-27]。本研究中發現,從長薄鰍分離到的惡臭假單胞菌(BMH170820)對四環素、氧氟沙星、恩諾沙星以及強力霉素等10種抗生素敏感,對氟苯尼考、阿莫西林、頭孢氨芐、林可霉素等8種抗生素耐藥。這與楊圓圓等[8]報道雜交鱘源惡臭假單胞菌對氟苯尼考敏感;毛芝娟等[7]報道黑鯛源惡臭假單胞菌對氧氟沙星耐藥;Holmgaard等[28]報道人源惡臭假單胞菌對強力霉素耐藥的結果存在較大的差異。此外,Holmgaard等[28]還報道,從丹麥分離的人源惡臭假單胞菌具有包括β-內酰胺類、氨基糖苷類、四環素類等6種耐藥基因,Peter等[29]也證實韓國分離的不同菌株間的耐藥基因存在差異,這表明不同菌株間存在耐藥性差異。因此,臨床用藥應根據藥物敏感性試驗結果選擇用藥,以避免藥物的濫用。另外,由于疾病發生除了病原因素之外,還與環境、機體等因素有關,因此,有必要開展惡臭假單胞菌感染相關的環境風險因素的研究,以明確不同環境因子在發病風險中的作用,為養殖過程通過環境調控降低該病的發生風險提供依據。人類醫學已發現,惡臭假單胞菌的感染往往與機體的免疫力低下相關,因此,在長薄鰍的養殖過程適時使用微生態制劑與免疫增強劑,改善正常菌群[30],調節免疫系統,增強動物抵抗力[31]也可能是防控該菌感染的重要策略。
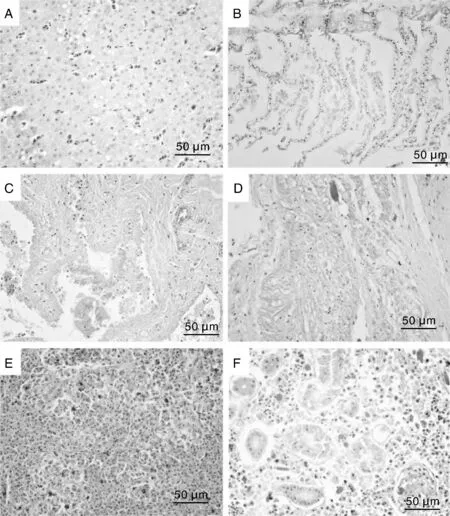
A,肝細胞顆粒變性,空泡變性;B,鰓小片上皮細胞壞死、脫落,炎癥細胞浸潤;C,腸黏膜上皮細胞壞死,脫落;D,心肌纖維變性,壞死,溶解;E,脾出血,淋巴細胞減少;F,腎小管上皮細胞變性,壞死,間質炎癥細胞浸潤。A, Granular and vacuolar degeneration in hepatocytes; B, Epithelial necrosis and abscission of the lamellae along with infiltration of inflammatory cells; C, Epithelial necrosis and abscission in intestinal mucosa; D, Degeneration, necrosis and myolysis of myocardial fiber; E, Hemorrhage and lymphocytopenia in spleen; F, Degeneration and necrosis in renal tubular epithelia and inflammatory cell infiltration of renal interstitium.圖4 感染惡臭假單胞菌長薄鰍的組織病理學損傷(HE)Fig.4 Histopathological lesions of Leptobotia elongate infected by P. putida(HE)

