慢性腦缺血與表觀遺傳學關系的研究進展
楊 旭,余能偉
(1.西南醫科大學臨床醫學院,四川 瀘州 646000;2.四川省醫學科學院·四川省人民醫院神經內科,四川 成都 610072)
隨著我國人口老齡化進展,腦血管疾病的發病率逐漸增高,居于我國疾病發病前列。目前中國心血管病人數2.9億,其中腦卒中1300萬,居于首位,2003~2015年中國腦血管病死亡率呈上升趨勢,農村地區高于城市地區[1],可見腦血管疾病嚴重加重了我國疾病負擔。在我國最新版《中國腦血管疾病分類2015》中,新增的慢性腦缺血疾病分類引起廣泛關注。對于缺血性腦血管事件而言,急性腦卒中起病急驟,易被發現且更受重視,但易導致嚴重臨床不良結局發生,慢性腦缺血起病隱匿,易受忽視,最終可發展為急性腦卒中、阿爾茨海默病等,但慢性腦缺血屬于可逆性疾病,因此在疾病早期給予干預可預防疾病進一步發展。
1 慢性腦缺血
慢性腦缺血作為獨立的疾病診斷長期存在爭議,2017年中華醫學會神經病學分會腦血管病學組正式發布《中國腦血管疾病分類2015》標準,其中專門增加了慢性腦缺血(chronic cerebral hypoperfusion,CCH)這一疾病類型,并提出慢性腦缺血為腦整體水平血液供應減少狀態[腦血流量25~45 ml/(100 g·min)]而非局灶性的腦缺血。患者多為老年人,常感覺頭重、頭暈、頭痛,除有動脈硬化或腦動脈狹窄外,無局灶性神經系統缺損的癥狀和體征,也無顱腦影像學異常(即無結構性改變)[2],但在疾病分類中尚未提出慢性腦缺血診斷標準,故臨床診斷仍存在一定爭議。2018年9月,北京中西醫結合學會卒中專業委員會發布《慢性腦缺血中西醫診療專家共識》[3],建議將慢性腦缺血的定義概況為:由于長期的血管病變或循環障礙所導致的腦供血減少,因失代償而引發的一系列臨床綜合征,患者癥狀出現時間一般在失代償后3個月以上,可持續存在或間斷性發作。并綜合國內外學者提出的診斷標準提出臨床診斷標準為:①患者年齡原則上大于60歲;起病隱襲,病程長,病史一般超過3個月;癥狀可程波動性。②具有慢性腦功能不全的表現。如頭暈、頭昏、頭脹痛,記憶力減退,反應遲鈍,注意力不集中,情緒不穩定,工作能力減退,睡眠障礙及情緒障礙等。③具有腦血管病危險因素,如高血壓病、糖尿病、血脂異常和冠心病病史。④無腦部的局灶神經系統體征。⑤實驗室檢查:存在支持腦動脈硬化的證據;眼動脈、顳動脈、橈動脈等周圍動脈硬化表現,或可聞及腦灌注動脈的血管雜音;腦血管檢查可發現腦動脈狹窄或梗阻性病變的證據。⑥頭CTA/MRI無血管性器質性腦改變。⑦腦灌注影像檢查證實存在腦部低灌注,建議將CTP及PWI作為診斷的基本條件,以充實慢性腦缺血診斷的準確性。⑧排除其他可導致相關臨床癥狀的神經、精神疾病;排除相關疾病如癔病、焦慮軀體化障礙、抑郁及各種變性病或主觀性頭暈等引起的慢性腦功能不全。
慢性腦缺血時因血管狹窄或血液動力學、血液流變學等因素導致腦血流量降低而出現腦慢性缺血缺氧改變。正常腦血流量約為50~55 ml/(100 g·min);當腦血流量減少至40 ml/(100 g·min)可導致腦中葡萄糖利用障礙;當腦血流量降至<30 ml/(100 g·min)時會出現蛋白質合成障礙;當腦血流量降至25~10 ml/(100 g·min)時,神經元活動開始喪失,神經功能障礙,但是仍然沒有神經元永久性損傷。然而,當腦血流量低于8 ml/(100 g·min)時,可出現細胞膜破壞導致細胞死亡以及永久性神經壞死[4]。新版腦血管疾病分類將慢性腦缺血血液供應減少定為25~45 ml/(100 g·min)可引起葡萄糖利用及蛋白質合成障礙等。慢性腦缺血發病機制復雜[5~7],包括膠質細胞增殖活化、氧化應激反應、細胞凋亡、突觸改變、神經遞質紊亂等,針對發病機制給予干預,可更有效預防慢性腦缺血疾病進展。
2 表觀遺傳學
近年表觀遺傳學作為一門新興學科逐漸成為研究熱點,表觀遺傳是指DNA序列不發生變化,而基因表達發生可逆可遺傳改變的現象。表觀遺傳修飾在正常生長發育及疾病中發揮重要作用,主要包括DNA甲基化、組蛋白修飾、非編碼RNA調控等。
DNA甲基化修飾指在DNA甲基化轉移酶(DNMTs)作用下將S-腺苷甲硫氨酸(SAM)作為甲基供體將甲基連接到胞嘧啶5位碳原子上形成5-甲基胞嘧啶(5 mc)的過程,主要發生于CpG二核苷酸位點,在不同生理過程及疾病階段呈現動態變化[6],此時形成的5 mc在TET氧合酶家族(α-酮戊二酸和Fe2+依賴的雙加氧酶)作用下依次將5-mc氧化為5-羥甲基胞嘧啶(5 hmc)、5-甲酰基胞嘧啶(5fc)、5-羧基胞嘧啶(5caC),最后5caC脫羧基為胞嘧啶完成循環(圖1[7]),因此5 mc是DNA甲基化形式,而5 hmc、5fc、5caC為去甲基化過程的中間體[8]。繼5-mc之后,新近發現的5-hmc逐漸進入人們視野,與5-mc在各組織中有穩定數量相比,5-hmc在各組織中差異較大,具有組織特異性。相關研究顯示,5-hmc在胚胎干細胞及腦組織中的含量最高[9,10],可高達其余組織的10倍[11,12],且越來越多的研究提示5-hmc與許多神經系統疾病存在關聯,其可以導致突觸可塑性改變、少突膠質細胞異常,出現學習、記憶功能障礙等。
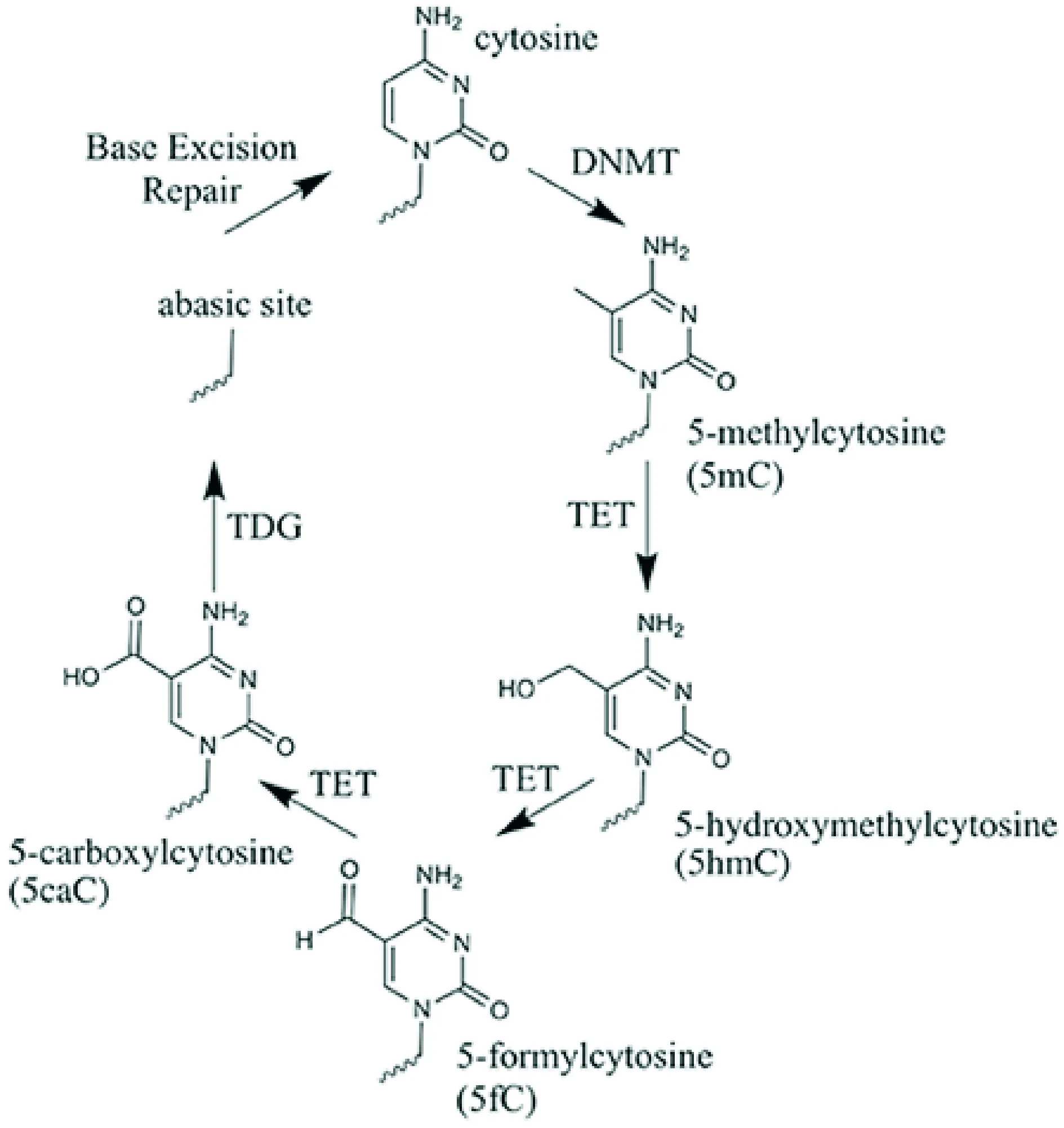
圖1 胞嘧啶氧化循環
組蛋白修飾是指組蛋白在相關酶的作用下發生一系列修飾變化的過程。組蛋白作為核小體核心在基因轉錄過程中發揮重要作用,組蛋白尾部游離的N-端可接受各種各樣的修飾,包括乙酰化、甲基化、磷酸化、泛素化、小類泛素化等[13],可影響染色質組裝及凝集程度,其中相對研究較多的是組蛋白乙酰化過程。組蛋白乙酰化是由組蛋白乙酰化酶(HATs)和組蛋白去乙酰化酶(HDACs)兩個酶系共同作用控制的動態過程,兩者之間的平衡在基因表達調節和發育過程及疾病狀態調控中發揮重要作用[14]。組蛋白乙酰化及去乙酰化異常可引起突出可塑性異常、長時程記憶形成障礙而出現學習、記憶功能障礙等神經系統相關癥狀[15]。有相關研究提示阿爾茨海默病、帕金森病等神經系統疾病中可出現組蛋白修飾改變[16],故對其研究可能將為某些神經系統功能變異或疾病的早期識別與治理提供理論依據。
非編碼RNA[17,18]是指不能翻譯為蛋白質的RNA分子,包括rRNA、tRNA、snRNA、snoRNA、microRNA等,其中microRNA研究最清楚。非編碼RNA根據長度是否超過200 nt可分為長鏈非編碼RNA(lncRNA)和短鏈非編碼RNA(sncRNA)。RNA修飾通過調節基因表達可影響正常發育過程[19],這些修飾可在細胞狀態轉變期間控制轉錄物的轉化或翻譯,在組織發育及穩態中發揮重要作用。在中樞神經系統疾病中,非編碼RNA在急性缺血性卒中、阿爾茨海默病、帕金森病、亨廷頓病等中發揮重要作用。急性缺血性卒中時[20,21]其可通過興奮性毒性作用、氧化應激、神經炎性反應及細胞凋亡等作用可導致急性缺血性卒中患者第二次腦損傷并阻礙腦功能的恢復,在腦缺血及卒中后恢復中發揮重要作用。非編碼RNA也可通過調節APP、BACE1表達及tau磷酸化等在阿爾茨海默病中發揮重要作用[22]。總體而言,非編碼RNA種類繁多,功能特性復雜,隨著基礎研究的進行,其在疾病中的作用將會得到進一步挖掘。
3 慢性腦缺血與表觀遺傳
慢性腦缺血時,腦血流量慢性持續減少引起腦組織長期缺血缺氧,導致持續性神經退行性變,細胞應對缺氧反應時,表觀遺傳通過組蛋白修飾、DNA甲基化及相關酶學變化等調控低氧誘導轉錄因子(HIF)家族與轉錄靶點結合及穩定性[23],介導突觸重塑,預防長時間暴露于低氧環境引起的興奮性毒性神經退行性病變,改變突觸遞質[24]等發揮重要作用。
目前對于慢性腦缺血與表觀遺傳關系的研究主要集中在組蛋白修飾及DNA甲基化修飾,可影響全基因組DNA甲基化及組蛋白乙酰化從而影響基因轉錄[25,26]。通過結扎小鼠雙側頸總動脈模擬慢性腦缺血模型,在結扎術后10天的急性階段,DNA甲基化(5 mc)首先呈現出甲基化水平降低的結果,隨著缺血時間延長,全基因組5 mc表達水平逐漸升高,在術后90天,與假手術組相比,全基因組5 mc水平增加了54%,在術后180天,全基因組5 mc水平為假手術組兩倍,同時伴隨DNA甲基轉移酶(DNMT3 a)水平降低及甲基結合蛋白(MBD2)水平升高。此外慢性腦缺血時,還出現組蛋白H3乙酰化及組蛋白去乙酰化酶(HDAC2)水平降低,組蛋白H4乙酰化水平無顯著變化,而乙酰轉移酶(HAT)水平升高[27],其具體原因尚未完全明了,需要更進一步研究完善。而不同的研究卻提示慢性腦缺血時雖然全基因組5 mc水平升高,但某些特殊基因如APP、BACE1卻呈低甲基化狀態,同時出現DNMT3 a水平升高,組蛋白H4乙酰化水平升高,H3水平無顯著變化,而補充DNA甲基供體S-腺苷甲硫氨酸(SAM)可通過上調乙酰膽堿及腦源性神經營養因子(BDNF)逆轉上述改變從而逆轉慢性腦缺血小鼠學習、記憶損害[28],故早期提供SAM可能成為慢性腦缺血治療靶點。
5 hmc作為一種重要的表觀遺傳標志物,在慢性腦缺血中亦發揮重要作用,表現出升高趨勢。慢性腦缺血與衰老及疾病導致的白質改變有關[29],白質5 hmc改變涉及小膠質細胞浸潤和少突膠質前體細胞(OPCs),在慢性腦缺血動物模型中,模型鼠一月后胼胝體5 hmc陽性細胞、Iba1陽性炎性小膠質細胞、NG2陽性少突膠質前體細胞比例明顯增高,5 hmc水平升高與炎性小膠質細胞增多有密切聯系,因此5 hmc在小鼠慢性腦缺血中表現出白質束和細胞類型的特異性動態改變。在腦缺血再灌注損傷時,總5 hmc在損傷后24小時開始表達增加,隨著時間延長表達逐漸增高,到48小時達到高峰,線粒體5 hmc亦明顯增高,在24小時達高峰,隨后逐漸略有降低,但仍高于假手術組。與5 hmc相比,總5 mc在缺血后36小時明顯增加,而后隨著時間延長表達逐漸下降,線粒體5 mc未見明顯改變[30]。缺血性腦損傷時,也可出現TET2介導血液中5 hmc含量增加,在大腦中動脈閉塞小鼠模型中使用TET2抑制劑SC1減少TET2或敲除TET2可加重缺血性腦損傷[31]。可見在多種類型的腦缺血損傷中均可能出現5-hmc的改變。
表觀遺傳中非編碼RNA亦在許多神經系統疾病表觀遺傳調控中發揮重要作用,多種類型的非編碼RNA水平變化在慢性腦缺血導致的認知損害中占重要地位。多項研究表明非編碼RNA主要通過調節APP、BACE1等表達,影響突觸重塑、樹突變性、神經元活性等在慢性腦缺血及腦缺血引起的癡呆中發揮作用。慢性腦缺血時,在血清、腦脊液、海馬、皮質等區域可出現miR-9-5p、miR-96、miR-9等含量增加,通過增加BACE1及下調CREB含量引起學習記憶損害進一步發生癡呆,應用miR拮抗劑可減輕記憶損害等表現,且可挽救膽堿能神經元功能、神經元丟失、氧化應激、降低自噬體數量影響自噬過程等[32~34]。然而在神經系統尤其是海馬及皮質中高表達的非編碼RNA如miR-181c[35]在慢性腦缺血引起的低氧環境中出現表達降低,其高表達時可改善細胞活性及神經重塑,減少凋亡細胞數量。表明不同類型的非編碼RNA在慢性腦缺血時出現差異性變化,最終均可導致學習記憶損害甚至認知功能障礙等。
4 問題及展望
慢性腦缺血時,由于腦組織缺血缺氧引起膠質細胞激活、炎性反應、神經遞質紊亂等,長期持續性缺血缺氧可進一步導致能量衰竭、ATP耗盡以及大量活性氧系列(ROS)的產生從而導致神經元損傷,腦組織長期的這些改變可能引起表觀遺傳的變化,除此之外,引起慢性腦缺血眾多的危險因素如高齡、吸煙、飲酒、高血壓、糖尿病、高血脂等引發機體內環境改變也可能造成表觀遺傳的改變。因此在慢性腦缺血疾病進程中,究竟是腦缺血自身變化還是如年齡等危險因素的作用引起表觀遺傳改變需要進一步的研究探索。
表觀遺傳學作為一種可逆可遺傳性基因表達改變在各種疾病中發揮重要作用。已有相關研究顯示慢性腦缺血時表觀遺傳改變可引起學習、記憶損害,但目前對于兩者關系的研究相對比較局限,主要集中在少量動物實驗,尚缺乏臨床研究,主要涉及對DNA甲基化及組蛋白修飾研究,且研究結果存在差異,而大部分表觀遺傳改變的具體機制尚未明了,需要更多的基礎及臨床試驗證實兩者關系。在以后的研究中,除了需要進一步完善相關動物實驗更加明確兩者之間的關系外,我們更需要進一步探索臨床中慢性腦缺血患者表觀遺傳學變化情況,突破動物實驗的局限性,為慢性腦缺血預防及治療帶來突破性進展。

