胸腔積液細胞塊免疫組化檢測對胸腔積液的價值分析
李清苗
(河南省南陽市腫瘤醫院 病理科,河南 南陽 473000)
胸腔積液是臨床上較為常見的呼吸系統病癥,其主要的臨床特征為胸膜腔內病理性液體積聚,胸腔膜處于臟層與壁層胸膜之間,正常人體的胸膜腔內包含5~15 ml液體,主要在人體呼吸時起到潤滑作用,胸膜腔內每天形成與吸收約500~1 000 ml的液體,多種因素均可導致胸膜腔內液體發生變化,即引發胸腔積液[1-2]。目前,臨床上常采取細胞學涂片、蘇木精-伊紅染色法(hematoxylin-eosin staining, HE)、肺穿刺活檢、支氣管鏡活檢及活體組織活檢等方式對胸腔積液進行檢查,但因存在較多的限制條件,無法廣泛普及[3-4]。本研究主要分析胸腔積液細胞塊免疫組化檢測對胸腔積液的應用價值,現報道如下。
1 資料與方法
1.1 一般資料
選取2016年3月-2018年2月本院收治的84例胸腔積液待查患者作為研究對象,其中 男43 例,女41例;年 齡22~81歲,平 均(51.26±6.48) 歲。所有患者均行細胞學涂片、HE染色及細胞塊免疫組化檢測。本研究經院醫學倫理委員會審批同意。
1.2 入選標準
納入標準:①均需接受胸腔積液檢查的患者;②年齡>18歲;③患者均簽署知情同意書。排除標準:①合并嚴重的心、肝及腎等功能不全者;②精神障礙者;③依從性較差者。
1.3 方法
1.3.1 細胞涂片制備 將取出的胸腔積液標本置于室溫下30 min,利用吸管吸取50 ml容器接近底部處的胸水,并將其置于尖底離心管內,以2 500 r/min的速度離心5 min,離心后將上清液倒掉,保留沉淀物,利用醫用棉簽吸取沉淀物中多余的水分,隨后直接進行涂片,并將濕片置于濃度為90%的乙醇溶液中固定,置于通風柜中晾干,最終進行常規HE染色及閱片。
1.3.2 細胞塊制備 將取出的胸腔積液標本置于室溫下30 min,利用吸管吸取50 ml容器接近底部處的胸水,并將其置于尖底離心管內,以2 500 r/ min的速度離心5 min,離心后將上清液倒掉,保留沉淀物。在試管中加入5~10 m濃度為4%的中性甲醛,與沉淀物充分混合,置于室溫下固定1 h,離心后將上清液倒掉,再加入5~10 ml濃度為4%的中性甲醛,混合均勻后,固定1 h,再次將上清液倒掉,利用濾紙將沉淀物包好。利用全自動脫水機進行脫水處理及包埋,完成細胞塊制作,最終進行切片、常規HE染色及閱片。
1.3.3 免疫組化染色 利用細胞塊制作切片,厚度約為3 μm,采用EnVision兩步法進行測定,染色流程均嚴格按照試劑盒說明進行,抗體及工作液均由福州邁新生物技術開發有限公司提供。一抗使用廣譜免疫組化指標包括CK5/6(D5/16B4)、CK7(OV-TL12/30)、MOC-31、CD15(Carb-3)、Epithelial Antigen(Ber-EP4)、TTF-1(SPT24)、CEA(ZC23)、Calretinin(SP13)、WT-1(WT49) 及Desmin(D33),染色體均以磷酸緩沖鹽(phosphate buffer saline, PBS)代替一抗作為陰性對照,用已知的陽性切面作為陽性對照。一抗使用廣譜中支持間皮細胞的免疫組化指標包括CK5/6、Calretinin、WT-1及Desmin;支持肺腺癌的免疫 組 化指標 包 括CK7、MOC-31、CD15、Ber-EP4、TTF-1及CEA。
1.3.4 結果判定 ①HE染色觀察及敏感性分析:所有病例的HE染色情況均由兩名專業的病理醫師進行觀察,根據細胞形態、黏附性及核不典型性將其分為良性、惡性及無法確定。其中良性主要指細胞彌散,形態溫和,且無不典型性,即為反應性增生間皮細胞;惡性主要指細胞成團,細胞形態及核均為不典型性,均較嚴重,即轉移性腺癌與惡性間皮瘤細胞;無法確定主要指細胞彌散,細胞核的不典型性處于中重度,或形成細胞團,但細胞核的不典型性僅處于輕中度。②免疫組 化 陽 性 分 析:CK5/6、CK7、MOC-31、Ber-EP4、CEA及Desmin呈現黃色細胞質染色時則為陽性;TTF-1及WT-1細胞核呈現棕黃色染色時則為陽性;CD15細胞膜或細胞質均著色時則為陽性;Calretinin細胞質及細胞核均出現著色時則為陽性。
1.4 觀察指標
①對比單純細胞涂片HE染色及細胞塊免疫組化染色的結果;②分析轉移性腺癌細胞、惡性間皮瘤及反應性增生間皮細胞各抗體的陽性染色情況,并計算陽性率。
1.5 統計學方法
采用SPSS 25.0軟件處理數據。計數資料以百分比(%)表示,計數資料組間比較采用χ2檢驗;等級資料采用秩和檢驗;計量資料以均數±標準差(±s)表示,計量資料組間比較采用t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 單純細胞涂片染色與細胞塊免疫組化的診斷結果對比
單純細胞涂片HE染色及細胞塊免疫組化染色的結果對比,差異有統計學意義(P<0.05);最終確診為惡性類型的39例患者中,經細胞塊免疫組化檢測明確為惡性的有38例,誤診1例,診斷符合率為97.44%(38/39)。經肺和胸膜穿刺活檢證實肺腺癌30例,肺鱗癌3例,惡性間皮瘤3例;2例淋巴瘤經手術或活檢確診為彌漫大B細胞淋巴瘤及Burkitt淋巴瘤伴胸腔播散各1例;剩余1例誤診屬于轉移腺瘤,經組織學診斷為足跟部惡性黑色素瘤胸腔轉移。見表1。
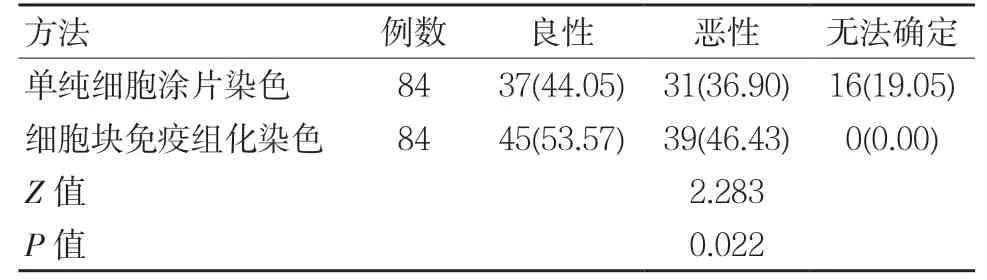
表1 HE染色與細胞塊免疫組化的診斷結果對比 例(%)
2.2 細胞涂片與細胞塊免疫組化染色結果對比
肺腺癌細胞對CK7、MOC-31、CD15、Ber-EP4、TTF-1及CEA的陽性表達率較高;間皮病變細胞對CK5/6、Calretinin、WT-1及Desmin的陽性表達率較高;上述抗體組合在肺腺癌與間皮病變(包括間皮腫瘤與反應性增生間皮細胞)的表達差異有統計學意義(P<0.05)。涂片免疫組化結果比較:轉移性肺腺癌涂片與間皮病變(包括間皮腫瘤與反應性增生間皮細胞)比較,差異有統計學意義(χ2=62.07、44.40、48.70、62.22、55.15、51.85、41.85、70.00、54.92、43.01,均P=0.000);細胞塊免疫組化結果比較:轉移性肺腺癌與間皮病變(包括間皮腫瘤與反應性增生間皮細胞)比較,差異有統計學意義(χ2=78.00、78.00、69.78、78.00、78.00、55.47、73.86、78.00、78.00、70.08,均P=0.000)。見表2。
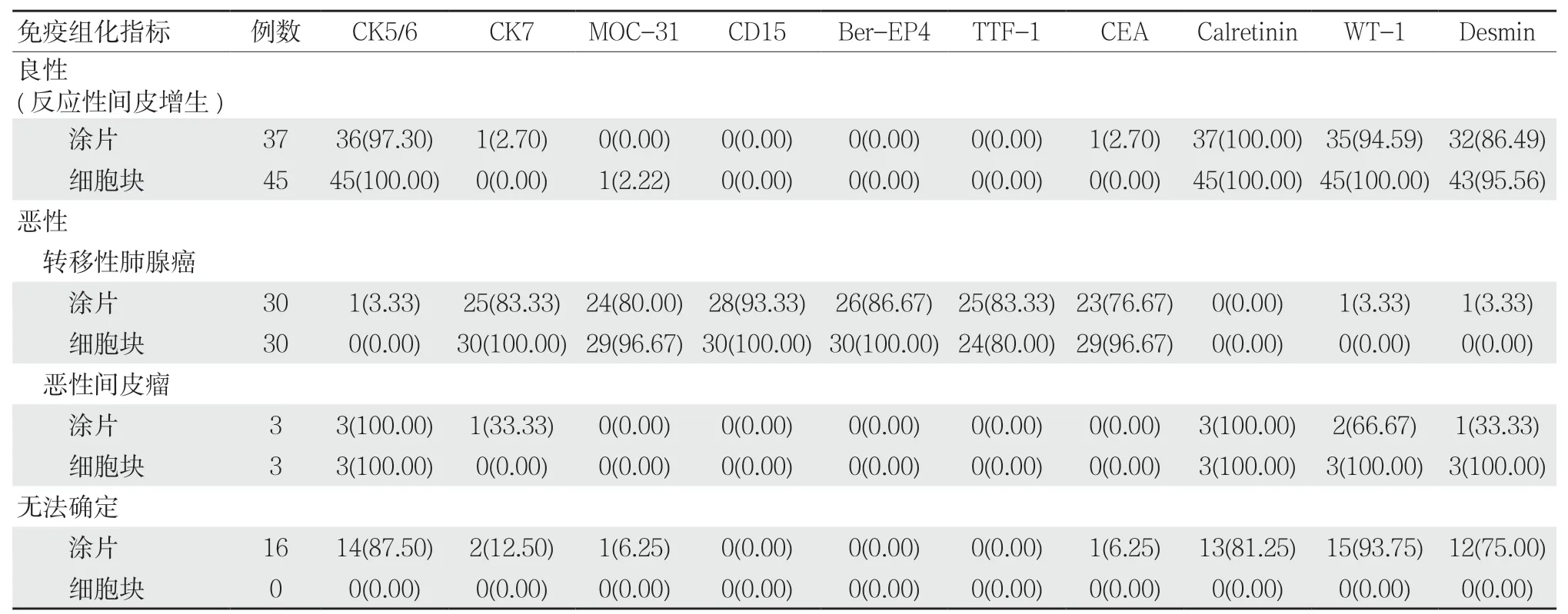
表2 84例胸腔積液細胞涂片與細胞塊免疫組化染色結果對比 例(%)
3 討論
胸腔積液的檢查方式較多,且容易獲取所需標本,但傳統的細胞學涂片易出現細胞成堆、成團、細胞角質化及細胞內黏液不明顯等問題,且胸腔積液中的細胞成分較為復雜,各類細胞的形態較為類似,尤其是增生的間皮細胞與腺癌細胞,無法進行有效鑒別。同時,細胞學涂片中的癌細胞較為分散,導致免疫組織化學染色陽性率偏低,且其無法反復操作,難以提供有價值的信息[5-7]。本研究結果顯示,單純細胞涂片染色檢測良性率為44.05%,惡性率為36.90%,無法確定率為19.05%。由于胸腔積液不僅發生于肺腺癌,腺癌、肺鱗癌及淋巴瘤等也可能形成胸腔積液,使鑒別難度大大增加[8]。因此,臨床中應進一步探討更加有效的診斷胸腔積液的方法。
細胞塊免疫組化檢測是目前最常用的檢測胸腔積液方法,收集胸腔積液中的癌細胞,并將其制成細胞塊,可獲取更多的腫瘤細胞數量,細胞結構更加清晰,且其可保持一定的組織學結構及排列方式,對病理學診斷更加有利,可有效提升腫瘤細胞的檢出率及準確率,為臨床治療提供依據[9-11]。本研究結果顯示,細胞塊免疫組化檢測良性率為53.57%,惡性率為46.43%,無無法確定病例,且最終確診的39例惡性患者中,經細胞塊免疫組化檢測明確為惡性的有38例,誤診1例,診斷符合率為97.44%,表明胸腔積液細胞塊免疫組化檢測可有效判斷胸腔積液細胞的類型及性質,提升胸腔積液的診斷符合率,降低漏診率及誤診率,可作為細胞病理診斷的理想方法;此外,細胞塊的制作具有操作過程簡單、易于保存及易于檢測等優勢,可在基層醫院推廣使用[12-13]。本研究結果顯示,肺腺癌細胞對CK7、MOC-31、CD15、Ber-EP4、TTF-1及CEA的陽性表達率較高;反應性增生間皮細胞及惡性間皮瘤對CK5/6、Calretinin、WT-1及Desmin的陽性表達率較高,上述抗體組合在肺腺癌與間皮病變間的表達存在差異性,表明上述抗體聯合應用可有效鑒別肺腺癌與間皮病變,且其特異性較強,與章文華[14]等研究結果基本一致,分析其原因在于多種抗體綜合可有效消除各抗體的表達差異,避免發生交叉反應,進而提升診斷陽性率及鑒別能力[15]。
綜上所述,胸腔積液細胞塊免疫組化檢測在胸腔積液檢測中具有較高應用價值,為臨床治療提供重要依據。

