醬油釀造過程中微生物多樣性分析方法研究進展
張書泰,周斌,童星,周其洋*
(1.佛山市海天(高明)調味食品有限公司,廣東 佛山 528500;2.廣東海天創新技術有限公司,廣東 佛山 528500)
醬油起源于中國,至今已有2500年的歷史,在中國、日本、韓國及東南亞國家作為一種重要的食品調味品[1,2]。醬油釀造最重要的兩個工藝環節是制曲和醬醪發酵[3,4]。其中,制曲階段主要是以曲霉(如米曲霉、醬油曲霉)代謝活動為中心進行固態發酵,生成的物質是構成醬油風味的源泉[5,6];醬醪發酵主要是以耐鹽性乳酸菌和耐鹽性酵母菌為主進行液體發酵,在這個階段生成大量的乙醇、甘油和醇類物質以及芳香族化合物,賦予醬油特殊的風味[7-9]。在醬油發酵過程中,微生物對醬油色、香、味和體態的形成和品質起到了極其重要的作用[10,11]。
自20世紀60年代開始,研究者開始對醬油發酵過程中的微生物多樣性進行研究,研究方法主要是傳統的平板分離培養技術[12]。后續隨著生物化學和分子生物學技術的發展應用,使微生物多樣性的研究方法不再局限于傳統的分離培養技術,運用非培養的生理生化方法和分子生物技術實現了對環境中89%~99%不可培養或未培養微生物的檢測,對微生物進行更全面而深入的了解[13]。本文介紹了研究傳統發酵食品微生物多樣性的多種方法,簡要地綜述了各技術的原理、優缺點及應用概況,以期為研究醬油釀造過程中微生物群落結構組成、演替和功能代謝及其對醬油風味的形成機理和對醬油品質的影響開拓新思路。
1 傳統微生物培養法
傳統微生物培養法根據目標微生物對不同碳源、氮源等營養物質的需求,在培養基中加入相應比例的營養成分,進行定時定溫培養,然后通過形態觀察,并結合生理生化特征等進行鑒定,分析不同可培養微生物的種類和數量。Tanaka等、Wei等[14]和Yan等[15]利用傳統微生物培養法對中國傳統醬油和日本醬油發酵過程中微生物變化分析得出,醬油制曲階段中乳酸菌為優勢菌群,其次為酵母菌和霉菌;醬醪發酵中雖然乳酸菌仍為優勢菌群,但數量與制曲階段相比降低了3~5倍。Cui等[16]研究發現醬油發酵整個階段中,乳酸菌、酵母菌和霉菌總微生物數量在春季最高,夏季最低;其中,乳酸菌和酵母菌數量變化與總微生物變化趨勢相一致;而霉菌在冬季數量最多,夏季數量變化最大。Tanasupawat等[17]利用微生物培養方法對泰國醬油醬醪中的乳酸菌數量和種類進行了分析,共分離純化得到44株乳酸菌,其中以Lactobacillusacidipisis和Tetragenococcushalophilus為主,其次為Lactobacilluspentosus,Lactobacillusplantarum和Lactobacillusfarciminis;同時,結合生理生化反應發現Lactobacilluspentosus可利用D-glucose產生DL-lactic,Lactobacillusplantarum細胞內含2,6-二氨基庚二酸,Lactobacillusfarciminis為異型發酵乳酸菌。這些研究揭示了醬油醬醪發酵中乳酸菌群落的結構和功能,為醬油發酵中乳酸菌的應用提供了參考依據。傳統微生物培養法有利于了解分離純化得到的微生物的形態特征和生理特性,對有價值的微生物進行保藏、應用等,但該方法在實際應用中工作量大、流程繁瑣,且人工模擬的環境與醬油發酵過程中微生物的生長環境存在一定偏差,不能準確反映微生物群落組成、分布及變化特征[18-20]。
2 磷脂脂肪酸(PLFA)分析法
不同的微生物細胞膜中含有不同種類和數量的磷脂脂肪酸,通過提取微生物細胞內的磷脂脂肪酸,利用氣相、氣質聯用等色譜技術測定其種類和含量并進行分類鑒定。目前,該方法多用于土壤微生物的研究,在醬油發酵過程中微生物多樣性的研究中運用較少,在白酒大曲、酸菜中有較多報道[21-24]。趙金松等采用PLFA技術分析了清香型大曲、濃香型大曲和醬香型大曲的微生物群落結構及其多樣性,結果表明不同類型的大曲微生物都以真菌(18:2ω6,9、18:1ω9)為優勢菌群,占脂肪酸總量的90%以上;細菌以G+(a14:0、i14:0、i15:0、a16:0、i16:0)為主;不同工藝大曲微生物群落結構存在明顯差異,隨制曲溫度升高,大曲微生物多樣性降低。Wu等利用PLFA分析了Lactobacillusplantarum和Zygosaccharomycesrouxii對中國酸菜發酵過程中微生物群落結構多樣性及酸菜風味形成的影響,檢測到酸菜發酵過程中微生物以G+(a14:0、i16:0)和真菌(18:2ω6,9、18:1ω9)為優勢菌群。Zhang等[25]運用PLFA方法對中國傳統發酵醬油不同發酵模式下醬醪發酵過程中微生物群落結構多樣性進行分析,包括高鹽稀態發酵(HSDS)和低鹽液態發酵(LSSS),實驗結果表明醬醪發酵中以G+((a14:0、i15:0、a15:0、a16:0、i16:0))和真菌(18:2ω9,11、18:1ω9、18:3ω9,12,15)為優勢菌群;發酵期間,HSDS醬醪真菌生物量高于LSSS醬醪,且在發酵中期(60天)生物量達到最大,之后降低。
由于某些磷脂脂肪酸在不同微生物類群中都有存在,造成不同微生物類群的磷脂脂肪酸出現重疊;且磷脂脂肪酸含量也會受到不同因素的影響而發生改變,比如溫度、pH值等;同時,微生物細胞內的磷脂脂肪酸也會隨著生長期變化而發生變化[26,27]。因此,磷脂脂肪酸分析法適用于對微生物生物量和群落結構的動態分析,但不適用于微生物群落種群分析。
3 分子生物學方法
隨著DNA提取技術、聚合酶鏈式反應(Polymerase Chain Reaction,PCR)技術的不斷發展,分子生物學技術越來越廣泛地應用于微生態學的研究,為發酵食品微生物群落多樣性的研究帶來了良好的契機[28,29]。
分子生物學以核糖體基因序列(rRNA)為研究對象,16S rRNA基因具有高度的保守性和高變異性,保守性能夠反映生物物種的親緣關系,高變異性則能反映生物物種特征核酸序列的差異性,以及擁有豐富的數據庫等優點,廣泛應用于原核微生物多樣性研究[30-32]。真核微生物多樣性研究主要基于18S rRNA基因、26S rRNA基因或5.8S rDNA間隔區的分析(ITS間隔區)的擴增和分析[33-36]。
3.1 基因指紋圖譜分析法
基因指紋圖譜技術是基于核酸分子成分、大小和構型上的差異,利用電泳方法將不同的核酸分子分離,形成不同分子量的基因條帶圖譜,根據圖譜上條帶信息進行基因分析的技術。基因條帶圖譜中,每個條帶代表不同的操作分類單位(Operational Taxonomy Unit,OTU),條帶數量反映微生物種群的多樣性和相對豐度。目前,基因指紋圖譜技術在發酵食品中應用較廣泛,有以下幾種類型。
3.1.1 DNA長度多態性圖譜分析
DNA長度多態性圖譜分析法是基于DNA長度多態性的研究方法,包括限制性片段長度多態性(Restriction Fragment Length Polymorphism,RFLP)分析法、擴增核糖體DNA限制性分析法(Amplified Ribosoma DNA Restriction Analysis,ARDRA)、末端限制片段多態性(Terminal Restriction Fragment Length Polymorphism,T-RFLP)技術、隨機擴增多態性DNA(Randomly Amplified Polymorphic DNA,RAPD)技術、擴增片段長度多態性(Amplified Fragment Length Polymorphism,AFLP)技術。
限制性片段長度多態性分析法(RFLP)是根據不同微生物種群基因限制性片段長度的差異,先將基因組DNA進行PCR擴增,利用限制性內切酶進行消化,經電泳分離形成長度多態圖譜,再根據圖譜條帶分子量大小和數量分析微生物群落結構和組成[37]。末端限制片段多態性(T-RFLP)技術和擴增核糖體DNA限制性分析法(ARDRA)是在RFLP基礎上發展而來的。末端限制片段多態性(T-RFLP)技術是在其中一個PCR擴增引物5'末端上加上熒光標記,將基因組DNA進行PCR擴增后,經限制性內切酶消化后進行電泳分離,分析其帶熒光標記的末端限制性片段多樣性。擴增核糖體DNA限制性分析法(ARDRA)是對擴增后的16S rDNA進行限制性酶消化,再根據電泳分離得到的多態圖譜分析微生物群落結構、組成。王彩虹[38]采用RFLP技術建立了汾酒清香型大曲、瀘州老窖濃香型大曲和郎酒醬香型大曲細菌和真菌群落結構,比較了不同類型大曲細菌和真菌多樣性;研究發現隨著制曲品溫的升高,耐溫性芽孢桿菌、高溫放線菌、嗜熱或耐熱霉菌比例也增加,同時也檢測到了傳統培養方法未檢測到的微生物,如枝芽孢桿菌(Virgibacillus)、糖多孢菌(Saccharopolyspora)、掃帚狀曲霉(Aspergilluspenicillioides)等。李艷等[39]從羊羔美酒大曲中分離出14種不同形態類型的酵母共474株,采用ITS-RFLP分析酵母菌多樣性,經基因序列發現14株不同形態的酵母分屬于6個屬的6種酵母菌,其中以釀酒酵母為優勢菌群。但是,RFLP、T-RFLP和ARDRA技術都存在一定的缺陷:操作繁瑣,對操作人員技術和儀器檢測精度要求高,以及圖譜中的每個條帶不一定對應一個菌種,影響微生物群落多樣性的評估[40]。
隨機擴增多態性DNA(RAPD)技術是以非限制性的隨機核苷酸為引物,對基因組DNA進行多態擴增,擴增產物經電泳分離,根據圖譜分析微生物基因組多態性。該技術的優點是對整個未知的基因組進行多態性分析,在物種分類和鑒定上應用較廣泛[41,42]。但是,由于引物篩選過于繁瑣,且隨機引物擴增的條帶過于復雜,不易分析。
3.1.2 DNA成分多態性分析
DNA成分多態性分析是利用雙鏈DNA在變性劑梯度或者溫度梯度下,部分解鏈形成單鏈DNA在聚丙烯酰胺變性凝膠上的遷移速率隨解鏈程度的增大而減小,形成不同序列的DNA圖譜條帶。DNA成分多態性圖譜分析技術包括時間溫度梯度凝膠電泳(Temporal Temperature Gradient Gel Electrophoresis,TTGE)、溫度梯度凝膠電泳(Temperature Gradient Gel Electrophoresis,TGGE)和變性梯度凝膠電泳(Denaturing Gradient Gel Electrophoresis,DGGE)。DGGE已成為研究發酵食品微生物多樣性最常用的手段之一,也是醬油釀造過程中微生物多樣性的研究中應用最廣泛的技術,表1展示了部分近些年DGGE技術在醬油釀造過程中微生物多樣性研究的概況。利用DGGE對醬油釀造過程中微生物多樣性的研究結果表明,醬油制曲過程中微生物多樣性程度較高,細菌主要以Weissellasp.,Staphylococcussp.,Bacillussp.,Lactobacillussp.為優勢菌群,真菌以Aspergillus,Candida,Trichosporonasahii,Pichia等為優勢菌群[43]。醬油發酵過程中,主要優勢微生物由制曲期間不耐鹽性和不耐酸性微生物演替成鹽水落黃發酵之后的耐鹽性和耐酸性微生物。其中細菌主要有:Weissellasp.,Staphylococcussp.,Lactobacillusfermentum,L.plantarum,Tetragenococcushalophilus[44]。真菌主要有:Zygosaccharomycesrouxii,Candidaetchellsii,Candidaversatilis,Rhodotorulasp.等。另外,還檢測到部分不可培養的微生物,如uncultured yeast。DGGE和TGGE檢測的準確性和靈敏性都很高,能夠分離出1 bp堿基差異的DNA片段。但是,對操作人員技術要求高,由于部分微生物存在異源雙鏈現象和對相似度近的微生物檢測性差異等因素,無法對微生物進行定量分析。

表1 部分DGGE技術在醬油釀造過程中微生物多樣性研究概況Table 1 Research status of microbial diversity in soy sauce brewing process by DGGE technology

續 表
3.2 宏基因組學
宏基因組是1998年Handelsman首次提出,將宏基因組定義為環境中全部微小生物遺傳物質的總和[45,46]。隨著高通量測序技術的不斷發展,宏基因組學被廣泛應用于自然環境微生物群落結構(如土壤、海洋等)、人體和動物腸道微生物群落結構、食品微生物群落結構的研究[47-52]。表2列舉了近幾年部分與食品微生物相關的宏基因組學研究,主要應用在奶制品、泡菜、普洱茶等發酵食品研究中。分析方法包括利用細菌和古細菌16S rDNA、真菌18S rDNA、28S rDNA和ITS分析食品微生物多樣性及對食品微生物宏基因進行測序,分析其群落功能和代謝途徑[53,54]。目前,宏基因組學在醬油釀造微生物的研究中應用較少,本文簡要介了宏基因組學在其他發酵食品中的應用進展,以供利用宏基因組學分析醬油釀造微生物研究做參考依據。

表2 部分與食品微生物相關的宏基因組學研究Table 2 Some metagenomic researches related to food microorganisms

續 表
注:項目信息由MG-RAST(http://metagenomics.anl.gov/)搜索獲得。
3.2.1 宏基因組學技術基本方法
3.2.1.1 提取總基因組DNA
DNA的提取方法可分為兩種,即原位裂解法和間接提取法(細胞分離提取法,見圖1)。原位裂解法主要是通過酶解法、變性劑等方法直接從樣品中提取微生物總DNA,該方法操作簡便,提取率高,但是提取的DNA片段小(1~50 kb),適用于構建小片段文庫的DNA提取。間接提取法是先用物理方法從樣品中分離微生物,然后采用溫和的方法提取微生物總DNA,該方法的操作較繁瑣,在分離微生物過程中可能造成部分微生物丟失,但是獲得的DNA片段大(20~500 kb),且純度高,適用于構建大片段文庫的DNA提取。
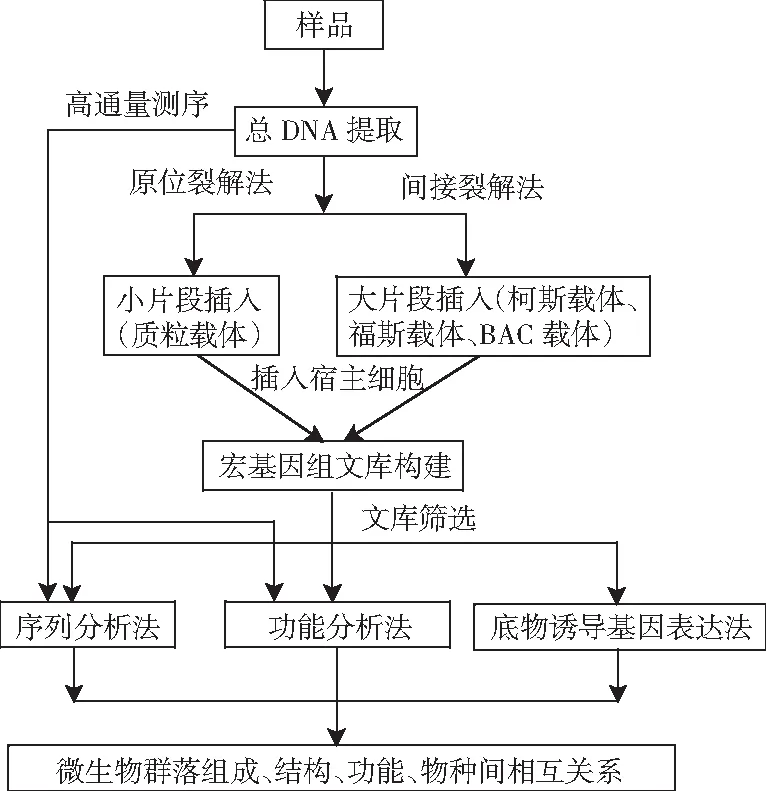
圖1 環境微生物宏基因組學研究方法Fig.1 Research methods for environmental microbial metagenomics
3.2.1.2 宏基因組文庫的構建
根據插入片段大小,將總基因組DNA克隆到質粒載體、柯斯載體、福斯載體或BAC載體中。再將克隆后的載體轉化到宿主細菌,構建基因組文庫,見圖1。
3.2.1.3 宏基因組文庫的篩選
由圖1可知,宏基因組文庫的篩選方法可分為:基于基因序列特異性差異的序列篩選法;基于基因活性的功能篩選法;基于底物誘導基因表達的篩選法[55]。
3.2.1.4 宏基因組學的分析
宏基因組學的分析方法主要是基于高通量測序技術和數據處理分析平臺對擴增子測序和全基因組測序結果進行分析。其中,以對16S rDNA擴增進行測序分析的方法最常用[56]。表3列舉了宏基因組學研究中部分常用的生物信息學平臺。通過數據處理分析平臺可以對序列進行前處理和分析,包括序列去噪、質量控制、序列拼接、分類學分析和序列功能預測等,進而分析微生物群落組成、群落功能、遺傳多樣性、微生物代謝的相互作用及其與環境因素的相互關聯等[57-59]。

表3 常用的生物信息學平臺及其主要工具Table 3 Commonly used bioinformatics platforms and their main tools

續 表
3.2.2 宏基因組學在發酵食品微生物研究中的應用
Almeida等[60]采用鳥槍法宏基因組學研究傳統發酵奶酪微生物群落功能基因庫,實驗分離出142株細菌。基于宏基因組序列分析,這些細菌分屬于67個屬、137個種,并構建117個基因組草圖,使得奶酪中細菌基因組增加2倍,為乳制品微生物群落研究提供了更多的基因數據源。Chen等[61]利用宏基因組學分析中國甘肅漿水菜發酵過程中真菌群落結構組成,研究發現漿水菜中真菌分屬4個菌門、10個種。其中Candidaxylopsoci為優勢菌群(占23.96%),其次為Sporopachydermiasp.,Cystofilobasidiaceae等,以及大量的未鑒定的真菌序列(占44.44%)。這些研究結果揭示了漿水菜中微生物群落結構組成,而大量的未鑒定菌群也暗示著漿水菜發酵過程中微生物多樣性豐富、代謝途徑復雜,有待進一步研究。Lyu等[62]運用宏基因組學分析普洱茶在渥堆發酵過程中微生物群落組成和群落功能,研究發現普洱茶在渥堆發酵中以細菌為優勢菌群,細菌以變形菌門(Proteobacteria)、放線菌門(Actinobacteria)和厚壁菌門(Firmicutes)為主要菌群,真菌以子囊菌門(Ascomycota)為優勢菌群。經KEGG代謝途徑分析,與萜類、酮類及其他次生代謝產物相關的69種酶基因分布于16種代謝途徑中,包括氨基酸代謝途徑、碳水化合物代謝途徑、核酸代謝途徑等。
傳統發酵醬油釀造過程微生物多樣性研究中,Wang等[63]利用宏基因組學分析中國傳統發酵醬油制曲到醬醪發酵過程細菌多樣性的變化,研究發現制曲階段細菌存在29個不同種屬,醬醪發酵階段有34個不同種屬。由制曲轉化至醬醪發酵有7個不同種屬的細菌消失,12個不同新種屬出現。Sulaiman等[64]運用鳥槍法宏基因組學對中國傳統發酵醬油為期6個月的醬醪發酵過程中微生物群落結構多樣性及微生物功能進行分析,實驗發現Weissella在發酵初期為優勢菌群,隨后Candida為優勢菌群,整個發酵過程中酵母數量增加,真菌豐度降低;而細菌豐度在發酵過程中先降低,到第6個月則增加。通過宏基因組的代謝重建,揭示了醬油發酵過程中蛋白質和碳水化合物異氧發酵的特征,與檢測到的發酵過程中乙醇含量和pH值下降情況相符合。其中,對編碼碳水化合物代謝途徑的基因進行分析,包括三羧酸循環(TCA循環)和磷酸戊糖途徑,發現從醬醪發酵第1個月開始代謝途徑由同型發酵轉為異型發酵,且與異型發酵乳酸菌相關性高。對編碼支鏈氨基酸基因進行分析,包括異亮氨基酸、亮氨酸和纈氨酸,發現Candida可能通過Ehrlich途徑代謝支鏈氨基酸,在發酵過程中由支鏈氨基酸轉氨酶、脫羧酶和乙醇脫氫酶作用產生芳香化合物。這些研究結果有助于我們更好地了解中國傳統發酵醬油發酵過程中微生物群落結構、功能演替和潛在的代謝能力。
另外,發酵食品安全也是發酵食品工業中的一個重要研究方向,宏基因組學技術在分析發酵食品安全問題中也發揮著重要作用。Park等[65]運用鳥槍法宏基因組學技術分析自然發酵的蝦、韓國泡菜和德國泡菜中的病毒種類,發現37%~50%的新序列,以雙螺旋DNA病毒Caudovirales為主,包括Myoviridae,Podoviridae和Siphoviridae。Jung等[66]運用宏轉錄組學技術研究朝鮮泡菜發酵過程中乳酸菌基因表達時也發現了大量噬菌體DNA序列。這些研究表明發酵食品中微生物種類和功能復雜,為發酵食品安全研究提供了更豐富的基因數據庫。但是,宏基因組學的研究及數據的分析很大程度依賴于現有微生物物種數據庫的豐富度,且生物信息分析對數據處理系統要求高,不同的算法對研究結果會產生很大的影響,這限制了對微生物新品種和新功能基因的研究和開發利用。
4 展望
隨著分子生物學技術的發展,我們對醬油釀造過程中微生物群落結構的研究不再受傳統微生物純培養技術的限制。近幾年,基于細菌16S rDNA和真菌18S rDNA(或25S rDNA~28S rDNA)或rDNA間隔區的分析,不僅克服了純培養的限制,豐富了醬油釀造過程中微生物多樣性,也提高了分析效率。特別是高通量測序和宏基因組學技術的不斷革新,以及生物信息學工具和大數據處理平臺的完善,不僅更真實地反映了醬油發酵過程中微生物組成、分布及演替,也讓我們進一步了解了醬油釀造過程中微生物代謝和功能演替。但是,每種微生物多樣性研究方法都有其優缺點,在研究工作中我們應當根據研究目的,選擇合適的一種或結合幾種研究方法進行研究,才能更有效地挖掘和利用微生物多樣性信息。
在未來的工作中,我們應該考慮醬油工業生產中,醬油發酵過程的主要優勢微生物和醬油生產工藝及生產環境之間的相互關系;了解醬油發酵過程中主要優勢微生物間的相互作用,探索如何通過微生物數據預測醬油發酵過程中存在的工藝問題,為醬油生產工藝優化和醬油質量控制提供參考依據。

