Ce0.8Sm0.2O1.9@TiO2異質結構電解質研究
童雨竹 劉清 陳碩 周翔 朱斌 董文靜

摘要:半導體與離子導體形成的異質結構可以極大地增強材料的離子電導率,其兩相界面能為離子傳輸提供較好的通道。以TiO2與Ce0.8Sm0.2O1.9(samarium doped ceria,SDC)為研究對象,分別通過濕化學法和干混法構造了兩種不同的異質結構復合材料。研究表明,利用濕化學法制備的SDC@TiO2異質結構復合材料(簡稱SDC@TiO2)作電解質的燃料電池在550℃下最大輸出功率密度為761 mW·cm-2,比用干混法制備的SDC-TiO2,異質結構復合材料(簡稱SDC-TiO2)作電解質的燃料電池的最大輸出功率密度高21%。與SDC-TiO2相比,SDC@TiO2具有更豐富的兩相界面.電化學阻抗譜顯示,以SDC@TiO2材料作為電解質的電池具有更低的歐姆電阻和極化電阻。
關鍵詞:固體氧化物燃料電池;Ce0.8Sm0.2O1.9;異質結構;兩相界面
中圖分類號:TM911.4文獻標志碼:A
固體氧化物燃料電池(solid oxide fuel cell,SOFC)是一種將化學能轉化為電能的能源轉換裝置,具有干凈、高效的特點,被認為是21世紀最有希望大量應用的綠色能源轉化裝置。傳統SOFC使用的電解質是Y2O3穩定的ZrO2(yttrium stabilizedzirconia,YSZ),該電解質在800-1 000℃的高溫下才具有足夠高的氧離子電導率(0.1 S.cm-1)。然而電池在高溫環境下長時間運行會導致其組成部件之間發生化學反應,由此會引發電極燒結、界面反應等問題,這不但增加了燃料電池的制作成本,而且加速了燃料電池系統的老化。為了解決這一問題,人們嘗試研發新的電解質,以降低燃料電池的工作溫度,并提高其電導率。
CeO2是典型的立方螢石結構,且在室溫到熔點的溫度范圍內不發生相變。摻雜CeO2電解質在500-800℃的電導率為10-3~10-1S·cm-1,是一種極具潛力的中、低溫電解質材料。為了進一步提高摻雜CeO2的離子電導率,Wang等提出了納米復合的概念,如Sm摻雜的CeO2(samarium dopedceria,SDC)與Na2CO3復合得到核殼結構材料。由于Na2CO3在高溫下為熔融態,其電導率在300℃以上顯著增加,比SDC的電導率增大約3個數量級。其他兩相復合材料的電導率也得以提高,比如Kim等的研究表明,在Gd摻雜的CeO2(gadoliniumdoped ceria,GDC)中加入摩爾分數為5%-7%的Al2O3可使材料的電導率明顯提高;Lan等發現,LiFeO2和LiAlO2復合材料體系的電導率高于LiFeO2和LiAlO2的電導率。
研究表明,兩相界面處品格失配形成的位錯能夠為氧離子傳輸提供快速通道,因此兩相界面區域對離子電導率具有重要影響。同時,研究發現,在多層膜異質結構中,離子電導率有極大的提高。早在2000年,Sata等指出,兩相界面的空間電荷區有利于離子傳導,在CaF2/BaF2多層膜中,保持薄膜總厚度不變的情況下,降低每層膜的厚度會使薄膜的電導率顯著提高。Garcia等研究發現,在SrTiO3與YSZ構建的薄膜異質結構中,外延應變和氧空位濃度的提高導致了其活化能的降低以及離子電導率近8個數量級的提高。Lee等構建了SrTiO3與垂直YSZ的納米異質結構薄膜。由于具有鈣鈦礦結構的SrTiO3與具有螢石結構的YSZ品格失配,垂直納米支架薄膜的兩相界面區域氧空位顯著增多,使得薄膜的電導率提高。
本文選取SDC和TiO2作為研究對象。分別利用濕化學法和干混法制備了兩種異質結構復合材料(下文簡稱復合材料),研究它們作為電解質時電池性能的差別,探討兩相復合體系中界面對離子傳輸的影響。
1試驗
1.1 樣品的制備
SDC的制備:以Ce(NO3)3·6H2O和Sm(NO3)3·6H2O2為原料,以NH4HCO3為沉淀劑,用共沉淀法制備SDC。具體方法如下:按照Ce3+和Sm3+的物質的量的比為4:1來配置濃度為0.1 mol·L-1的硝酸鹽混合溶液,然后向該溶液中逐滴加入濃度為1 mol·L-1的NH4HCO3溶液。在滴加的同時攪拌溶液,最后將溶液靜置2h,得到乳白色沉淀物。將沉淀物過濾、洗滌、烘干,然后在800℃保溫4h,冷卻后研磨得到SDC粉。
復合材料的制備:按照二乙酰丙酮二異丙醇鈦(體積分數為75%的異丙醇):無水乙醇=1:3的體積比配置TiO2前驅體溶液,再將0.5g SDC粉加入到1 mL的TiO2前驅體溶液中,攪拌均勻。將其在120℃烘干后繼續在500℃下保溫2h,冷卻后研磨得到SDC@TiO2異質結構復合材料(簡稱SDC@TiO2)。采用X射線熒光光譜儀(X-ray fluorescencespectroscopy,XRF)分析得到SDC@TiO2中SDC與TiO2的物質的量的比為5.66:1.00,計算得到SDC與TiO2的質量比為1.00:0.08。作為對比,稱取質量比為1.00:0.08的SDC粉和TiO2粉,用研缽研磨均勻,得到SDC-TiO2異質結構復合材料(簡稱SDC-TiO2)。
1.2樣品表征
采用波長色散型熒光光譜儀XRF-1800(島津)測定樣品的成分。采用D8X射線衍射儀(X-RayDiffraction,XRD)表征樣品的物相組成,使用Cu靶Ka射線,掃描范圍為10°-80°,掃描速度18(°).min-1。采用JSM7100F掃描電子顯微鏡(scanning electronmicroscope,SEM)和JEM-2100F透射電子顯微鏡(transmission electron microscope,TEM)觀測樣品微觀形貌。
1.3電池的制備及電化學性能測試
本文以LiNi0.8Co0.15Al0.05O2-δ為電極,SDC@TiO2和SDC-TiO2構造電池。將LiNi0.8Co0.15Al0.05O2-δ粉和松油醇調制成漿料均勻涂覆在泡沫鎳上,烘干,剪成直徑為13mm的小圓片作為電極。分別稱取0.3g SDC@TiO2和SDC-TiO2作為電解質,以200MPa的軸向壓力壓制成對稱結構的Ni-LiNi0.8Co0.15Al0.05O2-δ電解質LiNi0.8Co0.15Al0.05O2-δ電池。
以氫氣為燃料,空氣為氧化劑,使用可編程電子負載IT8511測量電池的輸出特性。使用GamryReference 3000電化學工作站測量電池在氫氣-空氣環境下的阻抗,頻率范圍1 MHz-0.1 Hz,振幅為10mV。工作溫度均為550℃。
2結果與討論
圖1(a)和(b)分別是SDC和TiO2的SEM圖。SDC呈不規則形狀,且尺寸分布范圍較廣,小至幾十納米,大至數十微米。TiO2由尺寸約幾百納米的顆粒構成。圖1(c)和(d)分別是SDC@TiO2和SDC-TiO2的SEM圖。SDC@TiO2中,SDC顆粒表面被TiO2均勻包裹,致密且顆粒尺寸均勻;SDC-TiO2中,SDC表面散落的TiO2分布比較稀疏,且有明顯的顆粒團聚。結果表明,SDC@TiO2中SDC與TiO2的接觸面積更大,能夠提供更多的兩相界面。
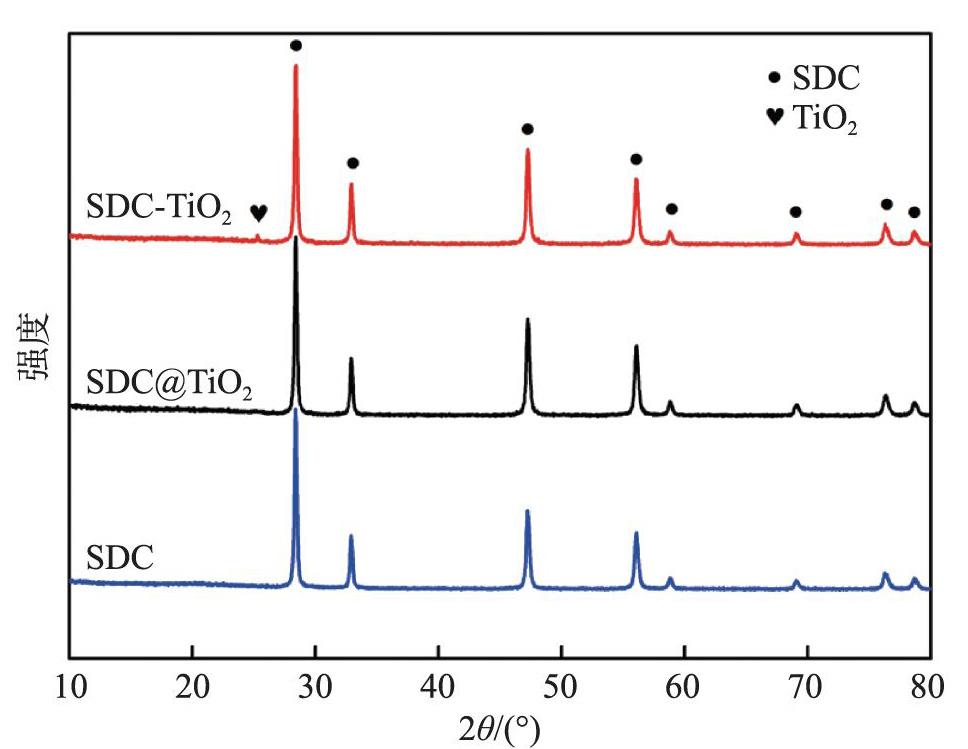
圖2是SDC-TiO2和SDC@TiO2及SDC的XRD譜圖。SDC的所有衍射峰與立方螢石結構的Ce0.8Sm0.2O1.9(PDF卡片號:75-0158)的衍射峰一一對應,表明制備的SDC是單一相。SDC-TiO2的XRD譜圖中不僅包括SDC的衍射峰,還出現了TiO2的衍射峰的主峰,此外未觀察到其他衍射峰,說明兩者沒有發生化學反應。SDC@TiO2的衍射峰中未觀察到TiO2的衍射峰,這可能是因為該樣品中TiO2較均勻地覆蓋于SDC的表面,且厚度過薄,超出了XRD的檢測范圍。相比之下,SDC-TiO2中,TiO2較大且存在聚集,所以其衍射峰能夠被檢測到。
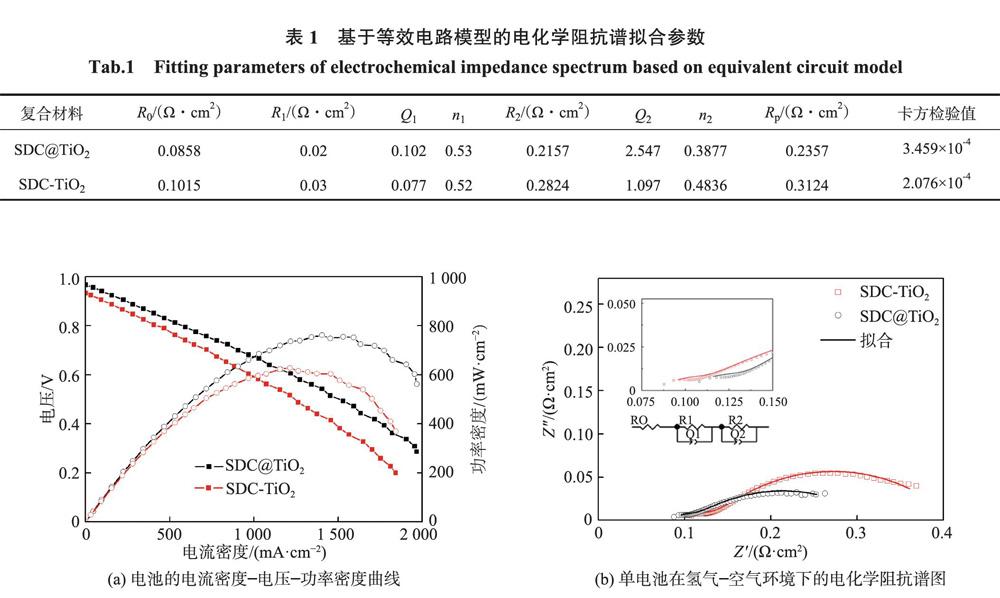
圖3是分別用SDC@TiO2和SDC-TiO2作電解質的電池在550℃時的電流密度-電壓-功率密度曲線和在氫氣一空氣環境下的電化學阻抗譜圖。圖3(a)表明,兩種電池的開路電壓均接近1 V,但SDC@TiO2電解質電池的最大輸出功率密度(Pmax)達到761 mW·cm-2,比SDC-TiO2電解質電池的Pmax高21%。圖3(b)是550℃時兩種電解質在電池環境下的電化學阻抗譜圖。表1是圖3中電化學阻抗譜基于等效電路模型的擬合參數。其中,R為電阻;Q為常相位角元件,n為常相位角元件指數,當n=1時常相位角元件表示純電容,當n=0時常相位角元件表示純電阻。高頻區半圓與x軸的交點對應電池的體電阻R0(也稱歐姆電阻),包括電解質中的離子輸運電阻和電極中的電子遷移電阻。高頻區電阻R1為界面電阻,即氧離子從陰極向電解質轉移的電阻,低頻區電阻R2反映了氧離子的吸附和解離過程。R1和R2的和表示為電極極化電阻Rp。從表1中可以看出,SDC@TiO2電解質電池具有更小的歐姆電阻Rn,說明SDC@TiO2復合材料電解質具有更高的離子輸運能力。這是因為相比于SDC-TiO2復合材料,SDC@TiO2復合材料中TiO2與SDC的接觸面積更大,能產生更多缺陷,為氧離子遷移提供快速通道。而SDC-TiO2中,盡管TiO2會附著在SDC顆粒表面,但兩者接觸不充分,兩相界面相對匱乏,氧離子大多只能在材料內部遷移,所以用SDC-TiO2復合材料作電解質電池的輸出性能較差。
圖4是SDC和SDC@TiO2的TEM圖。從圖4中可以看出,SDC中僅存在單一的SDC品格條紋,且顆粒表面界面清晰;而SDC@TiO2中的SDC被粒徑約為10mm的TiO2小顆粒較為均勻地包覆,形成了類似核殼結構。SDC的表面界面不再清晰,且能觀察到兩種晶向,分別是晶面間距為0.344nm的銳鈦礦相TiO2的(101)面和晶面間距為0.307nm的SDC的(111)面。
圖5是SDC@TiO2與SDC-TiO2的界面示意圖。SDC@TiO2中TiO2與SDC的接觸形式為面接觸,兩者界面處的品格失配產生大量氧空位,為氧離子傳輸提供通道。而SDC-TiO2中TiO2與SDC的接觸形式為點接觸,由于兩者接觸面積過小,品格失配問題不十分明顯,產生的界面氧空位數量較少。且兩者間過小的接觸面積導致晶界電阻增加,不利于氧離子快速遷移,該結果與圖3(b)的電化學阻抗譜結果一致。因此,與SDC-TiO2相比,SDC@TiO2提供了更豐富的兩相界面,有助于增強材料的氧離子輸運能力,獲得更高的電池輸出性能。
3結論
本研究比較了SDC與TiO2構造的兩種不同異質結構復合材料作為電解質的差別。采用濕化學法制備了SDC@TiO2,以此為電解質的電池在550℃時的開路電壓達到1V,最大輸出功率密度達到761 mW·cm-2,比用干混法制備的SDC-TiO2作為電解質的電池性能高21%。研究發現,SDC@TiO2中,TiO2均勻地包覆于SDC表面,形成類似核殼結構的形貌。該結構提供了較大的兩相接觸面積,兩種顆粒間的品格失配在界面處提供的位錯和氧空位等有利于氧離子傳輸。而SDC-TiO2中兩相接觸面積較少,其構造的電池中體電阻和界面電阻都高于SDC@TiO2電解質電池。

