RVVC致病白假絲酵母菌對小鼠陰道上皮侵襲性及局部免疫的研究
姚福強,盧 偉,祁文瑾
(昆明醫科大學第一附屬醫院產科,昆明 650032)
外陰陰道假絲酵母菌病(vulvovaginal candidiasis,VVC)是由假絲酵母菌引起的陰道黏膜和(或)外陰真菌感染,是婦產科常見的感染性疾病。研究顯示,VVC的發生與宿主防御機制及陰道上皮局部免疫功能變化相關[1-2]。上皮細胞在假絲酵母菌刺激下釋放多種免疫因子組成復雜的信號網絡,在局部免疫應答中起著調控作用[3-4]。細胞介導免疫(cell-mediated immunity,CMI)是陰道局部免疫抵抗假絲酵母菌感染的主要防御機制,其中輔助性T(helper T,Th)細胞及其細胞因子等在抗假絲酵母菌感染中發揮了重要作用[5]。但其確切機制尚不明確,本研究在小鼠陰道上皮細胞體外培養的基礎上檢測陰道局部免疫因子表達與真菌侵襲力的關系,以期為RVVC的發病機制提供新理論。
1 材料與方法
1.1材料
1.1.1致病白假絲酵母菌 所有致病白假絲酵母菌均來自本院婦產科門診VVC、RVVC患者。患者均知情同意,研究通過醫院倫理委員會批準。VVC、RVVC診斷標準以第8版婦產科學為依據。排除妊娠期、哺乳期、患糖尿病,口服避孕藥,3個月內接受過全身抗真菌治療或1個月內接受過外用抗真菌藥物治療,患免疫性疾病或正在服用免疫抑制劑、混合陰道感染者。
1.1.2實驗動物 小鼠購自昆明醫科大學SPF動物房,雌性,體質量23~27 g,動物合格證編號:SCXK(滇)K2015-0002。
1.1.3主要試劑 沙堡羅氏培養基(250 g,法國生物梅里埃公司);EpiLife cf kit(500 mL,美國Gibico公司);胎牛血清(500 mL,美國Gibico公司);0.25%胰酶+0.02%EDTA(100 mL,美國HyClone公司);中性蛋白酶Ⅱ(1 g,德國Sigma公司);小鼠IL-8、TNF-α、IL-4 ELISA試劑盒(4 pack,美國Ebioscience公司)。
1.2方法
1.2.1小鼠陰道上皮細胞的原代培養 斷頸法處死小鼠,消毒鋪巾解剖取出新鮮陰道上皮,用含雙抗的PBS清洗后放入含2 U/mL DispaseⅡ中并置于4 ℃冰箱過夜。分離上皮層分割成碎片,用2 mL 0.25%胰酶37 ℃消化15 min,含10%胎牛血清的DMEM/F12終止消化,輕輕吹打2 min吸出細胞懸液過濾,1 000 r/min離心5 min,棄上清液。加EpiLife重懸計數,按每毫升1×106個細胞接種于25 cm2細胞培養瓶,置于37 ℃、5%CO2培養箱培養;48 h首次換液,以后隔天換液,倒置相差顯微鏡觀察細胞生長情況。
1.2.2小鼠陰道上皮細胞傳代與鋪板、爬片制作 取生長匯合度90%的上皮細胞,1 mL 0.25%胰酶消化,等量含10%胎牛血清的DMEM/F12終止消化,1 000 r/min離心5 min,棄上清液。加EpiLife重懸并計數,按每毫升1×105個細胞接種于明膠處理的24孔板,繼續培養;將明膠處理的爬片置于24孔板中,爬片中點上方加2滴細胞懸液,置于培養箱30 min,沿孔邊加入1 mL EpiLife,繼續培養。
1.2.3致病白假絲酵母菌菌液配置 選取VVC、RVVC致病菌株各6株,復溫后挑取單菌落在沙堡羅氏培養基上轉種純化2次,挑取約1 mm單菌落加入1 mL EpiLife中,吹打混勻,計數調整密度為1×106CFU/mL。
1.2.4ELISA檢測IL-4、IL-8、TNF-α水平 鋪板24 h,換液。實驗組加1 mL EpiLife及致病菌懸液各1 mL與上皮細胞繼續培養6、12、24、48 h;對照組則以1 mL EpiLife代替菌液。實驗組及對照組陪養6、12、24、48 h取上清液以ELISA法檢測IL-4、IL-8、TNF-α水平。
1.2.5電鏡觀察致病菌對上皮細胞的侵襲過程 細胞爬片24 h,換液加1 mL EpiLife及100 μL上述VVC(VVC組)、RVVC(RVVC組)致病菌各1株菌液繼續培養6、12、24、48 h;對照組則以等量EpiLife代替菌液。掃描電鏡下觀察細胞形態學變化。
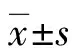
2 結 果
2.1體外培養小鼠陰道上皮細胞形態學特征 小鼠陰道上皮細胞體外培養傳代后,電鏡下可見所培養上皮細胞表面布滿皺褶微絨毛,呈不規則疏網狀,細胞觸角細長,細胞邊緣連接處,形成清楚的細胞分界線,細胞緊密相連、呈鋪石狀排列,見圖1。

圖1 小鼠陰道上皮細胞形態學(掃描電鏡×600)
2.2小鼠陰道上皮細胞與白假絲酵母菌共培養后的形態學變化 培養6 h后,VVC、RVVC組細胞微絨毛較對照組減少,部分細胞縮小,胞體變圓凸起呈滴狀,少量孢子附著。培養12 h后,VVC組少量孢子附著在細胞周圍,細胞間隙增大;RVVC組大量孢子聚集,細胞表面微絨毛減少、消失,部分孢子轉化為菌絲。培養至24 h,VVC組細胞被菌絲侵蝕,表面形成孔洞,部分細胞塌陷,胞質外溢,偶見殘缺的細胞輪廓和菌絲;RVVC組菌絲穿透細胞膜在細胞內生長,微絨毛消失,細胞萎縮,部分細胞殘缺不全,大量菌絲纏繞。培養至48 h,VVC、RVVC組均見大量殘缺不全的細胞殘骸并纏繞附著成團的菌絲,核中央形成空洞。RVVC致病白假絲酵母菌表現出比VVC致病菌更強的黏附性、穿透性、破壞性,見圖2。
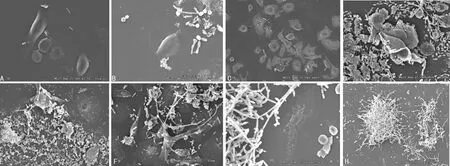
A:VVC組6 h(掃描電鏡×1 200);B:RVVC組6 h(掃描電鏡×1 000);C:VVC組12 h(掃描電鏡×400);D:RVVC組12 h(掃描電鏡×900);E:VVC組24 h(掃描電鏡×900);F:RVVC組24 h(掃描電鏡×900);G:VVC組48 h(掃描電鏡×1 200);H:RVVC組48 h(掃描電鏡×200)
圖2兩組電鏡掃描形態學分析
2.3小鼠陰道上皮細胞與白假絲酵母菌共培養后免疫細胞因子的表達情況 共培養12、24、48 h后,RVVC組IL-4、IL-8、TNF-α水平高于對照組(P<0.05);VVC組IL-4、IL-8水平在共培養12、24、48 h后高于對照組,而TNF-α水平在6、12、24、48 h均高于對照組(P<0.05)。RVVC組IL-8水平在6、12、24、48 h均明顯高于VVC組,TNF-α水平在24、48 h高于VVC組,差異有統計學意義(P<0.05),IL-4水平在兩組間差異無統計學意義(P>0.05)。培養6、12、24 h后,VVC、RVVC組的IL-8、TNF-α水平均逐漸升高(P<0.05),IL-4水平在共培養6、12、24 h逐漸升高(P<0.05),見表1。

表1 各組小鼠陰道上皮免疫細胞因子濃度
a:P<0.05,與對照組比較;b:P<0.05,與VVC組比較
3 討 論
成熟的鼠類陰道上皮細胞的培養方法主要有組織塊法和酶消化法。本研究采用酶分步消化法[6-7]。DispaseⅡ酶可成功分離上皮組織,具有細胞純度高、培養周期短的特點,可以快速獲得大量活性高的上皮細胞,能夠有效排除非上皮細胞的干擾[8-9]。掃描電鏡下細胞表面見許多微絨毛和脊樣胞質皺褶,符合典型的鱗狀上皮細胞特點,體外培養上皮細胞成功。
本研究選取VVC和RVVC的主要致病菌種白假絲酵母菌(占60%~80%[10])為研究對象。作為條件致病菌,假絲酵母菌以酵母相少量存在于陰道中不引起臨床癥狀,當陰道微環境的免疫低下時,酵母相轉變為菌絲相并大量繁殖,從而致病[11]。假絲酵母菌對上皮細胞的黏附、穿透、破壞導致了對細胞的侵襲作用,是VVC發生的關鍵事件[12-13]。結果顯示,白假絲酵母菌發芽形成菌絲并黏附于上皮細胞單層,然后上皮細胞吞噬部分菌絲,導致白假絲酵母菌介導的上皮細胞裂解。酵母相發展為菌絲相伴隨著對細胞的黏附、穿透,同時細胞被破壞逐漸加重、脫落死亡;RVVC致病菌的轉變時間更短、破壞性更強。表明RVVC致病菌的侵襲性強于VVC。
Th細胞包括Th1、Th2等不同的亞型,各自亞型通過表達細胞因子實現免疫應答作用。Th1表達IL-8、TNF-α等,IL-8通過正反饋調節中性粒細胞等活化、聚集,釋放出系列活性物質,介導陰道局部的抵抗性免疫反應,以殺菌和抑制細胞損傷[5];同樣TNF-α增強中性粒細胞和巨噬細胞的吞噬活性,介導炎癥相關免疫應答,增強機體對假絲酵母菌的抗性,清除病原體[14]。Th2分泌IL-4等,作為致病性細胞因子,IL-4響應于假絲酵母菌抑制Th1介導的噬菌作用,增加對假絲酵母菌的易感性[15]。
本研究通過對Th1免疫因子IL-8、TNF-α及Th2 免疫因子IL-4的研究發現,隨時間的增加對照組上清液中Th1免疫因子IL-8、TNF-α、IL-4水平呈上升趨勢,提示陰道上皮細胞可能是Th細胞免疫因子的重要來源,說明正常陰道上皮細胞在沒有外界刺激的情況下也分泌少量免疫因子,發揮防御作用。表明在無法順利獲取人類陰道上皮細胞的情況下,可采用小鼠陰道上皮細胞進行相關研究。在實驗組,感染后12 h的IL-8、TNF-α、IL-4水平上升,RVVC組中IL-8在感染中期(12 h)、TNF-α在感染后期(24 h)水平比VVC組升高,表明感染后上皮細胞出現了隨時間增強的抵抗性免疫反應,并且RVVC組的抵抗力更強;而Th2代表因子IL-4水平在感染6~24 h隨時間上升,但后期(24 h以后)則沒有變化,RVVC與VVC組之間IL-4亦無差異,推測IL-4可能僅在感染早期的致病菌易感性中起了一定的作用,但是在RVVC與VVC的致病均易感性中并沒有明顯區別。
在感染后期,Th1/Th2比值增大,局部Th1占優勢,陰道局部表現出對致病菌的抗性,對RVVC致病菌的抗性更強,表明Th1/Th2平衡在陰道局部免疫中具有重要作用;致病菌對上皮細胞的侵襲逐漸加重,RVVC菌株侵襲性更強。由此可見,致病菌侵襲性與陰道局部抵抗性免疫之間相互拮抗的結果和RVVC的演進(即病情好轉或加重)息息相關,本研究在小鼠陰道上皮細胞體外培養的基礎上,體外構建陰道模型,結合致病菌侵襲力和免疫功能變化,希望為RVVC的發病機制提供新理論,有助于設計更有效的RVVC治療方式。

