黃芩莖葉和藤茶抑菌作用及其聯合應用研究
張 琳,宿曉蓉,徐 園,許利嘉,朱振華,曾建國,趙 明*,段金廒*
1南京中醫藥大學 江蘇省中藥資源產業化過程協同創新中心 中藥資源產業化與方劑創新藥物國家地方聯合工程研究中心國家中醫藥管理局中藥資源循環利用重點研究室,南京 210023;2中國醫學科學院北京協和醫學院藥用植物研究所,北京 100193;3湖南農業大學 獸用中藥資源與中獸藥創制國家地方聯合工程技術研究中心,長沙 410128
中藥黃芩為唇形科植物黃芩ScutellariabaicalensisGeorgi.的干燥根,味苦性寒,為清熱燥濕、瀉火解毒常用藥[1]。近年來,隨著黃芩資源產業經濟的快速發展,黃芩種植面積不斷擴大,生產過程中產生了大量的黃芩莖葉且大都被廢棄不用,不僅造成了資源的巨大浪費,同時亦衍生了較重的社會和環境壓力。現代研究證實黃芩莖葉與根化學成分類別相似,均為黃酮類,根部作為藥用具有苦、寒之性,主要含有黃芩苷、漢黃芩苷、黃芩素、漢黃芩素等成分,而莖葉黃芩苷、漢黃芩苷、黃芩素、漢黃芩素等含量較低,野黃芩苷、芹菜素7-O-β-D-葡萄糖醛酸苷、白楊素7-O-β-D-葡萄糖醛酸苷等成分含量相對較高,減弱了根部苦、寒的藥性,但保留了清熱燥濕、瀉火解毒、消炎等功效[2]。研究發現黃芩莖葉及其成分對金黃色葡萄球菌、大腸桿菌、綠膿桿菌具有良好的抑菌效果[3-5]。
藤茶為葡萄科蛇葡萄屬顯齒蛇葡萄Ampelopsisgrossedentata(Hand.-Mazz.)W.T.Wang的嫩莖葉,是典型的民間藥食兩用藤本植物。據《中草藥匯編》、《廣西藥用植物名錄》、《廣東藥用植物手冊》等記載,該藥性味甘淡,功效清熱解毒,主治黃疸型肝炎、風熱感冒、咽喉腫痛等。藤茶在加工嫩枝干及生產操作中產生的碎葉片含有較高量的黃酮類成分,其中含量較高的二氫楊梅素可達到30%左右[6],且對大腸桿菌、金黃色葡萄球菌、痢疾桿菌等的生長具有較明顯的抑制作用[7]。
金黃色葡萄球菌和痢疾桿菌均可通過食物污染引起人類常發細菌性疾病,危害人體健康[8];在食源性動物養殖中,金黃色葡萄球菌可引起食源性動物的傷口感染、乳腺炎、關節炎、腹瀉等多種疾病,是奶牛乳房炎的主要致病因素之一,對食品安全及產業發展影響較大[9]。
本文以金黃色葡萄球菌和痢疾桿菌為研究對象,探究黃芩莖葉和藤茶的聯合抑菌作用,以期為黃芩莖葉的資源化利用提供科學依據。
1 儀器與材料
DHG-9023A 型電熱恒溫鼓風干燥箱(上海昕儀),TDL-80-2B型離心機(上海安亭),FW80型高速萬能粉碎機(天津泰斯特),超凈工作臺,恒溫生化培養箱,Quitix125D電子天平(德國賽多利斯),IS-RDV1型恒溫振蕩器(美國精騏),KH-500型超聲波清洗器(昆山),S-B50L型立式壓力蒸汽滅菌器(江蘇省金壇市醫療器械廠),96孔微量板(美國 Coring 公司),可調式移液槍(美國 Eppendorf 公司)。注射用青霉素鈉(批號:H23020943);MH肉湯 (南京森貝伽生物科技有限公司)。金黃色葡萄球菌Staphylococcusaureus(ATCC 25923)、痢疾志賀氏菌Shigelladysenteriae(CICC 23829)。
黃芩莖葉,2017年8月采集于陜西省商洛,經南京中醫藥大學段金廒教授鑒定為唇形科黃芩屬植物黃芩ScutellariabaicalensisGeorgi.的干燥莖葉,憑證標本存放于南京中醫藥大學江蘇省中藥資源產業化過程協同創新中心(編號SB-201708)。藤茶樣品由中國醫學科學院藥用植物研究所許利嘉副研究員提供并鑒定為葡萄科蛇葡萄屬顯齒蛇葡萄Ampelopsisgrossedentata(Hand.-Mazz.)W.T.Wang的嫩莖葉,憑證標本存放于南京中醫藥大學江蘇省中藥資源產業化過程協同創新中心(編號AG-201701)。
2 方法
2.1 樣品制備
2.1.1 黃芩莖葉黃酮富集部位(SSTF)
干燥黃芩莖葉,粉碎,10倍量70%乙醇熱回流提取3次,減壓回收溶劑后得黃芩莖葉醇提物。醇提物經石油醚萃取,萃余部分用30%乙醇溶解,經AB-8大孔樹脂柱層析,收集60%乙醇洗脫餾分,濃縮并冷凍干燥,得黃芩莖葉黃酮富集部位(SSTF),該部位黃酮含量為22.42%,其中野黃芩苷的含量為6.14%。
2.1.2 藤茶醇提物(TE)
干燥藤茶,粉碎,10倍量70%乙醇熱回流提取3次,減壓濃縮并冷凍干燥,得藤茶醇提物(TE),測得藤茶中二氫楊梅素的含量為23.47%。
2.1.3 樣品儲備液
用滅菌MH肉湯將SSTF和TE分別配置成32、4 mg/mL的儲備液。
2.2 菌懸液的制備
將各試驗菌株接種于LB固體培養基,37 ℃活化培養增菌 18~24 h,取單個菌落于LB液體培養基中,37 ℃培養18~24 h。用滅菌MH肉湯培養基調整濁度至0.5麥氏(約為 1.5 × 109CFU/mL),備用。
2.3 SSTF和TE最小抑菌濃度(MIC)的測定
參照美國臨床標準協會(CLSI)M07-A9微量肉湯稀釋法[10]。600 nm OD值為1的菌液用麥氏比濁管稀釋至0.5麥氏比濁度,繼續稀釋1 000倍得到試驗用菌液(約為1.5 × 106CFU/mL),備用。分別測定SSTF和TE對金黃色葡萄球菌和痢疾桿菌兩種試驗菌株的MIC值。在滅菌96孔平底微量板上,第1列每孔加入100 μL供試藥液和100 μL的MH肉湯培養基,混勻后,自第1列每孔取100 μL加至第2列每孔,并于第2列每孔續加100 μL的MH肉湯培養基,混勻,依次按上述2倍稀釋法將SSTF和TE分別稀釋至8~0.062 5 mg/mL 和 1~0.007 8 mg/mL。同時做空白培養基對照、氯霉素和注射用青霉素鈉陽性藥物對照。最后,各孔加入試驗菌株的菌懸液100 μL(約為1.5 × 106CFU·mL-1)。置于37 ℃培養箱中培養 18~24 h,觀察細菌生長狀態,并用酶標儀檢測各孔OD (600 nm)值。試驗重復3次,每次平行3個復孔,取平均值測得SSTF、TE對金黃色葡萄球菌和痢疾桿菌的MIC值。
2.4 SSTF和TE的24 h時間—殺菌曲線
采用時間—殺菌曲線試驗法[11],考察SSTF和TE對金黃色葡萄球菌、痢疾桿菌的殺菌效果。以各試驗菌株的MIC值為依據,將SSTF和TE分別配置為1/2 × MIC、1 × MIC、2 × MIC、4 × MIC和8 × MIC濃度,各濃度取2 mL加入試管,再加入1.5 × 108CFU/mL的菌懸液2 mL,另取兩支試管,其中一支試管加4 mL培養基做空白對照,另一支試管加入2 mL培養基和2 mL菌懸液做菌對照。于37 ℃下振蕩培養,并于0、2、4、6、8、12、24 h分別取100 μL菌懸液,10倍倍比稀釋后,取100 μL稀釋液均勻涂布于LB固體平板上。37 ℃培養18~24 h后進行菌落計數。以時間點為橫坐標,以不同時間點生長的菌落數的對數為縱坐標繪制時間殺菌曲線。試驗重復3次,每次平行3份。
2.5 SSTF和TE聯合用藥指數的測定
采用微量棋盤稀釋法[12],測定SSTF和TE聯合應用的抑菌效果。在96 孔平底微量培養板上,以二維棋盤的縱向(A~H)和橫向(1~12)兩個方向,根據兩藥單用時對試驗菌株的MIC值,將兩藥分別以4 × MIC~1/16 × MIC的質量濃度聯合應用,每孔加入50 μL供試藥液。最后加入1.5 × 106CFU/mL的菌懸液100 μL。在37 ℃下培養 18~24 h后觀察各孔中細菌生長情況,通過酶標儀檢測各孔600 nm OD值。試驗重復3次,每次試驗平行3個復孔。FIC指數 =C(SSTF 聯合)/MIC(SSTF 單用)+C(TE 聯合)/MIC(TE 單用),式中的MIC(SSTF 單用)和MIC(TE 單用)分別為SSTF和TE單用時的最低抑菌濃度,C(SSTF 聯合)和C(TE 聯合)為兩藥聯用時MIC濃度下兩藥各自的濃度。(對于同一塊96孔板,計算數據獲得一系列FIC指數值,若FIC指數≤0.5,兩藥具協同作用;0.5
3 結果
3.1 SSTF和TE對金黃色葡萄球菌的抑制作用
3.1.1 SSTF和TE對金黃色葡萄球菌的抑菌曲線及MIC測定
SSTF和TE對金黃色葡萄球菌的抑菌曲線如圖1,由圖中可以看出,SSTF和TE對金黃色葡萄球菌MIC值分別為1.0 mg/mL和0.25 mg/mL,陽性對照青霉素的MIC為 0.25 μg/mL。
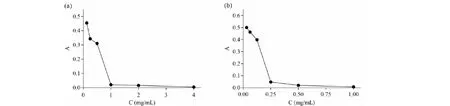
圖1 SSTF(a)和TE(b)對金黃色葡萄球菌的抑菌作用Fig.1 Antibacterial effects of SSTF (a) and TE (b) against S.aureus
3.1.2 SSTF和TE對金黃色葡萄球菌的時間-殺菌曲線
SSTF和TE對金黃色葡萄球菌的時間-殺菌曲線分別如圖 2(a)、2(b)所示。由圖可知,空白對照樣品中的金黃色葡萄球菌菌落數隨培養時間增加而持續上升至飽和后趨于穩定,而添加SSTF和TE的樣品中菌落數隨培養時間增加而下降,表明細菌生長受到明顯的抑制。
圖2(a)所示,濃度為1×MIC的SSTF樣品中金黃色葡萄球菌菌落數量明顯低于空白對照組,并于4 h達到最低,說明MIC條件下SSTF可有效抑制金黃色葡萄球菌生長,4 h時達最強抑菌效果。當SSTF濃度為2×MIC、4×MIC時,菌落數隨著時間持續下降,12 h后菌落全部死亡,表明添加2×MIC及以上濃度的SSTF對金黃色葡萄球菌具有良好抑制和殺滅作用。

圖2 不同濃度SSTF(a)和TE(b)對金黃色葡萄球菌的時間-殺菌曲線Fig.2 Time-bactericidal curves of SSTF (a) and TE (b) against S.aureus under different concentrations
如圖2(b)所示,MIC條件下TE可有效抑制金黃色葡萄球菌生長,6 h時達最強抑菌效果。2×MIC及以上濃度TE對金黃色葡萄球菌具有良好抑制和殺滅作用。
3.1.3 SSTF和TE聯用對金黃色葡萄球菌的抑菌結果
SSTF聯合TE對金黃色葡萄球菌的抑制活性OD值測定結果見圖3。以空白培養基和非加藥組的數值為指示OD值,OD值大于0.1的數值標記為灰色,即有菌生長,OD值小于0.1的數值標記為黑色,即無菌生長。由結果可知,在1/4×MIC SSTF-1/2×MIC TE和1/2×MIC SSTF-1/4×MIC TE的作用下,兩藥聯合使用開始表現明顯的抑菌作用。

圖3 SSTF及TE對金黃色葡萄球菌的抗菌作用Fig.3 Antibacterial effects of SSTF and TE against S.aureus
基于SSTF和TE聯合應用時的最低抑菌濃度計算相應的FIC值,并對兩者聯合作用進行評價。由表1中FIC值可以推斷:SSTF和TE聯合應用,對金黃色葡萄球菌生長抑制具有相加作用。
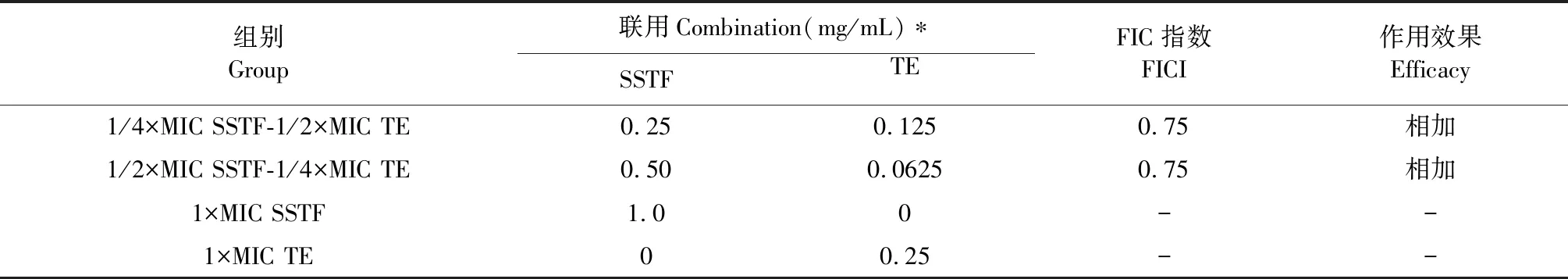
表1 SSTF和TE對金黃色葡萄球菌的聯合抗菌作用
注:*兩藥聯用時MIC濃度下各藥的濃度。
Note:Concentration of each drug at MIC concentration in two drug-associated drugs.
3.2 SSTF和TE對痢疾桿菌的抑制作用
3.2.1 SSTF和TE抑菌曲線及MIC測定
SSTF和TE對痢疾桿菌的抑菌曲線如圖4,由圖可知,SSTF和TE對痢疾桿菌的MIC值分別為4 mg/mL和0.5 mg/mL,陽性對照氯霉素的MIC為10 μg/mL。{
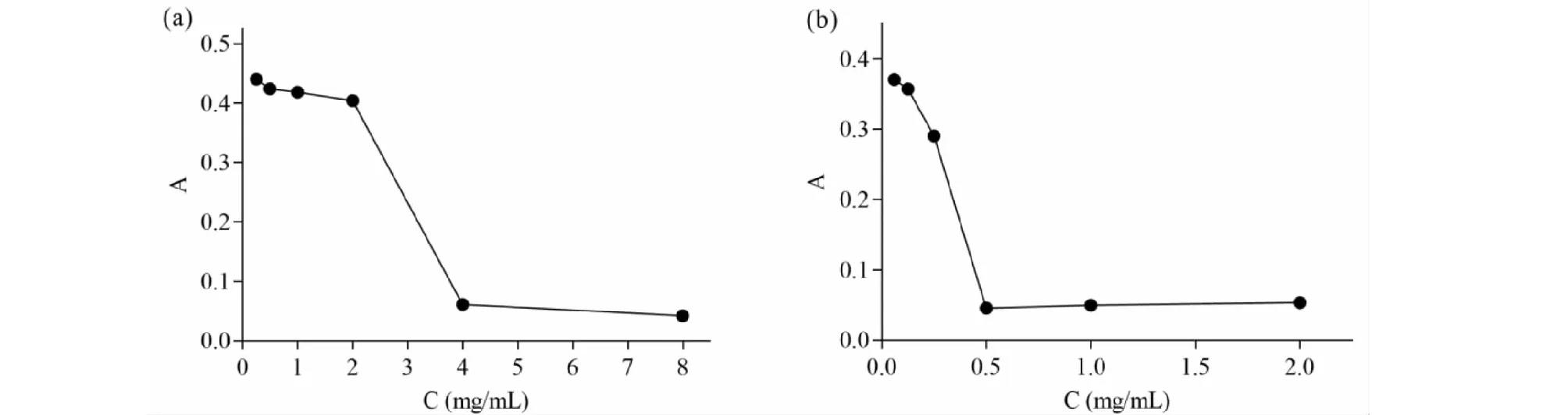
圖4 SSTF(a)和TE(b)對痢疾桿菌的抑菌作用Fig.4 Antibacterial effects of SSTF (a) and TE (b) against S.dysenteriae
3.2.2 SSTF和TE對痢疾桿菌的時間-殺菌曲線
SSTF和TE對痢疾桿菌的時間-殺菌曲線分別如圖 5(a)、5(b) 所示。由圖可知,空白對照樣品中的痢疾桿菌菌落數隨培養時間增加而持續上升至飽和后趨于穩定,而添加SSTF和TE的樣品中菌落數隨培養時間增加而下降,表明細菌生長受到明顯的抑制。
與空白組對照,當加入濃度為1×MIC的SSTF時,菌落數量明顯低于空白對照組,對痢疾桿菌的生長起到了抑制作用。當加入濃度為4×MIC和2×MIC的SSTF時,菌落數隨時間持續下降,并于8 h后全部死亡,說明添加2×MIC及以上濃度SSTF對痢疾桿菌具有殺滅作用(圖5(a))。
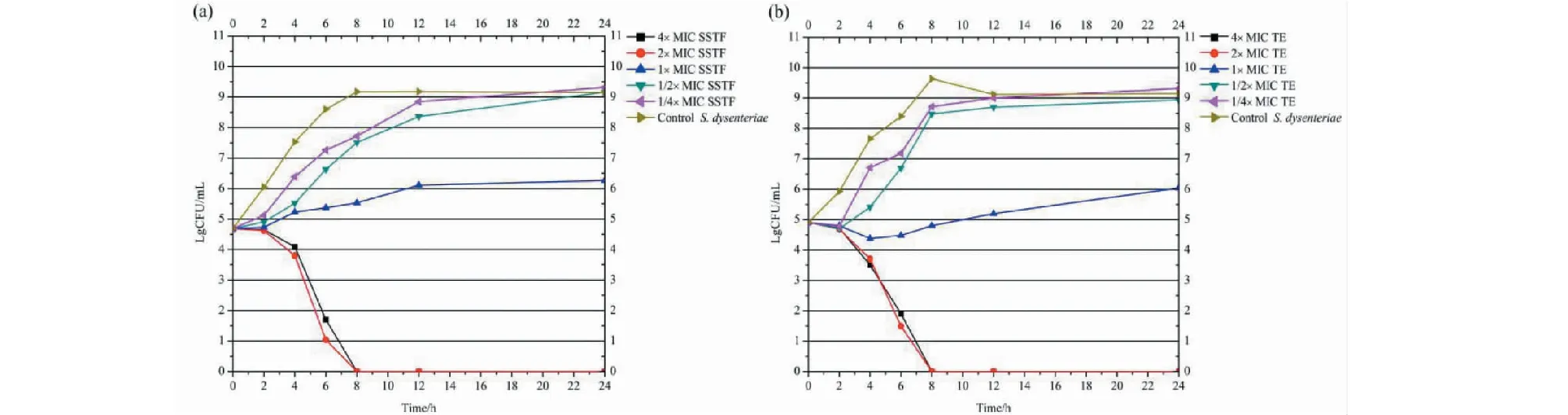
圖5 不同濃度SSTF(a)和TE(b)對痢疾桿菌的時間-殺菌曲線Fig.5 Time-bactericidal curves of SSTF (a) and TE (b) against S.dysenteriae under different concentrations
如圖5(b)所示,當加入濃度為MIC的TE時,菌落數明顯小于對照組且隨時間上下浮動較小,說明該藥對痢疾桿菌的生長具有抑制作用。當加入濃度為 2×MIC、4×MIC 的TE時,菌落數隨時間持續下降并于8 h后全部死亡,說明添加2×MIC及以上濃度TE對痢疾桿菌具有殺菌作用。
3.2.3 SSTF和TE聯用對痢疾桿菌的抑菌作用
SSTF聯合TE對痢疾桿菌的抑制活性OD值測定結果見圖6,以空白培養基和非加藥組的數值為指示OD值,OD值大于0.1的數值標記為灰色,OD值小于0.1的數值標記為黑色。結果顯示,在1/4×MIC SSTF-1/2×MIC TE、1/2×MIC SSTF-1/4×MIC TE、1/2×MIC SSTF-1/8×MIC TE作用下,聯合用藥開始表現明顯的抑菌作用。
基于SSTF和TE聯合應用時的最低抑菌濃度計算相應的FIC值,并對兩者聯合作用進行評價。由表2中FIC值可以推斷:SSTF和TE聯合應用,對痢疾桿菌生長抑制具有相加作用。
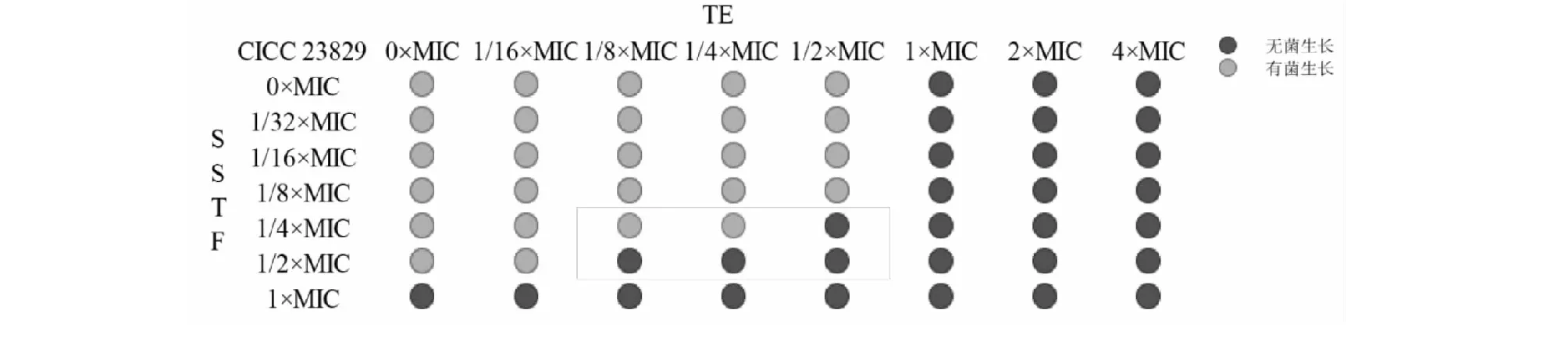
圖6 SSTF和TE聯合對痢疾桿菌的抗菌作用Fig.6 Antibacterial effects of SSTF and TE against S.dysenteriae
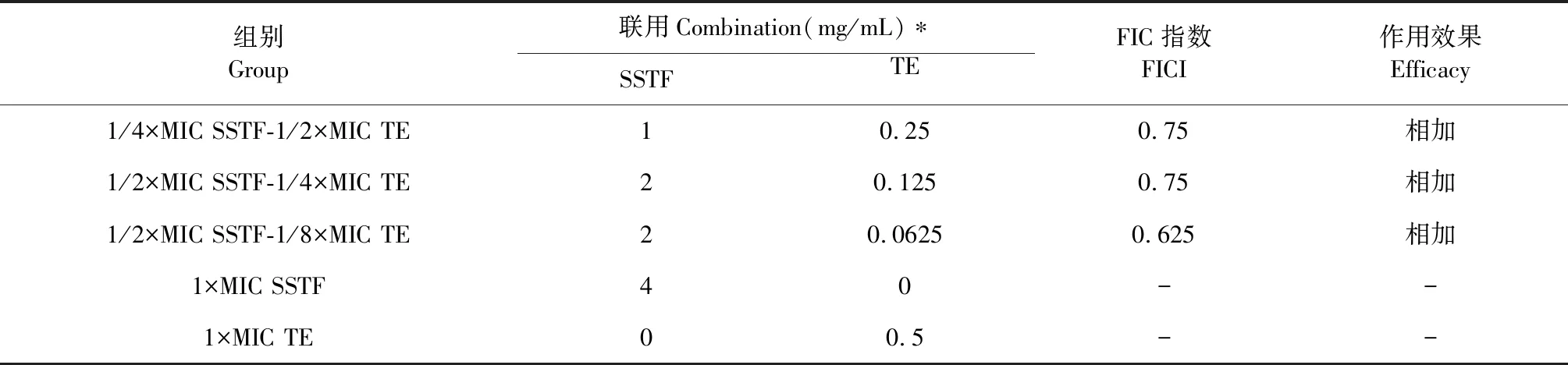
組別Group聯用Combination(mg/mL)?SSTFTEFIC指數FICI作用效果Efficacy1/4×MIC SSTF-1/2×MIC TE10.250.75相加1/2×MIC SSTF-1/4×MIC TE20.1250.75相加1/2×MIC SSTF-1/8×MIC TE20.06250.625相加1×MIC SSTF40--1×MIC TE00.5--
注:*兩藥聯用時MIC濃度下各藥的濃度。
Note:Concentration of each drug at MIC concentration in two drug-associated drugs.
4 討論
金黃色葡萄球菌及痢疾桿菌是引起人類常發食源性疾病的主要原因之一。金黃色葡萄球菌可產生腸毒素,感染后引起惡心嘔吐、腹部痙攣、水性或血性腹瀉等胃腸道癥狀;而痢疾桿菌感染后則會出現發熱、腹痛、腹瀉、嘔吐等典型癥狀[9]。金黃色葡萄球菌還可引起食源性動物的傷口感染、乳腺炎、關節炎、腹瀉等多種疾病,是引起牛乳房炎的主要致病菌之一。目前全世界奶牛乳房炎感染率高達50%左右,我國奶牛乳房炎的平均感染率為70%(包括隱性型乳房炎)[13]。
本研究證實了黃芩莖葉與藤茶對金黃色葡萄球菌和痢疾桿菌均具有抑制作用,并通過時間-殺菌曲線證明在一定濃度下黃芩莖葉和藤茶均可對金黃色葡萄球菌和痢疾桿菌呈現殺菌作用。本文參照抗菌素聯合作用常用的FIC指數值評價法,證實黃芩莖葉與藤茶聯合應用抗菌具有相加作用,可在一定程度上起到對食源性疾病的預防作用。
本研究僅對黃芩莖葉同藤茶聯合應用的抑菌作用做了初步探究,初步例證了基于聯合應用策略從中藥資源非藥用部位發展應對致病菌感染有效措施的可行性。除了直接抑殺作用,中藥資源尚可通過抗炎[14](抑制炎癥因子表達、調節炎癥相關信號通路)、增強溶菌酶活性、降解內毒素、影響內毒素釋放、機體免疫調節等多個環節發揮防治致病菌感染疾病的作用。如黃芩苷對金黃色葡萄球菌致乳房炎具有明確抗炎作用,同時可增強實驗動物溶菌酶活性[15],可降解革蘭氏陰性菌內毒素[16];黃芩素可作用于革蘭氏陰性菌第三分泌系統,影響毒力因子的合成與釋放等[17]。而黃芩莖葉中包括黃芩苷、黃芩素在內的黃酮類成分,具備了標(抗炎等)本(殺菌)兼治相關致病菌感染疾病的物質基礎。因此,可基于聯合應用策略全面提升黃芩莖葉抑菌、抗炎、對抗毒力因子等功效,最終實現黃芩莖葉在食源性動物養殖及人類臨床防治相關致病菌感染的資源化利用,不僅可解決其資源化利用問題、緩解環境壓力,尚可一定程度上減少抗生素的使用,具有多重意義。

