小檗堿對乳腺癌MDA-MB-231細胞增殖抑制作用及其分子機制研究
錢 潔,譚佳妮,程海波,沈衛星,徐長亮,劉陶世,孫東東*
1南京中醫藥大學轉化醫學研究中心 國家中醫藥管理局名醫驗方評價與轉化重點研究室 江蘇省抗腫瘤驗方研究與 產業化工程實驗室;2南京中醫藥大學藥學院;3江蘇省中醫藥防治腫瘤協同創新中心,南京 210023
小檗堿(Berberine)是一種臨床上廣泛使用的天然藥物,屬于季銨型異喹啉類生物堿,其存在于很多中藥中[1-3],常用于治療由細菌感染引起的胃腸道疾病。近年報道發現,小檗堿在體外具有抗腫瘤活性,其機制主要集中在抑制腫瘤細胞增殖和擴散、干預細胞生長周期、影響細胞能量代謝以及誘導腫瘤細胞凋亡等[4]。乳腺癌作為主要在女性中發病的惡性腫瘤,小檗堿針對其顯示較好的藥效活性,但是小檗堿與乳腺癌治療相關的具體作用機制尚不明晰,亟需補充完善[5]。本研究采用分子生物學技術研究小檗堿對乳腺癌MDA-MB-231細胞增殖的抑制作用,考察小檗堿對腫瘤細胞凋亡的影響,同時檢測腫瘤相關通路蛋白表達,為進一步闡明小檗堿抗腫瘤機制提供依據。
1 材料與方法
1.1 試驗藥物
小檗堿購自美國sigma公司(貨號B3240),純度為99%。3-MA購自MedChemExpress公司(貨號HY-19312)。精密稱取10 mg小檗堿粉末溶于二甲基亞砜(DMSO)中,超聲助溶,配制成母液,-20 ℃低溫儲存,臨用前再以培養基配成實驗所需濃度試液,用0.22 μm的過濾器除菌,根據需求進行濃度梯度稀釋。
1.2 細胞
MDA-MB-231乳腺癌細胞購自中國科學院上海生科院細胞資源中心,培養于含10% FBS,100 U/mL青鏈霉素的DMEM高糖培養基中,置于37 ℃、飽和濕度、5% CO2培養箱內,倒置顯微鏡觀察生長情況。細胞融合度約90%時用胰蛋白酶消化傳代或種板,取對數生長期的細胞用于實驗。
1.3 主要試劑與儀器
胎牛血清(Capricorn scientific 公司,批號:1705124);DMEM高糖培養基,胰蛋白酶溶液,青霉素-鏈霉素溶液(上海源培生物技術有限公司,批號:F40403,K40410,E40401);MTT,DMSO(Sigma公司,批號:SP1080、SHBH2446V);細胞裂解液(Bio-sharp公司,批號:6503595);Annexin V-FITC/PI雙染色流式細胞凋亡檢測試劑盒(BD公司,批號:556547);MDC法細胞自噬染色檢測試劑盒(江蘇凱基生物技術股份有限公司,批號:20180109);LC3A/B、Beclin 1、AKT、mTOR、p-AKT、p-mTOR、Bax、BCL-2及β-actin抗體(CST公司,批號:12741T、3495T、2920S、2938T、13038T、5536T、4970T)CPA225D萬分之一電子天平(賽多利斯科學儀器北京有限公司);Pall 超純水系統(美國Pall公司);SL16型低速離心機、FC型酶標儀、HER Acell 150i 型二氧化碳培箱(美國Thermo公司);熒光倒置顯微鏡(日本Nikon公司);BD FACSCalibur流式細胞儀(美國BD公司);Tanon-5500型化學發光凝膠成像儀器(中國天能科技有限公司);PowerPacTM Basic型電泳儀(美國Bio-Rad公司)。
1.4 檢測細胞增殖抑制率
采用MTT法,取對數生長期的細胞,PBS漂洗,胰蛋白酶消化后終止消化并離心,培養基重懸,細胞計數后以1×105個/mL接種于96孔板,每孔100 μL,設5復孔。24 h細胞貼壁后,分別加入不同濃度的小檗堿(0、10、20、40、80、100 μM),孵育24、48、72 h后,各孔加入 MTT(5 mg/mL)20 μL,孵育箱孵育4 h后棄去上清,每孔加DMSO 150 μL,避光震蕩10 min充分溶解沉淀后,酶標儀560 nm處檢測吸光度。
公式如下:細胞增殖抑制率(%)=[(OD對照組-OD給藥組)/OD對照組] ×100%。
1.5 觀察細胞形態
取對數生長期的乳腺癌MDA-MB-231細胞,制成單細胞懸液,接種于6孔板中,調整濃度為1.0×106 cell /孔,培養箱中37 ℃,5% CO2環境下培養24 h,吸取上清,每孔加入2 mL含不同濃度小檗堿的培養基(3%血清,1%雙抗),對照組加含 3%胎牛血清的培養基,孵育24 h后,倒置顯微鏡下觀察細胞形態并拍照。
1.6 檢測腫瘤細胞凋亡率
分別用25、50、100 μM濃度的小檗堿處理MDA-MB-231細胞24 h,同時設定空白對照組(DMSO,終濃度<0.05% (v/v)),每組設三個復孔,胰酶消化后,收集細胞。用緩沖液調整細胞濃度為1.0×106 個/mL,吸取100 μL的細胞至試管中,加入Annexin V試劑和PI各5 μL,避光孵育15 min后,于流式細胞儀檢測。
1.7 干預細胞自噬實驗
取對數生長期的乳腺癌MDA-MB-231細胞,胰酶消化后接種于6孔板中,調整濃度為1.0×106 cell /孔,37 ℃培養箱中培養24 h后棄上清,分別給予25、50、100 μM濃度的小檗堿刺激24 h。吸棄含藥上清,用Wash Buffer洗兩次,加入MDC染色工作液溫室避光孵育15~45 min后,熒光顯微鏡觀察并拍照。
1.8 細胞自噬相關蛋白表達
分別用25、50、100 μM小檗堿處理MDA-MB-231細胞24 h,同時設定空白對照組。用Western及IP裂解液裂解細胞,BCA試劑盒測定樣品蛋白含量,并變性。應用8%~12% SDS-PAGE電泳后,采用濕轉轉膜方法,將蛋白轉移至PVDF膜上,5%脫脂奶粉封閉后,加入相應的一抗(1∶1 000),4 ℃孵育過夜。次日,用PBST洗膜3次,再加入HRP標記的二抗(1∶5 000),室溫孵育2 h。ECL發光顯影、凝膠成像系統拍照成像。利用應用Gel Analysis軟件分析蛋白條帶光密度,并通過與相應內參β-actin條帶的密度做比較,測定樣品中目的蛋白的相對含量。
1.9 調節細胞自噬相關通路蛋白表達
AKT-mTOR通路與細胞自噬密切相關,采用Western blot方法檢測小檗堿作用于MDA-MB-231細胞24 h后對AKT及mTOR蛋白磷酸化的影響。
1.10 自噬與AKT-mTOR通路相關機制的驗證
在乳腺癌MDA-MB-231細胞中,加入3 mM PI3K-AKT信號通路抑制劑3-Methyladenine (3-MA)后,再加入50 μM小檗堿,孵育24 h 后,MTT法檢測細胞活力。提取細胞蛋白,觀察加入3-MA后,小檗堿對細胞自噬及凋亡相關蛋白的影響。
1.11 統計學分析
所得實驗數據均采用 SPSS 12.0軟件進行單因素方差分析,實驗數據均以平均數±標準差((x±s) 表示,以P< 0.05為差異有統計學意義。
2 結果
2.1 小檗堿對MDA-MB-231細胞增殖抑制率的影響
MTT結果表明,MDA-MB-231細胞的增殖受到不同程度的抑制,并與小檗堿的給藥劑量及時間成正相關。小檗堿對乳腺癌細胞在24、48、72 h的IC50值分別為:52.15 ± 3.87、49.28 ± 4.19和44.63 ± 3.26(見表1)。
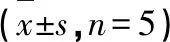
表1 小檗堿對MDA-MB-231細胞增殖抑制率的影響
2.2 小檗堿對MDA-MB-231細胞形態的影響
觀察結果顯示,正常的MDA-MB-231細胞呈梭形,伸展,貼壁。而小檗堿給藥組細胞呈現出不規則的形態,細胞膜明顯皺縮,細胞質高度濃縮,細胞外出現類似碎片,細胞間距變大。隨著小檗堿給藥濃度的增加,細胞的貼壁能力明細下降(見圖1)。

圖1 小檗堿對MDA-MB-231細胞形態的影響(20×)Fig.1 Effect of berberine on the morphology of MDA-MB-231 cells (20×)
2.3 小檗堿對MDA-MB-231細胞凋亡的影響
流式細胞實驗結果表明,小檗堿給藥24 h后細胞的總凋亡率分別為21.4% ± 3.43% (25 μM)、31.2% ± 5.22% (50 μM)和80.6% ± 6.45% (100 μM),與空白對照組(0.1% ± 0.1%)相比較,有顯著性差異(P< 0.05),提示小檗堿具有明顯的誘導乳腺癌MDA-MB-231細胞發生凋亡的作用(見圖2)。

圖2 小檗堿對MDA-MB-231細胞凋亡的影響Fig.2 Effect of berberine on apoptosis of MDA-MB-231 cells
2.4 小檗堿對MDA-MB-231細胞自噬的影響
MDC是自噬泡特異性的熒光標記物,結果顯示,小檗堿各給藥組細胞內MDC綠色熒光增強,且隨著處理濃度增加,熒光強度也逐漸增加。提示小檗堿可以誘導MDA-MB-231細胞自噬泡的形成(見圖3)。

圖3 小檗堿對MDA-MB-231細胞自噬的影響(20×)Fig.3 Effect of berberine on autophagy of MDA-MB-231 cells (20×)
2.5 小檗堿對MDA-MB-231細胞自噬相關蛋白表達的影響
LC3蛋白存在LC3A及LC3B兩種形式,結果表明,當乳腺癌MDA-MB-231細胞給予小檗堿后,細胞內LC3A蛋白表達減少,而LC3B蛋白表達增多。隨著小檗堿給藥濃度的增加,LC3B/LC3A表達量比也增加。同時自噬正調節因子Beclin 1表達也呈現增加的趨勢(見圖4)。

圖4 小檗堿對MDA-MB-231細胞自噬相關蛋白表達的影響Fig.4 Effect of berberine on the expression of autophagy-related proteins in MDA-MB-231 cells
2.6 小檗堿對調節MDA-MB-231細胞自噬相關通路蛋白表達的影響
Western blot結果表明,小檗堿抑制細胞內
AKT和mTOR蛋白的磷酸化水平,p-AKT/AKT和p-mTOR/mTOR比值降低(見圖5)。
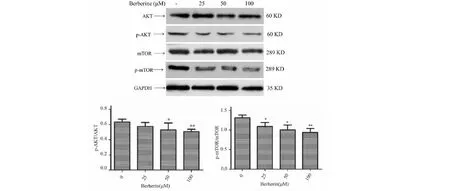
圖5 小檗堿對調節細胞自噬相關通路蛋白表達的影響Fig.5 Effect of berberine on the regulation of protein expression in autophagy-associated pathway
2.7 3-MA對細胞增殖、自噬及凋亡相關蛋白表達的影響
MTT結果表明,3-MA可抑制小檗堿給藥后出現的細胞活力降低的現象(圖 6A);Western-blot結果顯示,3-MA顯著抑制了LC3B/LC3A比值增大的趨勢(圖 6B、C),提示3-MA可抑制由小檗堿引起的細胞自噬的產生。此外,3-MA具有抑制小檗堿引起的凋亡相關蛋白Bax的表達增高、抗凋亡蛋白Bcl-2的表達降低的現象(圖 6D)。說明AKT介導的細胞自噬是小檗堿誘導細胞凋亡的原因之一。
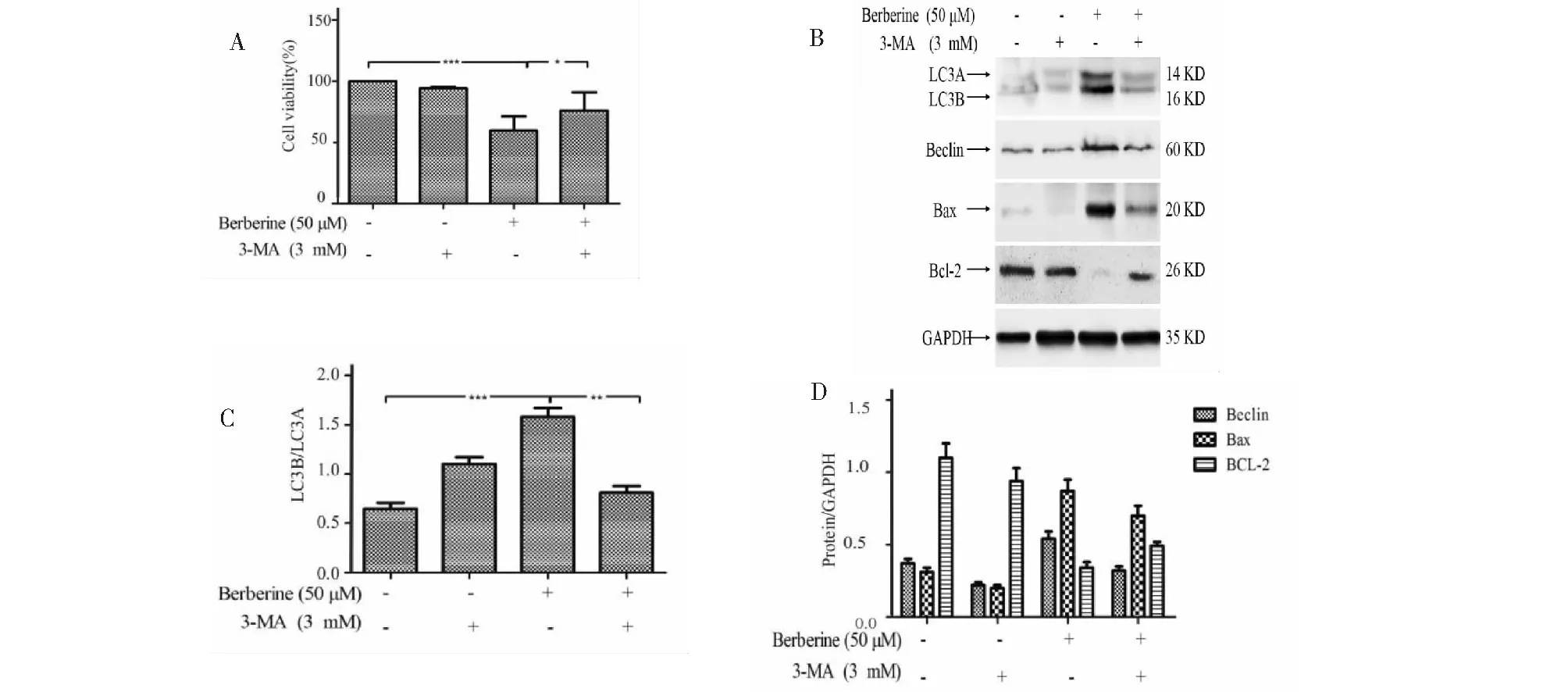
圖6 3-MA對小檗堿引起的細胞自噬及凋亡的影響Fig.6 Effect of 3-MA on autophagy and apoptosis induced by berberine
3 討論
自噬是把雙刃劍,其與細胞凋亡在不同的條件下相互協調、相互影響,對腫瘤的發生發展起著重要的調節作用[6]。在癌癥形成的早期階段,自噬具有抑制腫瘤增殖的作用。但同時,自噬也可使癌細胞適應不利的代謝應激(如缺氧、低營養狀態等)從而使腫瘤細胞存活[6-8]。因此,在癌癥早期,抗腫瘤藥通過激活細胞自噬可有效抑制腫瘤的生長,同時介導腫瘤細胞發生自噬性死亡。本實驗通過MDC染色,熒光顯微鏡觀察發現小檗堿可以誘導MDA-MB-231細胞自噬泡的形成。同時,Annexin V-PI染色結果顯示,小檗堿具有明顯的誘導MDA-MB-231細胞發生凋亡作用,提示小檗堿可能通過誘導腫瘤細胞自噬與細胞凋亡發揮抑制細胞增殖的作用。
LC3和Beclin 1是自噬體經典的標志蛋白。LC3包括LC3A及LC3B兩種形式,當自噬發生時,細胞質中的LC3A會轉變成自噬體膜上的LC3B蛋白,從引起LC3B蛋白表達增加[9]。而Beclin 1是一個重要的抑癌蛋白,Beclin 1的單等位基因缺失會造成自發性癌癥發病率的提升[10],本實驗通過Western Blot檢測發現,給藥后的乳腺癌細胞中LC3B/LC3A蛋白表達的比值及自噬正調節因子Beclin 1的表達與小檗堿濃度成正相關,表明小檗堿可以誘導乳腺癌細胞自噬的發生。AKT-mTOR (mammalian target of rapamycin)通路是調節細胞增殖及凋亡的重要通路[11],研究發現,乳腺癌患者存在mTOR蛋白過度激活的現象[12,13]。此外,mTOR是細胞自噬在啟動過程中的關鍵靶點通路[14,15],活化后可發揮抑制細胞自噬的作用。在本實驗中,Western Blot結果顯示,MDA-MB-231細胞在給予不同濃度的小檗堿后,細胞內AKT及mTOR蛋白的磷酸化水平受到不同程度的抑制,說明小檗堿通過抑制細胞中AKT-mTOR通路,從而發揮誘導乳腺癌細胞發生自噬的作用。
課題組長期以來對國醫大師周仲瑛臨床防治腫瘤的系列驗方消癌解毒方開展研究,其中應用于乳腺癌的方中主要有天葵子、八月札、白毛夏枯草、漏蘆、柴胡以及天冬等藥味,天葵子作為君藥,生物堿是其含有的一類主要成分[2],且課題組在前期的實驗也已從中分離得到小檗堿[3]。本研究表明,通過抑制AKT-mTOR通路,誘導細胞的自噬以及凋亡過程,是小檗堿發揮體外抑制乳腺癌細胞增殖效應的一個重要路徑,所以說實驗結果為進一步闡釋小檗堿的抗腫瘤分子機制提供了重要依據,同時為揭示抗腫瘤中藥天葵子的藥效物質基礎,以及復方抗腫瘤的臨床應用與轉化提供有效參考。

