多點突變提高α-L-鼠李糖苷酶熱穩定性
劉小琴,楊巖,吳喆瑜,鞏建業,劉嘉男,廖輝,李文靜,李利君,2, 3*
1(集美大學 食品與生物工程學院,福建 廈門,361021)2(福建省食品微生物與酶工程重點實驗室,福建 廈門,361021) 3(廈門市食品與生物工程技術研究中心,福建 廈門,361021)
α-L-鼠李糖苷酶(α-L-rhamnosidase, EC3.2.1.40)是一種糖基水解酶[1],廣泛來源于動物組織[2]、植物組織[3]以及酵母、真菌和細菌[3-4]中。不同來源的α-L-鼠李糖苷酶在酶學性質上存在一定差異,但大部分α-L-鼠李糖苷酶的最適pH 4~8[5],最適溫度40~70 ℃[6]。α-L-鼠李糖苷酶可特異性地水解末端帶鼠李糖的黃酮類,黃烷酮(如橙皮苷、柚皮苷),黃酮醇(如槲皮苷、蘆丁)[1]等物質,以及人工底物對硝基苯基-α-L-鼠李糖苷(4-nitrophenyl-a-L-rhamnopyranoside,pNPR),主要作用于α-1,2、α-1,3、α-1,4、α-1,6糖苷鍵[6]。
α-L-鼠李糖苷酶在食品與制藥等行業中有很大的應用價值。制藥行業中,可用于制備L-鼠李糖[7];水解蘆丁生成生物活性更高的異槲皮苷[8];參與人體結核病的治療[9]。食品行業中,可用于柑橘類果汁的脫苦[10],將果汁中的苦味物質柚皮苷降解生成普魯寧,提高果汁的口感;也可以水解柑橘類果汁中的橙皮苷,防止果汁中出現橙皮苷晶體而造成混濁狀[11];在葡萄酒釀造過程中,增加芳香族化合物,從而增加葡萄酒的香氣成分[12]。酶的熱穩定性對其在工業應用中具有極大的意義,如酶作用的底物的溶解度隨溫度的增大而增加,提高反應速率等,其次可以更加清楚了解蛋白質折疊、識別和穩定過程[13],因此為了滿足α-L-鼠李糖苷酶在食品制藥行業中的應用,研發具有更加優良性質的酶,對進一步研究其生物活性,分析熱穩定性與蛋白質結構之間的關系有重大意義。
此前研究表明,嗜熱蛋白中有賴氨酸轉變成精氨酸的趨勢,故在蛋白質的合適位置引入精氨酸有利于蛋白質熱穩定性的提高。KUMAR等[14]研究發現,精氨酸在嗜熱酶、嗜溫酶中出現的頻率是6.1%、6.5%; 而賴氨酸在嗜熱酶、嗜溫酶中出現的頻率則為4.6%、3.6%,表明精氨酸在嗜熱酶和嗜溫酶中出現的頻率較高。通過比較和分析嗜熱酶、嗜溫酶的蛋白質結構,發現蛋白質表面的賴氨酸替代為精氨酸可以提高其熱穩定性[15]。PoPMuSiC可以依據1個新統計勢的能量項變化的線性組合,從而估算突變引起的穩定性改變,評估序列最優性。這個新統計勢,基于引入與蛋白質序列以及結構相關的4個描述相符,進一步定義與它們之間的聯接相關的能量項集,同時考慮突變所致氨基酸體積的變化[16-17]。由此,實驗室前期經由精氨酸替換賴氨酸的策略以及通過PoPMuSiC分析α-L-鼠李糖苷酶三維結構模型,確定突變的氨基酸位點,構建了K440R、K402R、K573V、E631F4個單點突變體,發現這4個突變體在熱穩性質上有一定程度的提高,在單點突變體的基礎上,構建聯合突變體,進一步探究α-L-鼠李糖苷酶熱穩定性的變化,并通過圓二色譜分析和分子動力學模擬對突變體的結構進行分析,并對熱穩定性顯著提高的突變體進行微觀結構變化分析。
1 材料與方法
1.1 實驗材料及儀器
1.1.1 菌株
大腸桿菌DH5α、畢赤酵母SMD1168由本實驗室保藏。含pPIC9K-rha重組質粒的DH5α菌株;含pPIC9K-rha重組質粒的畢赤酵母SMD1168菌株,K440R, K402R, K573V, E631F突變體為實驗室前期構建。
1.1.2 主要試劑
DNA Marker、限制性內切酶Sal I購自寶生物工程(大連)有限公司;感受態細胞制備試劑盒購于寶生物工程(大連)有限公司;位點特異性突變導入試劑盒購于東洋紡(上海)生物科技有限公司;質粒小提試劑盒(離心柱型)、DNA純化回收試劑盒(離心柱型)購自天根生化科技(北京)有限公司;其余試劑均為國產或進口。
1.1.3 溶液及培養基
所用溶液:Amp溶液、磷酸鹽緩沖液、10×甘油、1 mol/Ld-山梨醇、0.02%生物素、10×YNB、10 mmol/L Tris-HCl溶液、1 mmol/L EDTA溶液、畢赤酵母破壁溶液、溶壁酶反應緩沖液、蛋白上樣緩沖液、染色液、脫色液、酶反應緩沖液、1 g/LpNPR。
其中,磷酸鹽緩沖液:1 mol/L K2HPO4和1mol/L KH2PO4對調至pH 6.0,高溫高壓滅菌后,放置4 ℃冷藏備用。酶反應緩沖液:0.02 mol/L Na2HPO4和0.01 mol/L檸檬酸對調至pH 3.0~8.0,放置4 ℃冷藏備用。1 g/LpNPR:0.1 gpNPR用酶反應緩沖液溶解并定容至100 mL,放置4 ℃冷藏備用。
培養基:LB培養基、YPD培養基、BMGY培養基、BMMY培養基、MD培養基。
1.2 實驗方法
1.2.1 多點突變位點的選擇
PoPMuSiC定義了4個結構變量:氨基酸類型(s),主鏈構象(t),溶劑可及性(a)和殘基距離(d)。當變量的組合數量為2個時,c1、c2表示任意的描述子,則其統計勢能如公式(1)所示:

(1)
式中:P表示描述子及其組合在蛋白質結構數據集合中出現的概率,k表示常量,T表示溫度。當n為3時,由公式(2)、(3)表示:

(2)
更多變量組合時,由此可類推:

(3)
基于以上統計能量值,得出了42個子勢能項, PoPMuSiC中所采用了其中 13 個勢能項組合,分別為:ΔWst、ΔWas、ΔWsd、ΔWsds、ΔWstt、ΔWsst、ΔWaas、ΔWass、ΔWast、ΔWasd、ΔWstd、ΔWasdas、ΔWstdst。
PoPMuSiC還考慮了突變前后氨基酸體積的變化,并用相應(ΔV-) 和(ΔV+) 來表示體積的增加和減少。則折疊自由能量如公式(4)所示:

(4)
通過PoPMuSiC網站分析黑曲霉JMU-TS528 α-L-鼠李糖苷酶三維結構模型,計算單點突變體折疊自由能的變化,從而預測影響熱穩定性的氨基酸位點,以及通過精氨酸替換賴氨酸策略和結合Discovery Studio 2016分析確定突變位點,得到熱穩定性提高的單點突變體,最后將實驗室前期構建的單點突變體進行聯合突變。
1.2.2 聯合突變質粒的構建轉化并篩選
將實驗室前期構建的單點突變體的質粒提取出來進行點突變,構建雙點突變質粒。構建好的雙點突變質粒轉化入E.coli感受態細胞,Amp抗性篩選重組子。篩選出的重組子進行菌液PCR后進行瓊脂糖凝膠電泳,并對有條帶的PCR產物進行測序。
1.2.3 電轉入酵母SMD1168及篩選陽性轉化子
將測序成功的突變質粒用Sal Ⅰ進行線性化回收,并轉化至畢赤酵母感受態。將轉化后的菌液涂于MD平板上,在30 ℃培養箱中倒置培養2~3 d。將MD平板上的單菌落挑取在含G418抗性的平板上,最后長出的單菌落進行保種和鑒定。
1.2.4 突變體酶的誘導表達及分離純化
1%接種量接種于100 mL BMGY培養基中,30 ℃、 200 r/min振蕩培養,使OD600達到3.0左右。4 000 r/min離心5 min收集菌體,并用BMMY培養基將菌體重懸至三角瓶中,30 ℃、200 r/min振蕩培養。每隔24 h加入500 μL甲醇。加入6次甲醇后,在10 000 r/min離心5 min,收集上清,放置于4 ℃冰箱備用。
將上步得到的酶液經過30 kDa的超濾膜進行超濾濃縮,取柱體積的1%~2%體積的酶液上樣,先用20 mmol/L磷酸鹽緩沖液(pH=7.0)平衡Sephacryl S-200HR凝膠柱,上樣后用同一緩沖液進行流洗,流洗的流速為0.8 mL/min,收集速度為3 min/管。按峰收集流洗液并測定各管的酶活和蛋白含量,將有酶活的管合并。
1.2.5 SDS-PAGE電泳檢測
參照碧云天生物公司配制蛋白膠的方法配蛋白膠的分離膠和濃縮膠。
取酶液30 μL與10 μL蛋白上樣緩沖液混勻,沸水浴10 min,冰上冷卻10 min,12 000 r/min離心2 min, 進行SDS-PAGE電泳。電泳完成后,將蛋白膠從膠板上取下來后,加入考馬斯亮藍染色液進行染色。
1.2.6 突變體酶學性質測定
初始酶活測定方法:以pNPR為底物,測定WT和突變體酶的蛋白濃度并稀釋至相同,在60 ℃放置10 min后,加入200 μL 1 mol/L Na2CO3溶液終止反應,空白對照為在100 ℃條件下處理20 min滅活的WT和突變體酶。反應終止后,吸取200 μL至96孔板中,使用酶標儀在410 nm下測定吸光值。
最適溫度測定方法:以pNPR為底物,將WT和突變體酶放置于30~70 ℃,其他反應條件相同測定酶活,空白對照為在100 ℃條件下處理20 min滅活的WT和突變體酶。反應終止后,測定吸光值。
最適pH測定方法:以pNPR為底物,將WT和突變體酶放置在pH 3~8緩沖液中,其他反應條件相同測定酶活,空白對照為在100 ℃條件下處理20 min滅活的WT和突變體酶。反應終止后,測定吸光值。
溫度穩定性測定方法:以pNPR為底物,將WT和突變體酶置于60、65、70 ℃下處理一定時間,其他反應條件相同測定酶活,空白對照為在100 ℃條件下處理20 min滅活的WT和突變體酶。反應終止后,測定吸光值。
1.2.7 突變體微觀結構分析
利用PyMol軟件在原始型酶三維結構模型的基礎上,構建突變體三維結構模型,并通過Discovery Studio 2016和在線網站PIC(http://pic.mbu.iisc.ernet.in/job.html)預測蛋白質內部相互作用的變化。
1.2.8 突變體結構分析
利用圓二色譜(circular dischorism, CD)、熒光光譜以及分析動力學模擬對熱穩性提高的聯合突變體進行分析。圓二色譜分析如下:純化的原始型酶和突變體酶在水中透析并稀釋至同一質量濃度,蛋白質量濃度為0.1 mg/mL,掃描范圍為185~255 nm,比色皿光徑為0.5 mm,檢測步長為1 nm,每個樣品掃描3次,最后用CDNN分析二級結構。
分子動力學模擬采用軟件Gromacs 5.1.4進行,模擬條件在恒定壓強(常壓),300K下進行,力場采用Gromos 96.1(53A6)。
2 結果與分析
2.1 突變位點的選擇
研究發現,精氨酸和賴氨酸在嗜熱酶、嗜溫酶中出現的頻率不同,且精氨酸在嗜熱酶、嗜溫酶出現的頻率均比賴氨酸高[14]。SOKALINGAM等[18]選擇10個蛋白質,引入精氨酸之后進行動力學分析,發現精氨酸引入后鹽橋和氫鍵的數量增加,表明賴氨酸替代為精氨酸后有利于提高蛋白質的穩定性。通過精氨酸替換賴氨酸策略并結合Discovery Studio 2016預測突變位點,進行單點突變后得到3個熱穩定性提高的突變體:K406R, K440R, K573R。PoPMuSiC使用已知結構的蛋白質數據集來計算某些殘基或原子在不同的結構環境中的條件概率,為一個蛋白質的每一對殘基指派一個能量,如果2個殘基間的距離在結構數據庫中出現的頻率高,那么相互作用就有一個低的能量;反之亦然。依賴于此統計勢能判斷出突變前后對蛋白的影響,由此應用PoPMuSiC對黑曲霉JMU-TS528 α-L-鼠李糖苷酶三維結構模型進行分析,計算出突變前后勢能的變化,預測突變的氨基酸位點,進行單點突變后得到突變體:E631F,將這不同的氨基酸位點突變的單點突變體進行聯合突變,得到4個聯合突變體:K406R-K573V, K406R-K440R, K440R-E631F, K573V-E631F。
2.2 聯合突變體的真核表達
將原始型α-L-鼠李糖苷酶(WT)和4個聯合突變體(K406R-K573V, K406R-E631F, K440R-K573V, K440R-E631F)進行發酵,離心和超濾濃縮收集酶液,收集后的酶液進行SDS-PAGE檢測,如圖1所示,均為100 kDa左右,片段大小正確,可進行酶學性質實驗。

M-蛋白質Marker;1-WT;2-K406R-K573V;3-K406R-E631F;4-K440R-K573V;5-K440R-E631F圖1 原始型α-L-鼠李糖苷酶和各個突變體的SDS-PAGE圖Fig.1 SDS-PAGE of WT and mutants of α-L-rhamnosidase
2.3 突變體酶學性質
測定WT和聯合突變體K406R-K573V、K406R-E631F、K440R-K573V、K440R-E631F的蛋白濃度,并將蛋白濃度統一至同一水平,在相同條件下測定它們的初始酶活。如圖2所示,與WT相比,K440R-K573V的初始酶活降低幅度較大,影響其酶學性質測定,文章后面不再對此突變體贅述;其他聯合突變體的酶活與WT相差不大。

圖2 原始型α-L-鼠李糖苷酶和突變體的初始酶活Fig.2 Initial enzyme activity of WT and mutants of α-L-rhamnosidase
測定WT和聯合突變體的最適溫度、最適pH、溫度穩定性。各個突變體的最適溫度與WT的一致(圖3),均為60 ℃,表明在單點突變的基礎上進行聯合突變構建的聯合突變體,并沒有影響酶的最適溫度。各個突變體在70 ℃的相對酶活均比WT的要高,最高可達83%。

圖3 原始型和突變體的最適溫度Fig.3 Optimum temperature of WT and mutants
由此可看出,聯合突變體的成功構建提高了酶的熱穩定性,且蛋白質分子改造能改善酶的熱穩定性。
聯合突變體的最適pH與WT的一致,均為pH 4(圖4),在pH 4~5的情況下,突變體的相對酶活相差不大。K440R-E631F在pH 3~8的相對酶活均比WT高,推測突變可能增強酶的酸堿耐受性。
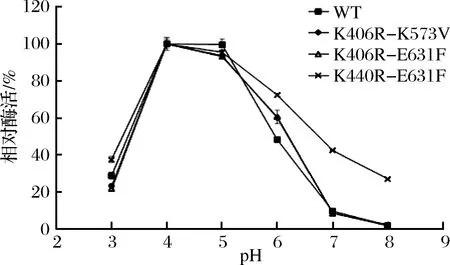
圖4 原始型和突變體的最適pHFig.4 Optimum pH of WT and mutants
測定聯合突變體K406R-K573V、K406R-E631F、K440R-E631F與WT在60、65和70 ℃條件下處理一段時間后的熱失活曲線,并通過熱失活曲線擬合半衰期,比較它們熱穩定性之間的差異(圖5、表1)。

A-60 ℃穩定性;B-65 ℃穩定性;C-70 ℃穩定性圖5 原始型和突變體的溫度穩定性Fig.5 Thermostability of WT and mutants

表1 突變體的基本酶學性質Table 1 Enzymatic property of WT and mutants
除了K406R-E631F外,其他聯合突變體K406R-K573V、K440R-E631F在60 ℃的熱穩定性均比WT好,半衰期比WT分別提高了1、3.5 h(表1)。聯合突變體K406R-K573V、K440R-E631F在65 ℃的半衰期與WT相比(圖5-B),分別提高了30、25 min(表1)。突變體K406R-E631F在65 ℃的穩定性比WT相比略有下降,降低了6 min。所有的聯合突變體在70 ℃熱穩定性均比WT好(圖5-C),K406R-K573V、K406R-E631F、K440R-E631F半衰期與WT相比分別提高了3.5、1.8、2.7 min。
綜上分析,突變體K440R-K573V酶活與WT相比損失很多,突變體K406R-E631F與WT相比,熱穩定性并沒有顯著提高,反而在60和65 ℃有所降低。K406R-K573V、K440R-E631F的熱穩定性提高。
2.4 突變體結構分析
2.4.1 圓二色譜分析
圓二色譜(CD)是用于測定蛋白質二級結構應用最廣泛的方法。蛋白質二級結構一般有α-螺旋、β-轉角、 無規則卷曲等結構,其中α-螺旋是最典型的結構。從圖6中可見,突變體K440R-E631F在208 nm有強的負吸收峰,在192 nm有強的正吸收峰,結合CDNN軟件計算后,從表2可看出,其α-螺旋、β-轉角、無規則卷曲結構增多,β-折疊結構降低。

圖6 原始型α-L-鼠李糖苷酶和突變體K440R-E631F的圓二色譜圖Fig.6 Circular dichroism spectrum of WT and K440R-E631F

表2 原始型α-L-鼠李糖苷酶和突變體K440R-E631F的二級結構比例Table 2 The secondary structure ratio of WT and K440R-E631F
研究表明,大量的α-螺旋有利于提高蛋白質的剛性,故適當提高蛋白質中α-螺旋結構的比例可以提高蛋白質的穩定性[14];無規則卷曲是蛋白質就空間結構中沒有規律性的區域,其結構柔性強,構象變化大,故無規則卷曲的減少也可以提高蛋白質的熱穩定性,與WT相比,突變體K440R-E631F α-螺旋含量增多,無規則卷曲增多,可能與熱穩定性提高有關。
2.4.2 分子動力學模擬
將WT和K440R-E631F進行動力學分析,并得到RMSD和RMSF結果圖。根據RMSD結果可以看出(圖7),WT和突變體在5 000 ps已經達到平衡狀態。K440R-E631F的波動幅度比WT稍大。根據RMSF結果(圖8-A),K440R-E631F突變體中氨基酸柔性比WT更加均勻,而蛋白質的穩定性是剛柔相互作用的過程,可能K440R-E631F突變體中氨基酸柔性和剛性的比例更加合適才使得其穩定性提高。分析406位和573位周圍氨基酸的RMSF值發現(圖8-B),突變體K440R-E631F中390~413位氨基酸(α-螺旋區)RMSF值變化不大,414~423位氨基酸(位于(α/α)6桶裝結構loop區)柔性增強,562~590位氨基酸(loop區)柔性增強,loop區柔性的增強有利于蛋白質與底物之間的結合。

圖7 WT和K440R-E631F的RMSD圖Fig.7 RMSD of WT and K440R-E631F

圖8 WT和K440R-E631F的RMSF圖Fig.8 RMSF of WT and K440R-E631F
2.5 突變體微觀結構變化
VOGT等[19-20]對16個蛋白家族中的蛋白進行研究,發現絕大部分蛋白質的熱穩定性越高,其氫鍵的數量也越多,表明氫鍵數量的增加可以使蛋白質的熱穩定性提高。此外,疏水相互作用取決于蛋白質中疏水氨基酸的個數和位置,當疏水氨基酸處于蛋白質內部時,有助于蛋白質結構的穩定,維持蛋白質的三級和四級結構。本研究通過WT三維結構模型和PyMol軟件構建所有突變體的三維結構模型,并用Discovery Studio 2016和PIC預測蛋白質內部鍵能的變化。對K406R-K573V進行分析發現,K406R-K573V比WT內部氫鍵數增加,同時疏水相互作用和陽離子-π作用減少。K440R-E631F突變體與WT相比,其熱穩定性有所提高,并且發現內部疏水性在一定程度也有所提高,推測疏水性的改變可能影響了它的熱穩定性。
3 結論
本研究應用精氨酸替換賴氨酸策略以及PoPMuSiC預測突變位點,改造α-L-鼠李糖苷酶,對實驗室前期構建的K406R, K440R, K573V, E631F四個不同氨基酸位點的單點突變體進行聯合突變,得到了2個熱穩定性提高的聯合突變體。與WT相比,突變體K406R-E631F熱穩定性并沒有顯著提高,突變體K440R-E631F的熱穩定性顯著提高。其中,K440R-E631F內部疏水性有所增加,二級結構中α-螺旋、β-轉角、 無規則卷曲結構增多,可能與熱穩定性提高有關;分子動力學模擬發現其蛋白質整體波動幅度與原始型相比較小。α-L-鼠李糖苷酶熱穩定性的提高,使α-L-鼠李糖苷酶在食品、制藥行業中可以得到更好的應用,同時,也為研究具有更優熱穩定性的酶提供理論依據。

