H2O2對白木香細胞生長和揮發性次生產物的影響
蔡 淼,李 明,董 閃,李敬輝
(1.廣東藥科大學中藥學院,廣東 廣州 510006;2.國家中醫藥管理局 嶺南藥材生產與開發重點研究室,廣東 廣州 510006)
【研究意義】白木香[Aquilariasinensis(Lour.)Gilg]為國產沉香的唯一正品來源[1],由于其自然繁殖率低, 森林資源、生態環境遭受自然災害和人為破壞, 加上掠奪式的砍伐,其野生資源幾乎已經枯竭[2]。白木香含樹脂的心材部分稱為沉香,具行氣止痛、納氣平喘、溫中止嘔的功效,主要治療胸腹脹痛、畏寒呃逆、腎虛氣喘癥[3]。白木香的重要價值體現在結香產物上,白木香結香過程是復雜的防御脅迫反應,誘導子誘導白木香結香是方法之一,本實驗研究H2O2對白木香細胞生長及其次生代謝產物的影響,為揭示白木香結香機制提供依據。【前人研究進展】茉莉酸甲酯、水楊酸、乙烯利等化學誘導子能誘導白木香細胞沉香類成分的產生[4]。H2O2是一種活性氧,也是植物響應逆境脅迫的重要信號分子,在調控細胞生長、植保素的合成中發揮重要作用[5],其在大豆、白苜蓿、番茄等其他植物上的研究中有證實[6]。【本研究切入點】本研究開展對白木香懸浮細胞施用不同濃度的H2O2的實驗。【擬解決的關鍵問題】在本實驗室之前關于白木香細胞愈傷組織誘導的基礎上對白木香細胞進行懸浮培養后[7],在培養基中添加H2O2溶液,通過檢測生長指標和化學成分,探究不同濃度的H2O2白木香細胞生長及揮發性成分的影響,為白木香結香機制提供科學依據。
1 材料與方法
1.1 供試材料
本實驗采用的白木香[Aquilariasinensis(Lour.)Gilg]懸浮細胞來源于實驗室前期培養獲得。
1.2 試驗方法
1.2.1 誘導子的制備 配置不同濃度的H2O2溶液,過0.45 μm過濾膜過濾后取適量的H2O2溶液加入第1天的白木香懸浮細胞培養液中,加入H2O2溶液的濃度分別為1、5、10、30、50 mmol/L,以無菌水作為空白對照。
1.2.2 細胞培養 參照董閃等[7]的方法,選取白木香無菌苗的莖段為外植體在培養基(MS+1.0 mg/L 6-BA+3.0 %蔗糖+0.6 %瓊脂,pH=5.8)中誘導出的愈傷組織作為繼代材料,先接種于不添加激素的MS培養基(3.0 %蔗糖+0.6 %瓊脂,pH=5.8)中生長7 d,再取長勢穩定、顏色正常的愈傷組織接種于培養基(MS+1.0 mg/L 6-BA+2.0 mg/L 2,4-D+3.0 %蔗糖+0.6 %瓊脂,pH=5.8)中繼代45 d得淡黃色疏松型愈傷組織。將該愈傷組織懸浮培養于培養液(1/2MS+1.0 mg/L 6-BA)中,再置于恒溫搖床上25℃暗培養,轉速110 r/min條件下培養。
1.2.3 細胞鮮重的檢測 在懸浮細胞培養液中加入不同濃度的H2O2,培養3 d后取出愈傷組織,用濾紙吸干表面水分,用萬分之一天平稱量其質量并記錄數據。
1.2.4 細胞活力的檢測 參照Miku和王躍華等[8-9]的方法,采用TTC法,取0.25 g愈傷組織,加0.4 %TTC溶液2.5 mL和pH為7的磷酸緩沖溶液2.5 mL染色4 h,取出染色液,蒸餾水洗3次,加5 mL甲醇溶解,60 ℃水浴30 min后取溶液檢測其吸光度。
1.2.5 細胞沉降體積的測定 參照史昆[10]等的方法并加以修改,用移液器吸取10 mL懸浮液于精密刻度試管中,靜置30 min后讀取沉降細胞的體積即為SCV值。
1.2.6 白木香細胞POD活性的測定 參照李玲[11]的方法,取樣品0.2 g,加入預冷的磷酸緩沖液5 mL,于10 mL EP管中搗碎,靜置20 min,4000 r/min離心10 min,收集上清液即為酶液,測定470 nm處的OD值的變化,酶活性的大小以每克樣品每分鐘OD值的變化值表示。
1.2.7 白木香細胞MDA含量的測定 參照李玲等[11]的方法,取樣品0.2 g,加入TCA溶液5 mL,于10 mLEP管中搗碎,靜置20 min,4000 r/min離心10 min,收集上清液即為MDA提取液。測定532 和450 nm處的OD值,計算MDA的含量。
1.2.8 DNA瓊脂糖凝膠電泳檢測 在添加不同濃度H2O2后的第3天取樣檢測,按照植物組織DNA提取試劑盒說明書操作提取DNA,將提取后的DNA樣品于1.0 %的瓊脂糖凝膠上進行電泳,電壓110 V,時間30 min,電泳完畢后在凝膠成像系統中觀察拍照。
1.2.9 白木香細胞揮發性次生代謝產物的提取及檢測 參照張娟芳等[12]的方法制備白木香懸浮培養物供試品溶液,取10 g懸浮培養物,濾紙吸干表面水份倒入研缽中簡單研磨,轉移至100 mL具塞錐形瓶中,加30 mL三氯甲烷溶液,密封,冰浴超聲30 min,冷浸過夜;搖勻過濾,濾渣反復過濾3次,收集濾液,65 ℃水浴蒸干,殘渣加1 mL三氯甲烷溶液溶解,微孔濾膜過濾,濾液轉移值1 mL容量瓶中定溶,密封冷藏,再采用GC-MS方法檢測所配置溶液中的成分。
2 結果與分析
2.1 不同濃度H2O2對白木香懸浮細胞鮮重和活力的影響
如表1所示,白木香懸浮體系的鮮重隨H2O2處理濃度的增加呈降低的變化,當H2O2濃度高于1 mmol/L時,其鮮重與對照組相比出現明顯降低的變化(P<0.05),在高濃度(30 和50 mmol/L)H2O2處理下,生長后的鮮重低于初始接種量。采用TTC法測定樣品活力后發現,白木香細胞活力隨著H2O2處理濃度的升高呈顯著下降的變化趨勢(P<0.05),當濃度達到50 mmol/L時其細胞活力與對照組相比降低了約93.3 %。

表1 不同濃度H2O2對白木香懸浮細胞鮮重和活力的影響
注:增殖倍數=培養后的鮮重/培養前的鮮重,表中標有相同字母的數據表示同列之間比較沒有顯著性差異(P>0.05),標有不同字母的數據表示表示同列之間比較有顯著性差異(P<0.05)。
Note: Proliferation rate = fresh weight after culture / fresh weight before culture. The data with the same letters in the table indicated that there was no significant difference between the same columns (P>0.05),data marked with different letters showed significant difference between the same columns (P<0.05).
2.2 不同濃度對白木香懸浮細胞沉淀體積(SCV)的影響
SCV能夠反應懸浮細胞液實際存在的細胞數量,其數值越大說明培養液中的細胞數量越多[13];如圖1所示,各培養的時間內,SCV均隨H2O2濃度的升高而下降(P<0.05),其中與對照組比較,10、30和50 mmol/L 3個組的SCV值在第1天就出現明顯下降的變化,培養第3天時,10、30和50 mmol/L H2O2處理的細胞的SCV分別較對照降幅值相近。
2.3 不同濃度H2O2對白木香細胞POD活性的影響
過氧化物酶(POD)是一種廣泛存在于植物體內的氧化還原類酶,其主要作用是催化H2O2氧化分解,清除H2O2對細胞的破壞作用[14]。如圖2所示,在培養12 h前,0~5 mmol/LH2O2處理下,POD活性均較對照均顯著升高,各處理均在培養6 h時POD活性最高,隨后POD活性隨時間的延長呈降低的變化,低濃度組(1 mmol/L)和中濃度組(5 和10mmol/L)POD活性在6 h達到最大值,高濃度組(30 和50 mmol/L)POD活性在4 h達到最大值,其中5 mmol/L處理組的POD最大活性明顯高于其它組;當處理時間超過2 d時,低中濃度組(1、5和10 mmol/L)的POD活性恢復到了初始狀態,而高濃度組(30 和50 mmol/L)的POD活性已基本喪失。
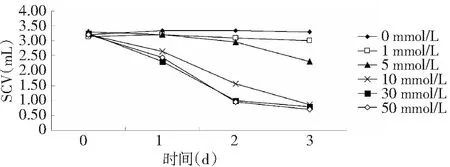
圖1 不同濃度H2O2對白木香懸浮細胞SCV的影響Fig.1 Effects of different concentration of H2O2 on cell SCV of Aquilaria sinensis
2.4 不同濃度H2O2對白木香細胞MDA含量的影響
丙二醛(MDA)是細胞膜脂質過氧化的產物,其含量大小可間接反應植物細胞組織受損傷的大小[15]。不同濃度H2O2對白木細胞MDA含量的影響結果如圖3,不同濃度處理組的MDA含量在培養時間內,均隨濃度的升高呈升高的變化,在4 h達到第1次高峰,而后降低,在8 h達到最低值,隨后各濃度培養均隨時間的延長MDA含量升高。在培養第3天時,高濃度處理組(30 和50 mmol/L)的MDA含量顯著高于對照組。
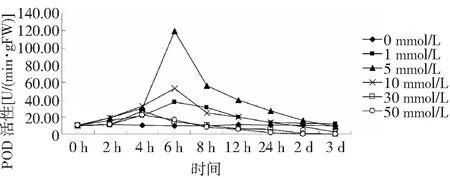
圖2 不同濃度H2O2對白木香細胞POD活性的影響Fig.2 Effects of different concentration of H2O2 on cell POD activities of Aquilaria sinensis
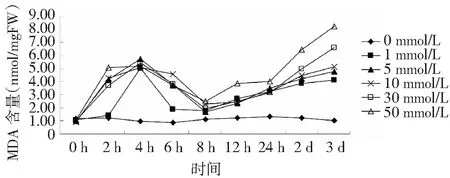
圖3 不同濃度H2O2對白木細胞MDA含量的影響Fig.3 Effects of different concentration of H2O2 on MDA of Aquilaria sinensis

M:DNA marker;A:對照;B:1 mmol/L;C:5 mmol/L;D:10 mmol/L;E:30 mmol/L;F:50 mmol/L圖4 不同濃度H2O2處理后的白木香細胞DNA瓊脂糖凝膠電泳圖Fig.4 Cellular DNA agarose gel electrophoresis of Aquilaria sinensis under different concentrations of H2O2
2.5 DNA瓊脂糖凝膠電泳
DNA瓊脂糖凝膠電泳技術已廣泛應用在動植物細胞的PCD檢測當中,當細胞發生PCD時,細胞核內DNA會降解成100~200 bp及其整數倍的片段,通過瓊脂糖凝膠電泳可觀察到“DNA Ladder”圖譜[15]。經過不同濃度H2O2處理后,白木香細胞中的DNA均發生了不同程度的降解,其中,低濃度(1 和5 mmol/L)組降解條帶明顯,中濃度組(10 mmol/L)出現梯形條帶的出現,說明添加不同濃度H2O2后,白木香細胞中的DNA均出現降解。圖4為經過不同濃度H2O2處理后的白木香細胞DNA電泳圖,從圖中可看出,5個處理組均出現不同程度降解帶,其中,1 和5 mmol/L H2O2組(圖4,B和圖4,C),在100~500 bp之間出現DNA降解帶較明顯;10 mmol/L H2O2組(圖4,D),在100~1200之間出現梯狀DNA降解帶;30 和50 mmol/L H2O2組(圖4,E和圖4,F),在100~500 bp之間出現較淡降解帶;而對照組(圖4,A)無降解條帶。
2.6 不同濃度H2O2對白木香細胞次生產物的影響
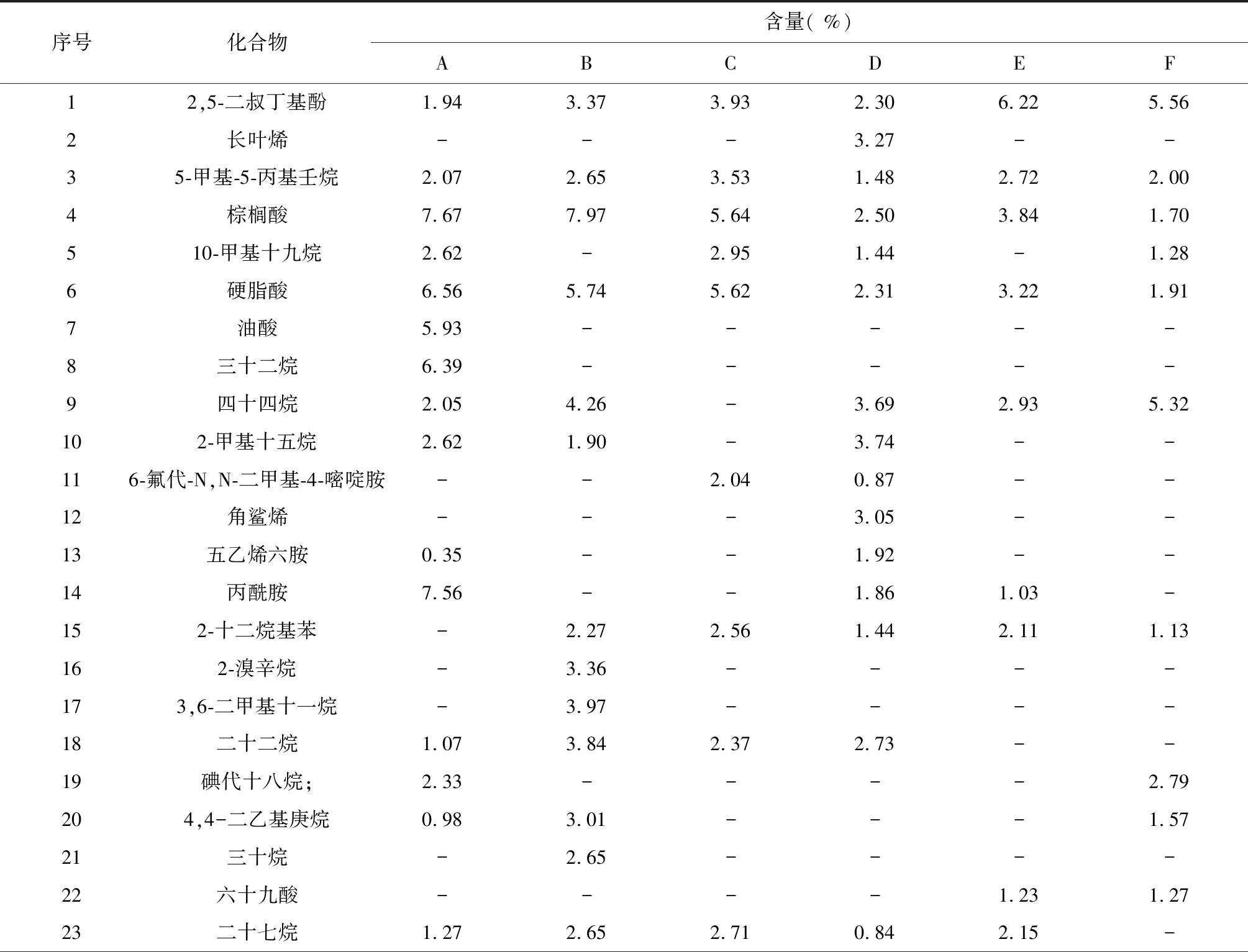
表2 不同濃度H2O2對白木香細胞次生代謝產物的影響
續表2 Continued table 2

序號化合物含量( %)ABCDEF24高瓜氨酸-1.943.702.461.46-25癸醛---2.50--261,4-雙(1-甲基乙基)苯--1.342.52--272,4,6-三甲基辛烷1.761.68----282-脫氧-D-半乳糖----2.14-294-甲基庚烷1.380.72----302-甲基十五烷2.62-----311-(4-叔丁基甲基)丙-2-酮----1.37-32硫酸--2.340.74-1.12332,4,6-三甲基辛烷1.761.683.64---344-乙酰氨基丁酸-0.722.13---355-茚醇-13.88---0.51361-(芐氧基)8-萘酚14.12-----37氨基甲酸-1.48----38十六烷基磺酰氯---1.79--39肉桂酸---5.04--40十二烷基乙二醇-1.49-3.09-1.14413,5-二甲基苯丙胺-1.551.104.971.882.33萜類化合物( %)0006.3200芳香族化合物( %)16.0621.078.9013.0210.219.53有機酸類化合物( %)20.1618.5713.3912.319.754.88烷烴類化合物( %)26.5928.2915.2013.927.8010.17其它化合物( %)10.246.865.4810.986.656.11
注:表中A、B、C、D、E、F分別代表對照組、1 mmol/L H2O2處理組、5 mmol/L H2O2處理組、10 mmol/L H2O2處理組、30 mmol/L H2O2處理組和50 mmol/L H2O2處理組。
Note: A, B, C, D, E and F in the table represent control group, 1 mmol/L H2O2treatment group, 5 mmol/L H2O2treatment group, 10 mmol/L H2O2treatment group, 30 mmol/L H2O2treatment group and 50 mmol/L H2O2treatment group respectively.
如表2所示,在對照組和5個不同濃度H2O2處理組中,檢出成分主要有烷烴類化合物、有機酸類化合物和芳香族類化合物。低濃度處理組(1 mmol/L)的芳香族化合物含量和烷烴類化合物含量最高,分別達到了21.07 %和28.29 %,對照組的有機酸類化合物含量最高,達到了20.16 %。所有實驗組均檢測出芳香族類化合物2,5-二叔丁基酚,脂肪酸類化合物棕櫚酸和硬脂酸,而萜類化合物僅在10 mmol/L處理組中被檢測出。
對照組與處理組比較發現,對照組檢測出1-(芐氧基)8-萘酚、油酸、三十二烷、2-甲基十五烷等特殊成份,處理組則檢測出2-十二烷基苯、3,5-二甲基苯丙胺、高瓜氨酸、4-乙酰氨基丁酸、氨基甲酸等特殊成分;5個處理組之間比較發現,低濃度處理組(1 mmol/L)芳香族類化合物和烷烴類化合物含量要明顯高于其它組,10 mmol/L處理組檢測出長葉烯(3.27 %)、角鯊烯(3.05 %)、十六烷基磺酰氯(1.79 %)、肉桂酸(5.04 %)等多種沉香類成分[16],而高濃度處理組(30 和50 mmol/L)有機酸和芳香族類化合物的種類和含量均顯著下降。
3 討 論
研究表明,H2O2作為一種活性氧(ROS),也是一種重要的信號分子,在調控植物抵御逆境中發揮重要的作用,并參與調節植物生理生化代謝、相關酶與基因激活、細胞死亡及植保素類的形成和積累方面都發揮重要的作用[17-18]。H2O2是植物中最穩定的活性氧分子之一,ROS機制在植物的防御反應中起重要的作用,在許多研究中被證實。用H2O2處理培養的細胞可以誘導保護反應和細胞死亡[19],ROS 的產生與植保素的合成也有密切的關系,在菜豆、大豆、白苜蓿、番茄和其他植物上的研究中均有證實, ROS 和植保素之間確實存在高度的相關性[20]。研究發現,外源 H2O2對水稻幼苗生長、細胞死亡和生長素分布有影響[21], 一定濃度的H2O2能增加燕麥苗中可溶性糖、蛋白質、脯氨酸等滲透性調節物質的含量,提高SOD、CAT、POD等抗氧化酶活性,減輕膜脂氧化傷害與燕麥苗生長受抑制程度,增強燕麥的耐鹽性[22]。外源噴施H2O2能夠增加苦菜幼苗可溶性糖、可溶性蛋白質和脯氨酸滲透調節物質的含量,提高抗氧化酶SOD、POD、CAT 和 APS 酶的活性[23]。本實驗表明,白木香細胞的生長、活力、SCV均隨H2O2濃度的升高而顯著降低,高濃度H2O2處理可以導致白木香細胞死亡。
MDA是表示膜質過氧化的指標,其值越高,表示膜質過氧化程度越高,細胞損傷越嚴重[14]。本研究表明,白木香細胞的MDA含量隨H2O2濃度的升高而升高,表明高濃度的H2O2能夠導致白木香細胞產生氧化脅迫。POD是植物體內的重要的抗氧化酶之一,低濃度處理的白木香細胞POD活性在生長前期呈顯著升高的變化,在生長后期呈急劇降低的變化;高濃度處理的細胞POD活性在培養期內均顯著低于低、中濃度處理的,在生長后期,高濃度處理的細胞POD活性已基本喪失,可能與高濃度H2O2處理下的白木香細胞發生了大量死亡有關。通過GC-MS技術檢測H2O2對白木香細胞的揮發油成分的影響,結果表明,經過H2O2處理,白木香細胞次生產物的種類和含量都發生了一定的變化。低濃度處理組(1 mmol/L)的芳香族化合物含量和烷烴類化合物含量最高,而僅在10 mmol/L處理組檢測出長葉烯(3.27 %)和角鯊烯(3.05 %)2種萜類化合物,高濃度處理組中有機酸和芳香族類化合物的種類和含量均呈降低的變化,有關H2O2對白木香細胞次生產物的組分及含量影響的相關機制仍需深入開展。
4 結 論
外源H2O2對白木香細胞的生長、活力產生影響,隨濃度的升高而降低,至一定濃度時,導致細胞死亡,一定濃度的H2O2能夠誘導白木香細胞的長葉烯(3.27 %)和角鯊烯(3.05 %)、十六烷基磺酰氯(1.79 %)、肉桂酸(5.04 %)等多種沉香類成分的形成。

