新疆釀酒葡萄表皮醋酸菌的分離鑒定及產酸條件優化
,,,,*
(1.石河子大學 食品學院,新疆 石河子 832000;2.石河子大學信息科學與技術學院,新疆 石河子 832000)
新疆地大物博,氣候獨特,瓜果品種多、種植面積大、糖度極高、品質優良,但由于加工和銷路的問題,每年產生大量的廢渣和殘次果,造成嚴重的經濟損失。果醋是一種以果蔬或其下腳料為主要原料,通過酒精發酵和醋酸發酵而成的具有多種營養成分和保健功能的液態食品[1,2]。因此,發展新疆特色果醋能夠快速、有效地解決新疆果品加工廢渣及殘次果經濟損失的問題。
醋酸菌種是決定果醋產量和質量的主要因素之一。目前,果醋釀造的優良菌株分為醋酸桿菌屬(Acetobacter)和葡糖桿菌屬(Gluconobacter)2個屬。常用的釀造用醋酸菌還有奧爾蘭醋桿菌(A.orleanense)、許氏醋桿菌(A.schuegenbachii)、產醋醋酸桿菌(A.acetigenum)、彎曲醋桿菌(A.curvum)、紋膜醋桿菌(A.aceti)、惡臭醋酸桿菌(A.rancens)、攀膜醋桿菌(A.ascendans)、膠膜醋桿菌(A.xylinum)等[3,4]。本文以新疆釀酒葡萄為原料,篩選高產酸醋酸菌,為新疆特色果醋業的發展以及果蔬加工產業鏈的延伸奠定了一定基礎。
1 材料與方法
1.1 材料
1.1.1 采樣
從新疆石河子142團采集10例赤霞珠釀酒葡萄。
1.1.2 主要試劑與儀器
葡萄糖、酵母浸粉、瓊脂粉、蛋白胨、氫氧化鈉、丙三醇、酵母膏、DNA Marker和ddH2O:購自北京奧博星生物技術有限責任公司;碳酸鈣、無水乙醇、Easy Taq Supermix:購自天津市致遠化學試劑有限公司;Gold View、DNA Kit:購自北京全式金生物技術有限公司,以上試劑均為分析純。
5810R高速冷凍離心機 德國Eppendorf儀器公司;TC-512PCR擴增儀 英國Techne公司;Power Pac Universal電泳儀、Gel DOC XR凝膠成像系統 美國BioRad公司;CX21FS1光學顯微鏡 Olympus 公司;LAC-5040S全自動高壓滅菌鍋 浙江新豐醫療器械有限公司;SW-CJ超凈工作臺 蘇州安泰空氣技術有限公司;GNP-9272智能生化培養箱 上海精宏試驗設備有限公司。
1.1.3 培養基
篩選培養基:葡萄糖(1%)、酵母膏(1%)、碳酸鈣(2%)、無水乙醇(3%)、自然pH,121 ℃高壓滅菌20 min,冷卻至60 ℃以下再加入無水乙醇[5]。
發酵培養基(GYPE):葡萄糖(0.1%)、蛋白胨(0.2%)、酵母膏(0.5%)、無水乙醇(6%)、121 ℃高壓滅菌20 min,冷卻至60 ℃以下再加入無水乙醇[6]。
1.2 方法
1.2.1 樣品處理
稱取20 g葡萄樣品,在無菌條件下,將其加入到裝有50 mL無菌水的三角瓶中,并放置三角瓶于搖床中,在30 ℃、120 r/min條件下,培養12 h,得菌懸液。
1.2.2 菌株的分離純化
采用梯度稀釋平板涂布法對葡萄樣品進行分離,在30 ℃恒溫條件下培養48 h。經連續劃線培養2~3次后,參考《伯杰細菌鑒定手冊》[7],與張紀中的《微生物分類學》進行比對。根據菌落的形態、大小、顏色進行初步分類鑒定,革蘭氏染色,將革蘭氏染色陰性菌(顯微鏡下為紅色)純培養物經液體培養基富集之后按600 μL甘油和水混合液(1∶1),將400 μL液體培養物移入1.5 mL離心管中,保藏5份至-20 ℃冰箱中,并做好標記。
1.2.3 醋酸菌的16S rDNA分析及系統發育分析
菌體DNA的提取:試驗DNA的提取采用Easy Pure Bacteria Genomic DNA Kit試劑盒,根據試劑盒提供藥品和說明書步驟進行DNA的提取。
PCR擴增[8]:
上游引物:27F-5′-AGA GTT TGA TCC TGG CTC AG-3′;
下游引物:1492R-5′-GGT TAC CTT GTT ACG ACT T-3′。
擴增體系:總體積為50 μL,其中包括2 μL的模板DNA,2 μL的上游引物,2 μL的下游引物,25 μL的Easy Taq Supermix,19 μL的ddH2O,并做空白對照。
擴增程序[9]:94 ℃預變性5 min,進行30個循環,每個循環為94 ℃變性45 s,53 ℃退火45 s,72 ℃延伸1 min,然后再延伸10 min。PCR擴增產物經1.0%瓊脂糖凝膠電泳檢測[10],并置于-20 ℃保藏以備后續試驗所用。
將符合標準的16S rDNA擴增產物進行測序。測序結果在NCBI(National Center for Biotechnology Information)BLAST中進行同源序列比對,根據比對的結果,下載相似性在99%以上菌種的16S rDNA序列,連同測序菌株的序列用Claustal X1.83軟件進行多序列比對,結果采用MEGA 6.0軟件中的鄰近法(Neighbor-Joining)進行系統發育樹的構建,并用Bootstrap對進化樹進行1000次置信度分析[11]。
1.2.4 總酸的測定
取-20 ℃下保存的菌種在液體培養基中活化,加入5%的活化菌液于50 mL液體培養基的250 mL三角瓶中,置于搖床于30 ℃,170 r/min進行培養,待測總酸。
24 h測1次樣品相關的數據,對樣品搖勻后在無菌操作臺中進行,并且用空白培養基作為空白對照,用堿式滴定法測量菌種產酸量,用移液槍吸取2 mL至三角瓶中進行滴定,然后用下式計算出總酸[12]:
產酸量(g/L)=V/V0×CNaOH×60/L。
式中:V為發酵液樣品滴定耗用的NaOH的體積數,mL;V0為以空白培養基為對照滴定耗用的NaOH的體積數,mL;CNaOH為NaOH溶液的濃度,mol/L;L為樣品的體積數,mL;60為醋酸的分子量。
1.2.5 高產酸菌株的篩選
接種5%的液體培養物于發酵培養基中進行7天發酵實驗,每天測其總酸,比較產酸量及產酸能力,篩選出產酸最高的菌株。
1.2.6 培養基優化單因素試驗[13]
1.2.6.1 不同濃度無水乙醇對高產菌株產酸能力的影響
活化產酸最高的菌株,按照5%的接種量分別接種于2%,4%,6%,8%,10%乙醇的GYPE培養基中,將其置于30 ℃搖床中發酵24 h,每組3個平行,并做空白對照。
1.2.6.2 不同濃度葡萄糖對高產菌株產酸能力的影響
活化產酸最高的菌株,按照5%的接種量分別接種于0.5%,1%,1.5%,2%,2.5%葡萄糖的GYPE培養基中,將其置于30 ℃搖床中發酵24 h,每組3個平行,并做空白對照。
1.2.6.3 不同濃度酵母膏對高產菌株產酸能力的影響
活化產酸最高的菌株,按照5%的接種量分別接種于0.5%,1%,1.5%,2%,2.5%酵母膏的GYPE培養基中,將其置于30 ℃搖床中發酵24 h,每組3個平行,并做空白對照。
1.2.7 正交試驗設計
根據單因素試驗的結果,先對微生物生長有重要影響的碳源和氮源,即葡萄糖、酵母膏、無水乙醇的用量,按照L9(33)正交表進行正交試驗設計[14],各因素水平見表1。
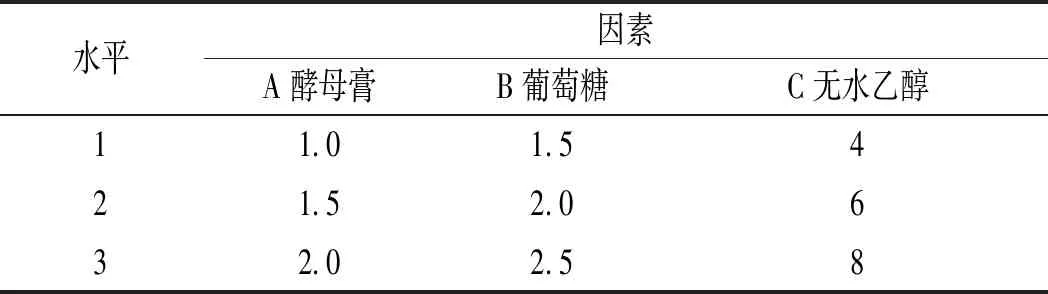
表1 產酸條件優化正交試驗因素與水平Table 1 Optimization of orthogonal test factors and levels of acid-producing conditions %
1.2.8 數據處理與分析
采用Origin 8.0數據分析軟件進行單因素分析,用SPSS數據分析軟件進行正交分析。
2 結果與分析
2.1 醋酸菌的分離
通過初步分離純化,共篩選得到15株醋酸菌,通過菌落形態和革蘭氏染色顯微形態比較,將篩選出的醋酸菌初步分為5類,菌落形態特征與顯微形態特征見表2和圖1。

表2 培養基上醋酸菌的形態特征Table 2 Morphological characteristics of lactic acid bacteria on culture medium
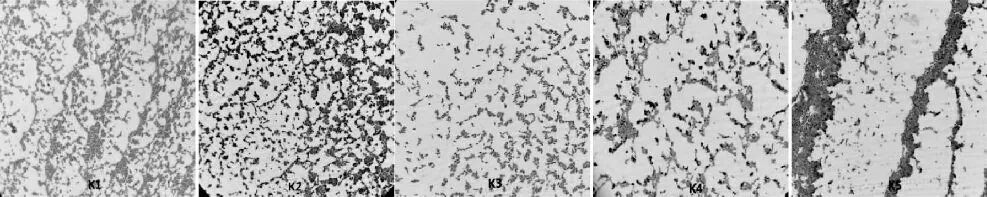
圖1 醋酸菌革蘭氏染色圖Fig.1 Gram staining of acetic acid bacteria
2.2 16S rDNA擴增產物電泳檢測結果
選取每種表型中生長活性最好的菌株作為代表菌株,分別標號為K-1、K-2、K-3、K-4、K-5并提取其DNA。將提取的5株醋酸菌的DNA進行PCR擴增后,進行瓊脂糖凝膠電泳檢測,在1500 bp左右出現了特異性擴增條帶,且條帶較為明亮,PCR擴增結果符合測序標準。電泳檢測結果見圖2。
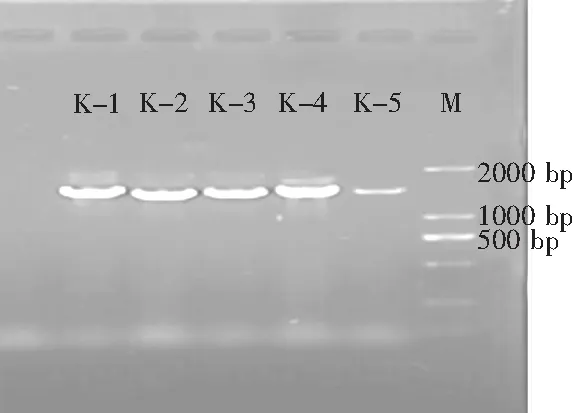
圖2 16S rDNA擴增產物電泳檢測圖Fig.2 The electrophoresis detection map of 16S rDNA amplification products
2.3 醋酸菌株的系統發育分析
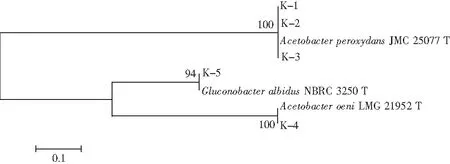
圖3 醋酸菌16S rDNA系統發育樹Fig.3 16S rDNA phylogenetic tree of lactic acid bacteria
由圖3可知,K-1、K-2、K-3與AcetobacterperoxydansJMC 25077同源性強,屬于Acetobacterperoxydans(過氧化醋桿菌),K-4與AcetobacteroeniLMG 21952同源性強,屬于Acetobacteroeni(葡萄酒醋酸桿菌),K-5與GluconobacteralbidusNBRC 3250同源性強,屬于Gluconobacteralbidus(白葡糖桿菌)。
2.4 高產酸醋酸菌種的篩選
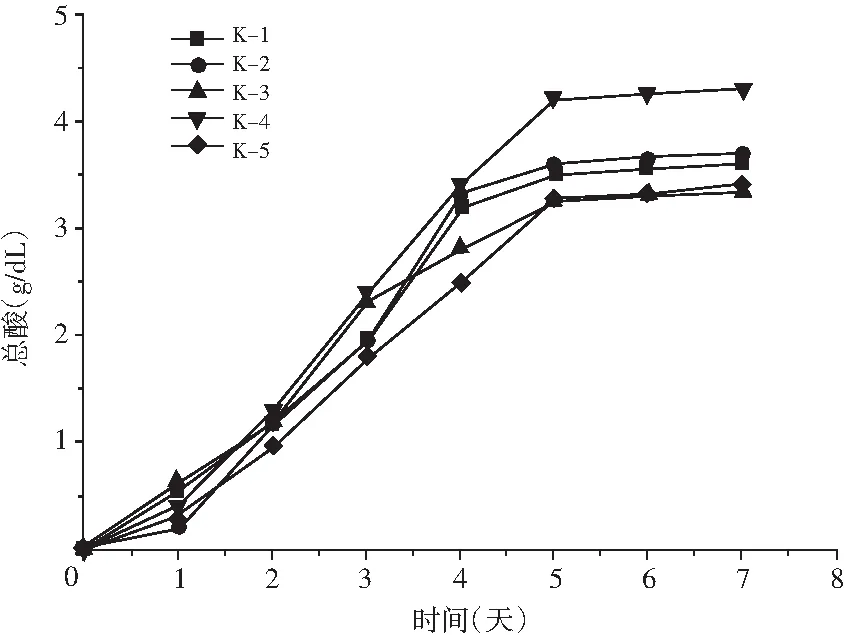
圖4 不同菌株產酸量的比較Fig.4 Comparison of acid production of different strains
由圖4可知,在發酵至第5天時不同菌株的產酸量都呈快速上升趨勢;發酵5天之后,產酸量呈緩慢上升趨勢;當發酵至第7 天時,K-4菌株的產酸量最高,達到了4.2 g/dL。因此,選取K-4菌株作為后期產酸條件優化的供試菌株。
2.5 產酸條件的優化
2.5.1 不同濃度無水乙醇對K-4菌株產酸能力的影響
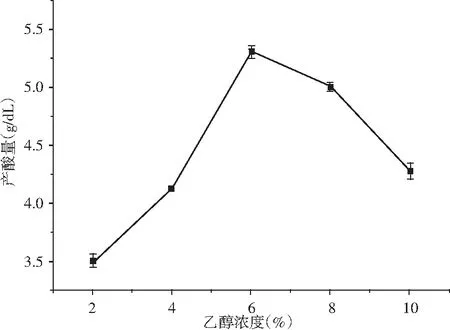
圖5 不同濃度無水乙醇對K-4菌株產酸能力的影響Fig.5 Effect of different concentration of absolute ethanol on acid-producing ability of K-4 strain
由圖5可知,K-4菌株的乙醇濃度不同,產酸量變化明顯,隨著濃度的升高,產酸量升高,6%以后逐漸下降。可知6%時產酸量最高,酒精是醋酸菌生長代謝能量的提供者,酒精濃度越高,對醋酸菌生長有抑制作用,所以培養基配制時最佳乙醇濃度為6%。
2.5.2 不同濃度葡萄糖對K-4菌株產酸能力的影響
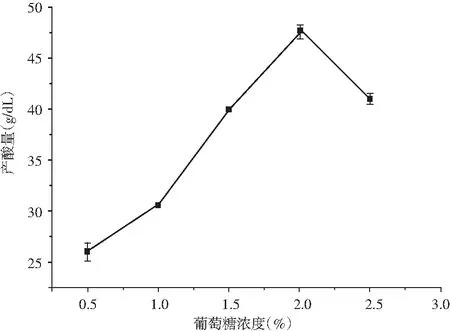
圖6 不同濃度葡萄糖對K-4菌株產酸能力的影響Fig.6 Effect of different concentration of glucose on acid-producing ability of K-4 strain
由圖6可知,K-4菌株葡萄糖濃度在2%時產酸量最高,大于2%時產酸量逐漸降低。隨著葡萄糖濃度的升高,細菌繁殖能力增強。但是當葡萄糖添加量增加到2.5%時,細菌繁殖能力下降,菌液濃度下降,所以在培養基配制時葡萄糖最佳添加量為2%。
2.5.3 不同濃度酵母膏對K-4菌株產酸能力的影響
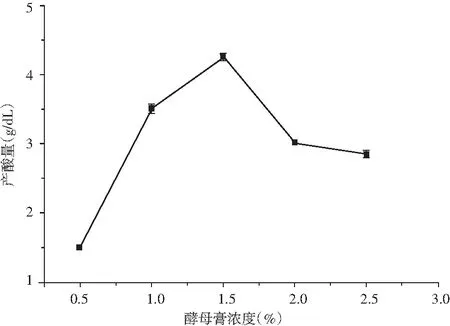
圖7 不同濃度酵母膏對K-4菌株產酸能力的影響Fig.7 Effect of different concentration of yeast extract on acid-producing ability of K-4 strain
由圖7可知,K-4菌株酵母膏濃度在1.5%時最佳,在1.5%之前,隨著酵母膏濃度的升高,產酸量增大,但隨著酵母膏濃度的升高,細菌產酸能力下降。所以,醋酸菌產酸量在1.5%時高于其他濃度,為最佳濃度。
2.6 K-4菌株產酸正交試驗
K-4菌株產酸正交試驗結果與分析見表3。
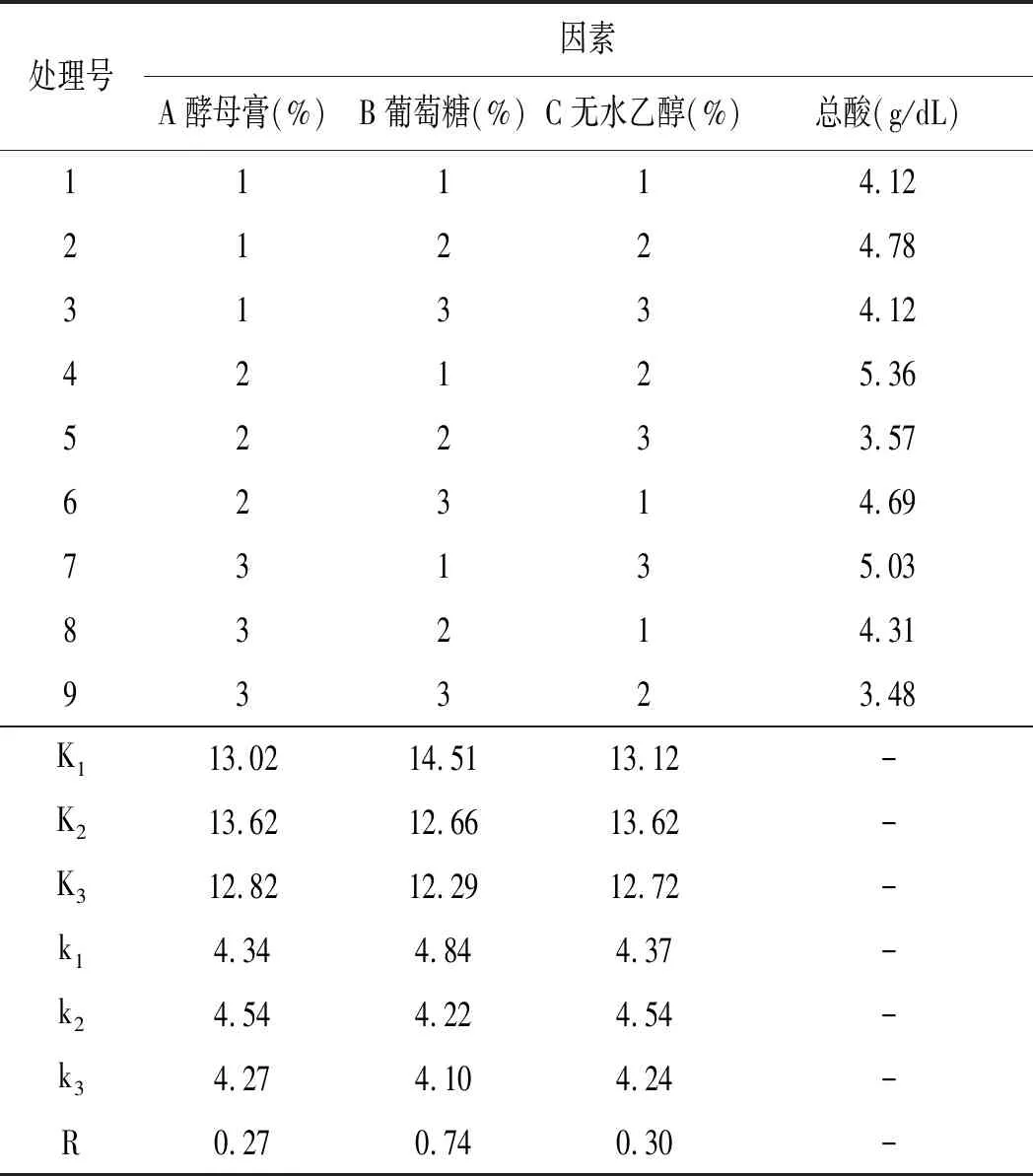
表3 產酸條件優化正交試驗結果與分析Table 3 Optimization of orthogonal test results and analysis of acid-producing conditions
由正交表極差分析可知,對K-4菌株產酸影響的重要性為B>C>A,即葡萄糖濃度>無水乙醇濃度>酵母膏濃度。由正交試驗結果可知,K-4菌株最佳產酸條件為A2B1C2,即酵母膏1.5%,葡萄糖1.5%,無水乙醇6%。
3 結論
通過對新疆釀酒葡萄赤霞珠表皮的醋酸菌進行不斷篩選和純化,最終初步得到了15株醋酸菌,經過對其鏡檢以及形態特征的對比,初步將其分成了5種類型,挑取5株活性較好的代表菌株進行DNA提取和16S rDNA序列擴增測序,NCBI序列比對結果表明:K-1、K-2、K-3屬于Acetobacterperoxydans(過氧化醋桿菌),K-4屬于Acetobacteroeni(葡萄酒醋酸桿菌),K-5屬于Gluconobacteralbidus(白葡糖桿菌)。
通過對K-1、K-2、K-3、K-4、K-5進行7天發酵試驗,結果表明K-4產酸能力最高,由正交表極差分析得出,對K-4菌株產酸影響的重要性為:B>C>A,即葡萄糖濃度>無水乙醇濃度>酵母膏濃度。所以,由正交試驗結果可知,K-4菌株最佳產酸條件為A2B1C2,即酵母膏1.5%,葡萄糖1.5%,無水乙醇6%。

