不同處理方法對靈芝有效成分提取率的影響
羅汝鋒,羅艷萍,藍澤基
(廣東一方制藥有限公司,廣東佛山 528244)
0 引言
靈芝為多孔菌科真菌赤芝(Ganoderma lucidum(Leyss.exFr.)Karst.)或紫芝(Ganoderma sinense Zhao) 的干燥子實體[1]。
我國是世界上最早栽培和食用靈芝的國家之一,因其具有獨特的藥用價值,功效確切,早在東漢時期,我國第一部中草藥著作《神農本草經》中就有相關收錄,并把靈芝稱為“上藥”;而之后的《本草綱目》 《開元本草》等著作中,也一直被稱為“扶正固本”“滋補強身”“延年益壽”的中藥珍寶和食療瑰寶。而我國也于2018年公開征求關于將靈芝等作為藥食同源管理意見函,這也為日后靈芝作為藥食同源產品的開發注入強大的動力。
靈芝中含有豐富的化學成分,主要包括多糖、三萜類、蛋白質、麥角甾醇、生物堿,以及多種微量元素等,孢子中還含甘露醇、海藻糖(Trehalose)等[2]。三萜類化合物是靈芝的主要活性成分之一,種類很多,它們是靈芝的苦味成分,其含氧功能團對苦味的產生起重要作用。藥理研究表明,靈芝三萜具有解毒、保肝、抗腫瘤、抗炎、抗氧化、抗組織胺釋放、抑制血管緊張素、調節免疫力等功效[3-4]。靈芝酸A和靈芝酸B是1982年首次從靈芝中分離出的三萜類化合物,具有抑制組織胺釋放、降血脂、降血壓、調節肝功能等作用[5]。在日本,正是因為靈芝酸的功效顯著,人們非常看重靈芝商品中靈芝酸的含量,并把其作為衡量靈芝及其制品品質的重要指標。靈芝多糖也是靈芝的主要活性成分,其與多種藥理活性有關,現代藥理研究表明,靈芝多糖具有顯著的提高免疫力、抗腫瘤、清除自由基、抗衰老等活性[6-12]。因此,靈芝多糖、三萜類化合物作為主要活性成分是評價靈芝品質高低的重要指標。然而,不同的提取方法對于靈芝有效成分的溶出具有較大的影響,前處理方法作為提取前的重要一環同樣具有不可或缺的影響。
因此,試驗對靈芝藥材分別進行粗碎、粉碎、切薄片及切厚片4種處理方法后加水回流提取,測定出膏率及提取物中靈芝多糖、三萜及甾醇、靈芝酸A和靈芝酸B含量,比較不同處理方式有效成分的提取率,以篩選出有利于提取靈芝有效成分的藥材處理方式。
1 材料與方法
1.1 材料與試劑
靈芝藥材,山東省臨沂金泰藥業有限公司提供,經廣東一方制藥有限公司質量中心鑒定為多孔菌科真菌赤芝Ganoderma lucidum(Leyss.exFr.)Karst.的干燥子實體。
靈芝酸A對照品、靈芝酸B對照品,上海安譜實驗科技股份有限公司提供;D-無水葡萄糖對照品、齊墩果酸對照品,中國食品藥品檢定研究院提供。
1.2 儀器與設備
UV-2450型紫外可見分光光度計,島津儀器(蘇州)有限公司產品;1260型高效液相色譜儀,安捷倫儀器有限公司產品;AB265-S/10型電子天平,梅特勒-托利公司產品。
1.3 試驗方法
1.3.1 前處理
(1)粗碎處理。取靈芝藥材,除去雜質,用破碎機(1.6 cm孔徑篩網)打碎。
(2)粉碎處理。取靈芝藥材,除去雜質,用破碎機(1.6 cm孔徑篩網)打碎,后用高速粉碎機粉碎,使其全部通過10目。
(3)薄片處理。取靈芝藥材,揀選除雜,切成0.1~0.2 cm的薄片。
(4)厚片處理。取靈芝藥材,揀選除雜,切成0.2~0.4 cm的厚片。
1.3.2 提取工藝
前處理過的靈芝→加水回流提取3次(第1次加入10倍水,煎煮1.5 h;第2次加入8倍水,煎煮1.5 h;第3次加入5倍水,煎煮0.5 h) →過濾→濃縮→干燥→靈芝提取物。
1.4 含量測定
1.4.1 多糖含量測定
標準曲線的制作:取105℃干燥至恒質量的無水葡萄糖對照品6 mg,精密稱定,加水溶解并定容至50 mL,制成每1 mL含0.12 mg的對照品溶液。分別精密量取對照品溶液 0.2,0.4,0.6,0.8,1.0,1.2 mL,分別置于10 mL具塞試管中,各加水至2.0 mL,迅速精密加入硫酸蒽酮溶液(精密稱取蒽酮0.1 g,加硫酸100 mL使溶解,搖勻)6 mL,立即搖勻,放置15 min后,立即置冰浴中冷卻15 min,取出,以相應的試劑為空白,于波長625 nm處測定吸光度,以吸光度為縱坐標、質量濃度為橫坐標,繪制標準曲線。
供試品溶液的制備及含量測定:取靈芝提取物粉末約2 g,精密稱定,置于圓底燒瓶中,加水60 mL,靜置1 h,加熱回流4 h,趁熱濾過;用少量熱水洗滌濾器和濾渣,將濾渣及濾紙置于燒瓶中,加水60 mL,加熱回流3 h,趁熱濾過,合并濾液,置于水浴上蒸干;殘渣用水5 mL溶解,邊攪拌邊緩慢滴加乙醇75 mL,搖勻,在4℃放置12 h,離心,棄去上清液;沉淀物用熱水溶解并轉移至50 mL量瓶中,放冷,加水至刻度,搖勻;取溶液適量,離心,精密量取上清液3 mL,置于25 mL量瓶中,加水至刻度,搖勻,即得供試品溶液。精密量取供試品溶液2 mL,置10 mL具塞試管中,按照標準曲線制備項下的方法,自“迅速精密加入硫酸蒽酮溶液6 mL”起,同法操作,測定吸光度,從標準曲線上讀出供試品溶液中無水葡萄糖的含量,計算后即得。
靈芝多糖標準曲線見圖1。
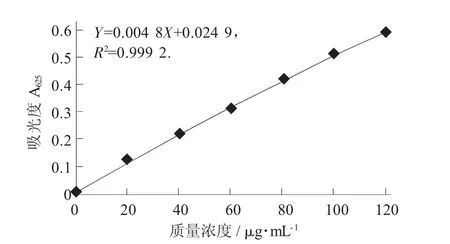
圖1 靈芝多糖標準曲線
1.4.2 三萜及甾醇含量測定
標準曲線的制備:精密稱取齊墩果酸對照品10 mg,置于50 mL容量瓶中,加甲醇溶解并定容至刻度,制成每1 mL含0.2 mg的溶液,即得對照品溶液。量取對照品溶液0.1,0.2,0.3,0.4,0.5 mL,分別置于15 mL具塞試管中,揮干,放冷,精密加入新配制的香草醛冰醋酸溶液(精密稱取香草醛0.5 g,加冰醋酸使溶解成10 mL,即得) 0.2 mL、高氯酸0.8 mL,搖勻,在70℃水浴中加熱15 min,立即置于冰浴中冷卻5 min,取出,精密加入乙酸乙酯4 mL,搖勻,以相應試劑為空白,于波長546 nm處測定吸光度,以吸光度為縱坐標、質量濃度為橫坐標繪制標準曲線。
供試品溶液的制備及含量測定:取靈芝提取物粉末約 2 g,精密稱定,置具塞錐形瓶中,加乙醇50 mL,超聲處理(功率140 W,頻率42 kHz)45 min,濾過,濾液置于100 mL量瓶中,用適量乙醇,分次洗滌濾器和濾渣,洗液并入同一量瓶中,加乙醇至刻度,搖勻,即得供試品溶液。精密量取供試品溶液0.2 mL,置15 mL具塞試管中,照標準曲線制備項下的方法,自“揮干”起,同法操作,測定吸光度,從標準曲線上讀出供試品溶液中齊墩果酸的含量,計算后即得。
靈芝三萜及甾醇標準曲線見圖2。
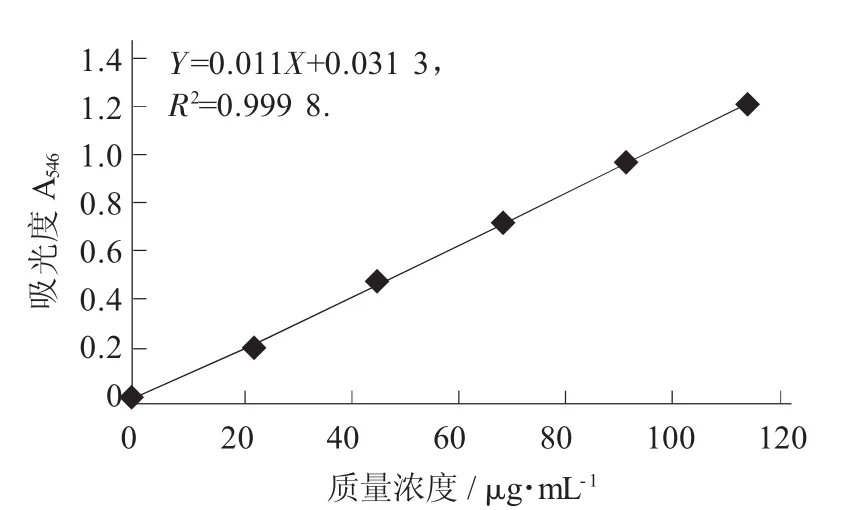
圖2 靈芝三萜及甾醇標準曲線
1.4.3 靈芝酸含量測定
色譜柱:十八烷基硅烷鍵合硅膠柱(4.6 mm×250 mm,5 μm);以 0.4%甲酸為流動相 A,乙腈為流動相B,按下表中的規定進行梯度洗脫,流速為1.0 mL/min,檢測波長254 nm,柱溫25℃。
靈芝酸含量測定梯度洗脫見表1。

表1 靈芝酸含量測定梯度洗脫
對照品溶液的制備:取靈芝酸A和靈芝酸B對照品適量,精密稱定,加甲醇溶解,制成每1 mL含0.25 mg的混合溶液,即得。
供試品溶液的制備:取靈芝提取物粉末2.5 g,精密稱定,置50 mL容量瓶中,精密加入甲醇35 mL,超聲處理40 min,放冷至室溫,用甲醇定容至刻度,搖勻,取上清液用濾膜濾過,即得。
測定法:分別精密吸取對照品溶液、供試品溶液各10 μL,注入液相色譜儀,測定后即得。
靈芝酸標準品液相色譜圖見圖3。
圖3 靈芝酸標準品液相色譜圖
2 結果與分析
2.1 不同處理方法對靈芝提取吸水率和出膏率的影響
不同處理方法對靈芝提取吸水率和出膏率的影響見表2。
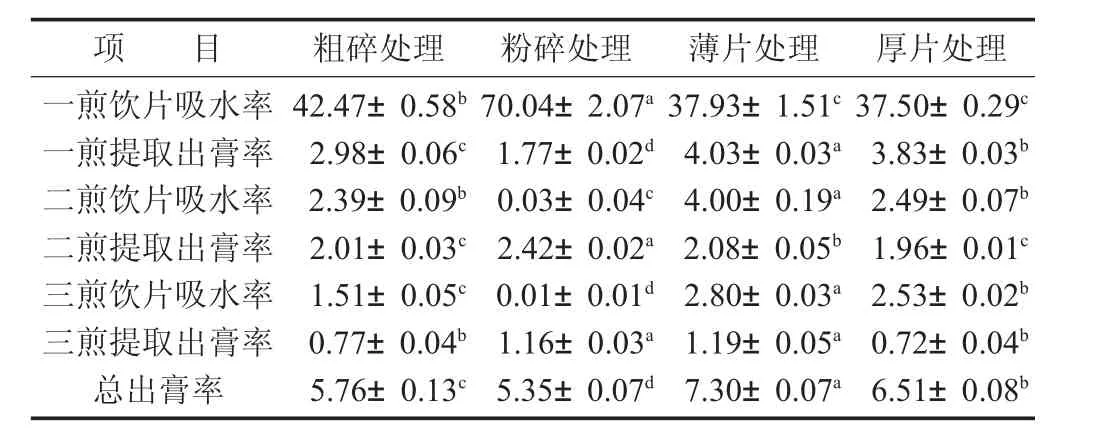
表2 不同處理方法對靈芝提取吸水率和出膏率的影響/%
由表2數據可知,不同靈芝藥材的處理方式,對飲片吸水率有顯著性(p<0.05)的影響,直接影響著靈芝提取溶出效果,導致了出膏率的變化。通過對比可以發現,粉碎處理后的靈芝在第1次煎煮時,吸水率高達70.04%,遠高于粗碎、薄片及厚片處理的吸水率(37.5%~42.47%),而切薄片和切厚片對飲片吸水率影響并不顯著(p>0.05)。同時,飲片一煎吸水率高的粉碎組,在一煎提取出膏率方面僅有1.77%,遠低于其余3組處理(2.98%~4.03%)。最后,從總出膏率數據可以看出,不同的靈芝處理方式對總出膏率具有顯著性差異(p<0.05),其中,靈芝切薄片處理的總出膏率最高,達到7.30%,是粉碎處理組的1.36倍;其次為厚片組,總出膏率為6.51%。
2.2 不同處理方法對靈芝多糖提取的影響
不同處理方法對靈芝多糖提取的影響見表3。
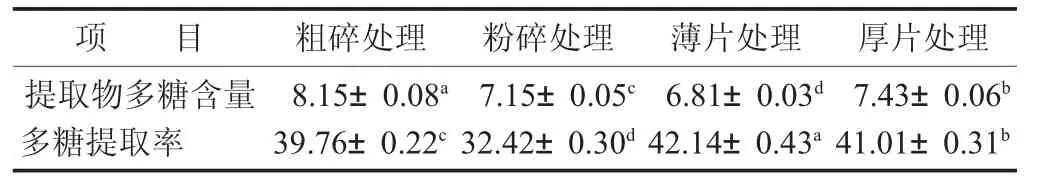
表3 不同處理方法對靈芝多糖提取的影響/%
由表3數據可知,不同處理方式所制得的靈芝提取物多糖含量及提取率差異顯著(p<0.05)。提取物多糖含量依次為粗碎處理>厚片處理>粉碎處理>薄片處理,其中粗碎處理所制得的靈芝提取物多糖含量高達8.15%,遠高于出膏率最高的薄片處理所得的靈芝提取物(6.81%),這是由于薄片組出膏率高,非多糖類物質溶出相對較多,導致提取物多糖含量整體偏低。而另一方面,多糖提取率大小依次為薄片處理>厚片處理>粗碎處理>粉碎處理,說明在固定提取條件下,切薄片處理后的靈芝飲片,更利于靈芝多糖的溶出,其提取率達到了42.14%;相反的,粉碎處理后的多糖提取率僅有32.42%,粉碎后飲片吸水率高的同時,也不利于多糖的溶出。
2.3 不同處理方法對靈芝三萜及甾醇提取的影響
不同處理方法對三萜及甾醇含量的影響見表4。
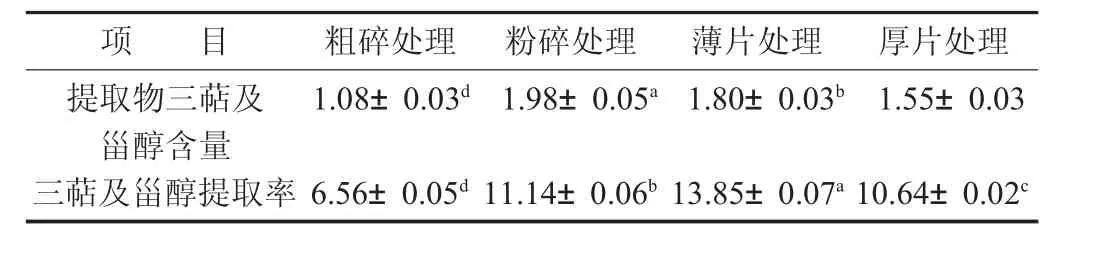
表4 不同處理方法對三萜及甾醇含量的影響/%
由表4數據可知,不同處理方式所制得的提取物三萜及甾醇含量及提取率差異顯著(p<0.05)。提取物含量依次為粉碎處理>薄片處理>厚片處理>粗碎處理,粉碎處理后制得的靈芝提取物三萜及甾醇含量最高,達到1.98%,其次為薄片處理后制得的靈芝提取物,含量為1.80%;而在提取率方面,薄片處理的靈芝三萜及甾醇提取率最高,為13.85%,但4種處理方式的靈芝提取物三萜及甾醇提取率均不高,僅有6.56%~13.85%,處于較低水平,這是由于三萜及甾醇在熱水中溶解度較低所造成的。另一方面,不同處理方式對三萜及甾醇提取率的影響規律與多糖提取率的影響規律也有較大的區別,如多糖提取率最高的粗碎處理方式,其三萜及甾醇提取率僅有6.56%,這也說明,不同的靈芝處理方式對不同的有效成分溶出有較大的影響。
2.4 不同處理方法對靈芝酸(A+B)提取的影響
不同處理方法對靈芝酸(A+B)含量的影響見表5。

表5 不同處理方法對靈芝酸(A+B)含量的影響/%
靈芝酸是一種三萜類物質,大多為四環三萜。由表5數據可知,不同處理方式所制得的提取物靈芝酸(A+B)含量及提取率差異顯著(p<0.05),其中薄片處理所制得的靈芝提取物含量最高,達到1.35%,其提取率也是最高的,達到35.2%,遠高于其他處理方式的樣品。靈芝酸的提取率除了薄片處理組外,其余均不高,這是因為靈芝酸在熱水中的溶解度較低所造成的,但整體而言,靈芝酸(A+B)的提取率比三萜及甾醇的提取率高。
3 結論
試驗發現,靈芝提取過程中飲片吸水率以薄片處理為最低,這樣不僅利于靈芝多糖等水溶性成分的溶出,也利于三萜及甾醇、靈芝酸(A+B)等脂溶性成分的提取,避免有效成分過多殘留在藥渣中。結果表明,不同藥材處理方式對靈芝出膏率、多糖提取率、三萜及甾醇提取率、靈芝酸(A+B)提取率的影響差異明顯,以切薄片處理的靈芝藥材更利于有效成分的提取。
目前,關于靈芝提取工藝的相關研究較多,如劉曉艷等人[13]利用響應面法優化靈芝三萜的提取工藝,得到較高的三萜得率,白鳳岐等人[14]利用正交試驗獲得較優的靈芝多糖提取工藝,崔曉瑩[15]通過比較不同的提取溶劑和提取方法,獲得較理想的靈芝酸提取工藝,但研究均集中在提取溶劑、提取方法的選擇上,且大部分現有靈芝提取工藝文獻中前處理方法為破碎或粉碎處理,對靈芝藥材前處理后,對于提取的影響還沒有相關文獻參考,試驗通過對藥材前處理方法的探討,為進一步完善靈芝各項有效成分的溶出提供參考依據。

