苯并芘和鄰苯二甲酸二(2-乙基己基)酯復合暴露對稀有鮈鯽的內分泌干擾效應研究
付娟娟,郭勇勇,韓建,楊麗華,周炳升,李云峰,倪朝輝
1. 中國科學院水生生物研究所,淡水生態與生物技術國家重點實驗室,武漢 430072 2. 中國科學院大學,北京 100049 3. 中國水產科學研究院長江水產研究所,武漢 430223
長江是亞洲第一長河,也是中國水量最豐富的河流,其水環境與中國人們生活息息相關。長期調查表明,長江水環境中存在多種有機污染物,例如,鄰苯二甲酸酯(phthalic acid esters, PAEs)、多環芳烴(polycyclic aromatic hydrocarbons, PAHs)和多溴聯苯醚(polybrominated diphenyl ethers, PBDEs)等。
鄰苯二甲酸酯(PAEs),又稱酞酸酯,廣泛應用于塑料制品、化妝品、油漆、食品包裝、兒童玩具、潤滑劑和農藥等制造行業中。隨著經濟的發展,PAEs的產量和使用量不斷增加,據估計全球PAEs的總產量已超過800萬t[1],而中國是PAEs的最大進口國,到2010年,中國的PAEs使用量高達136萬t,到2015年,中國PAEs年均使用量增長了約7.7%[2]。在酞酸酯中,鄰苯二甲酸二乙基己酯(di-(2-ethylhexyl)phthalate, DEHP)是目前使用最為廣泛的一種典型的增塑劑,在中國,DEHP年產量占PAEs總產量的80%以上[3],因此是酞酸酯中最主要的增塑劑。目前,DEHP已在全球的非生物介質中以及野生動物和人類的血液、尿液中都不同程度的檢出,是分布非常廣泛的有機污染物,大量DEHP的毒性研究結果表明,DEHP具有生殖毒性、胚胎毒性、肝臟毒性、免疫毒性及致癌性等多種毒性[4-6]。
多環芳烴(PAHs)是一類廣泛存在于環境中的有機污染物,主要是石油、煤等化石燃料和木材、煙草等有機物在不完全燃燒過程中產生的[7];另一方面,在森林火災和火山爆發等自然現象中也可產生PAHs。PAHs可以通過燃料排放和石油泄漏等途徑直接進入水體中,也可以通過大氣循環、遷移轉化等間接途徑污染水體。中國水環境中PAHs污染狀況較為嚴重,在中國長江流域、珠江流域以及遼河流域等水體和沉積物中均檢出不同含量的PAHs[8-9],并且PAHs總量最高達到12.9 μg·L-1[10]。苯并芘(benzo(a)pyrene, BaP)是PAHs中最具代表性的一種污染物,大量流行病學調查及可疑危險因素分析表明,BaP不僅是強致癌物,還是強致畸、致突變劑和內分泌干擾物。其不僅對呼吸系統、心血管系統和免疫系統等有損傷作用,而且與不良妊娠結局的發生密切相關[11]。據諸多研究報道,BaP具有抗雌激素活性,會嚴重影響哺乳動物、水生動物等的生殖系統和繁殖[12]。
在實際水環境中,污染物并非單一存在,所以單一物質的毒性研究已經不能完全反映其在環境中的風險。2種或多種物質混合后,常會發生毒性的改變,稱為毒性的聯合作用。因而聯合毒性效應能夠更加準確、真實地反應污染物的環境風險。聯合作用的類型,一般分為協同作用、加和作用、獨立作用和拮抗作用。當毒物聯合作用的毒性大于其中各毒物成分單獨作用毒性的總和時稱協同作用;多種毒物同時存在時的毒作用為各毒物分別作用時毒作用的總和時稱加和作用;而獨立作用的毒性低于相加作用,但高于其中單項毒物毒性;拮抗作用指的是毒物聯合作用的毒性小于其中各毒物成分單獨作用毒性的總和。對于預測聯合毒性分析的數學模型,應用最廣泛的有濃度加和模型(concentration addition, CA)和效應加和模型(response addition, RA)。其中,CA是混合物風險評價中使用最多的方法,特別是在混合物毒性未知的情況下;而RA是混合物每組分效應的加和,混合物中各組分被認為彼此獨立作用且不影響其他物質的毒性,適用于獨立聯合作用。先前的研究結果顯示,三峽庫區的PAEs和PAHs的范圍分別為1.96~7.81和0.23~0.99 μg·L-1,是最主要的2類有機污染物[13-15]。筆者先前研究了PAHs的代表物BaP對稀有鮈鯽的內分泌干擾效應,結果表明,低劑量BaP暴露不會影響魚體內激素和基因的水平[16],但是對于長江水體中的多種有毒物質同時存在時對珍稀魚類的影響還不清楚。基于PAHs和PAEs在長江上游水體中共同存在的客觀事實,二者聯合暴露更接近于上游珍稀特有魚類的真實生存環境。因此,研究二者聯合暴露的毒理學效應非常必要。
在毒理學研究中,濃度的設置是正式實驗的關鍵,濃度范圍一般介于無效應濃度和最大耐受濃度之間。但在不同的試驗中濃度梯度的設置也存在著一些差別,例如在急性毒性試驗中,污染物濃度水平的設置一般按照等對數間距設置;而在亞慢性試驗中,污染物濃度水平的設置一般按幾何級數設置。此外,在環境風險評價的研究中,低濃度的設置以實際環境劑量為參考,然后按幾何級數遞增。本實驗選擇了長江水域中2種典型的代表污染物DEHP和BaP,以實際環境中BaP和DEHP在長江上游中的含量為依據,各選取2個濃度來探討2種污染物共存的情況下對稀有鮈鯽的內分泌干擾效應。筆者檢測了稀有鮈鯽的形態學指標,血清中性激素水平,以及下丘腦-垂體-性腺軸(hypothalamic-pituitary-gonadal, HPG)相關基因和肝臟中卵黃蛋白原(vitellogenin, VTG)基因的轉錄水平,以評價BaP和DEHP對稀有鮈鯽潛在的內分泌干擾效應,為預測多種污染物共存條件下對長江上游魚類的潛在影響提供科學依據。
1 材料與方法(Materials and methods)
1.1 材料與試劑
苯并芘(BaP,CAS:50-32-8)和鄰苯二甲酸二乙基己酯(DEHP,CAS:117-81-7)購自美國AccuStandard公司,助溶劑為二甲基亞砜(DMSO),購自美國Amresco公司。內標化合物氘代苯并芘(d12-BaP)和氘代鄰苯二甲酸二乙基己酯(d4-DEHP)分別購自美國Supelco和AccuStandard公司。RNA提取試劑(RNAiso Plus reagent)和逆轉錄試劑盒(PrimerScript RTreagent Kit)購自中國Takara公司。熒光定量試劑盒(SYBR Green PCR Kit)購自日本Toyobo公司。睪酮和雌二醇酶聯免疫試劑盒(Testosterone EIA Kit和Estradiol EIA Kit)購自美國Cayman公司。其他所有試劑均為分析純。
1.2 稀有鮈鯽的飼養和暴露實驗
將稀有鮈鯽(Gobiocyprisrarus)飼養在經活性炭過濾且充分曝氣的自來水中,光暗周期為16 h∶8 h,水溫維持在(25±1) ℃,飼養期間每天投喂餌料2次,餌料為小顆粒商品餌料和剛孵化的豐年蟲幼蟲。暴露實驗開始前,將性成熟的稀有鮈鯽(7月齡)以半靜態條件在裝有20 L水的缸中馴養2周。每個缸中放置8條雌魚和8條雄魚,每天清除多余餌料和排泄物。適應期過后,稀有鮈鯽暴露于0、BaP(0.1、1 μg·L-1)、DEHP(10、100 μg·L-1)和BaP+DEHP((0.1+10)、(1+100) μg·L-1)的暴露液中28 d,暴露結束前一天下午停止喂食,使實驗魚空腹。暴露組和溶劑對照組中DMSO的終濃度為0.001%(體積比)。每個濃度包括3個平行缸,暴露期間每天更換1/2的暴露液。28 d后,用0.03%的MS-222將魚麻醉,并用濾紙吸干,稱量并記錄體長和體重,斷尾采血用于激素測定。準確分離腦、肝臟和性腺并稱重,于液氮中瞬間冷凍,保存于-80 ℃中待測。各形態學指標的計算方法如下:
K=m/L3×100%
(1)
BSI=mB/m×100%
(2)
GSI=mG/m×100%
(3)
HSI=mH/m×100%
(4)
式中:K為條件因子,m為體重(g),L為體長(cm),BSI為腦指數,mB為腦質量(g),GSI為性腺指數,mG為性腺質量,HSI為肝臟指數,mH為肝臟質量(g)。
1.3 化學分析
在暴露的第3天和第7天,分別從暴露缸中取換水后水樣200 mL,保存于干凈的玻璃瓶中,經0.7 μm玻璃纖維濾膜過濾后收集過濾液,加入對應的內標化合物。水樣中BaP及DEHP的抽提方法和分析方法參考之前的文獻[17-18]。DEHP用SILICA/PAS玻璃混合型SPE小柱富集(SPE小柱預先用二氯甲烷、乙腈和超純水依次活化),流速控制在6~8 mL·min-1。水樣富集完畢,真空下將柱干燥30 min,然后用乙腈洗脫,洗脫液一并收集到干凈的玻璃瓶中,高純氮氣緩緩吹干,最后用0.1 mL丙酮溶解目標化合物,4 ℃保存待測。BaP用C18填料的SPE小柱富集(SPE小柱預先用二氯甲烷、甲醇和超純水活化),待測水樣以5 mL·min-1的流速流過已活化的C18小柱。水樣富集完畢真空抽濾30 min使柱干燥。然后用二氯甲烷洗脫,洗脫液一并收集到干凈的玻璃瓶中,高純氮氣緩緩吹干,最后用0.1 mL乙腈溶解目標化合物,4 ℃保存待測。本研究利用氣相色譜質譜聯用儀(Agilent 7890A-5975C)分析了對照組和各處理組暴露水體中BaP和DEHP的實際濃度。用程序空白和空白加標來進行質量控制,根據d4-DEHP和d12-BaP測定加標回收率分別在89%~106%和93%~115%之間。
1.4 性激素的抽提與測定
暴露結束后,MS-222(0.03%)麻醉實驗魚,斷尾采血。每2條魚的血混合一起作為一個平行樣,每個濃度雌雄魚各4個平行。在4 ℃、7 000 r·min-1條件下離心5 min,取上清10 μL用于性激素的檢測。激素抽提法參照Guo等[17]的方法。即每個樣品(10 μL血清)中加入390 μL Milli-Q水,渦旋混勻,向其中加入2 mL乙醚,混勻器混勻,于4 ℃、5 000 r·min-1下離心10 min,取上清。再用2 mL乙醚按上述方法抽提一次,將2次抽提后的上清液集中于一個干凈離心管中,用氮氣吹干后保存于-80 ℃。所得樣品用試劑盒中120 μL EIA buffer溶解,按照Cayman Chemical Company公司的睪酮和雌二醇試劑盒說明書檢測性激素含量,其中睪酮的檢測限為6 pg·mL-1,雌二醇的檢測限為19 pg·mL-1。
1.5 實時熒光定量PCR
雌雄魚各不同組織(每個平行由2條魚的樣品合并而成)總RNA提取、純化、定量及cDNA合成法參照Wang等[19]的方法。為避免基因組DNA的污染,初提取物的總RNA用RNase和DNaseI進行消化并純化。用分光光度計測定樣品在260和280 nm下的吸光值,同時用1%的瓊脂糖凝膠電泳進一步檢測RNA的濃度,取1 μg總RNA進行反轉錄得到cDNA,用SYBR Green I染料法對目標基因進行定量檢測(ABI 7300, Applied Biosystem, USA)。反應體系為20 μL,其中包括SYBR Green PCR master mix (Toyobo, Japan) 10 μL、ROX 0.4 μL、5 μmol·L-1正義和反義引物各0.5 μL及cDNA 1 μL和7.6 μL ddH2O。實時定量PCR程序為:95 ℃預變性10 min;95 ℃變性30 s,58 ℃復性20 s,72 ℃延伸1 min,40個循環。內參基因選擇β-actin,內參及目標基因引物序列通過軟件Primer 5 (http://www.premierbiosoft.com/primerdesign/)設計,引物序列見表1。所有樣品的定量檢測至少重復3次,每次3個平行。以2-ΔΔCt法計算目標基因mRNA的相對表達量[20]。
1.6 數據處理與分析
所有數據均用平均值±標準誤表示。通過Kolmogorov-Smirnov方法檢測數據的正態性,通過Levene’s檢驗方法分析數據的方差同質性,數據滿足方差同質性,使用SPSS 13.0軟件(SPSS, Chicago, IL, USA)通過Dunnett’s檢驗對數據進行單因素方差分析,當P<0.05時,即表示有顯著性差異。

表1 實時熒光定量PCR基因引物Table 1 Primer sequences for the quantitative real-time polymerase chain reaction assays used in this study
2 結果(Results)
2.1 暴露水中BaP和DEHP的實際含量
在2次收集(第3天和第7天)的水樣中,BaP和DEHP的含量無明顯差異。暴露水中BaP和DEHP的實際濃度如表2所示。為了方便起見,后面仍用名義濃度表示。
2.2 形態學指標
稀有鮈鯽的形態學指標變化如表3所示。在雌性實驗組中,BaP和DEHP單獨暴露對稀有鮈鯽的各形態學指標均未有明顯影響,在BaP和DEHP復合暴露中,均顯著增加了雌魚的腦指數(P<0.05);在雄性組中,只有在1 μg·L-1BaP和100 μg·L-1DEHP顯著增加了稀有鮈鯽的肝臟指數(P<0.05)。
2.3 血漿中性激素水平
BaP和DEHP單獨暴露下,雌性和雄性稀有鮈鯽的性激素水平均未有顯著性變化(圖1)。在雌魚體內,1 μg·L-1BaP+100 μg·L-1DEHP復合暴露組血漿中睪酮(T)含量與對照組及各自單獨處理組相比顯著性升高(圖1(a)),但血漿中雌二醇(E2)含量與對照組相比顯著性降低(圖1(b))。在復合暴露組中,雄性稀有鮈鯽血漿中的T和E2的水平均未有顯著性改變(圖1(c), (d))。T/E2是性激素異常的敏感指示指標,在雌魚的1 μg·L-1BaP+100 μg·L-1DEHP組中,血漿中T/E2與對照組和各自的單獨處理組相比均顯著性升高(圖1(e)),而雄魚的各濃度組與對照組相比都無顯著性差異(圖1(f))。
2.4 基因表達
對稀有鮈鯽HPG軸和肝臟中相關基因進行了檢測,結果表明,與對照組相比,雌魚中lh和17β-hsd基因表達量在BaP和DEHP單獨暴露時均無顯著差異(表4),單獨100 μg·L-1DEHP處理顯著下調了cyp19a基因的表達(表4),但顯著升高了fsh和cyp17的表達量(表4);與對照組相比,復合暴露的1 μg·L-1BaP+100 μg·L-1DEHP組中,fsh、vtg、cyp17和17β-hsd基因表達量顯著上調了1.62、2.73、1.96和1.28倍(表4),cyp19a則顯著下調了-1.56倍(表4)。
雄性稀有鮈鯽相關基因中,fsh、cyp17、17β-hsd和cyp19a的表達量在BaP、DEHP單獨暴露以及二者復合暴露下均無顯著性差異(表5);lh基因的表達量在BaP和DEHP單獨暴露下均無顯著性改變,而在二者復合暴露高濃度組中,lh的表達量顯著性下調了-1.52倍(表5),vtg基因的表達量在100 μg·L-1DEHP單獨處理組和1 μg·L-1BaP+100 μg·L-1DEHP復合處理組中顯著性上調了1.48倍和1.81倍(表5)。
3 討論(Discussion)
之前大多數研究集中在單一化合物對魚類的毒理學效應,但在實際水環境中,化合物并不是單一存在,因而單一物質評價不能完全反映其在環境中的風險。在本研究中,筆者以中國特有模式魚類稀有鮈鯽為研究對象,評價了長江上游水域主要典型污染物BaP和DEHP共同存在時的生殖內分泌干擾效應。實驗檢測了魚體各形態學指標、體內性激素水平和HPG軸及肝臟中相關基因的表達量。實驗結果表明,BaP、DEHP單獨暴露時對稀有鮈鯽性激素含量和基因表達基本上無顯著影響,但兩者復合暴露情況下,在高濃度復合暴露組顯著改變了稀有鮈鯽體內性激素的水平及相關基因的表達,說明BaP和DEHP共同存在的情況下,顯著增強了它們各自的毒性效應,表現為協同效應。
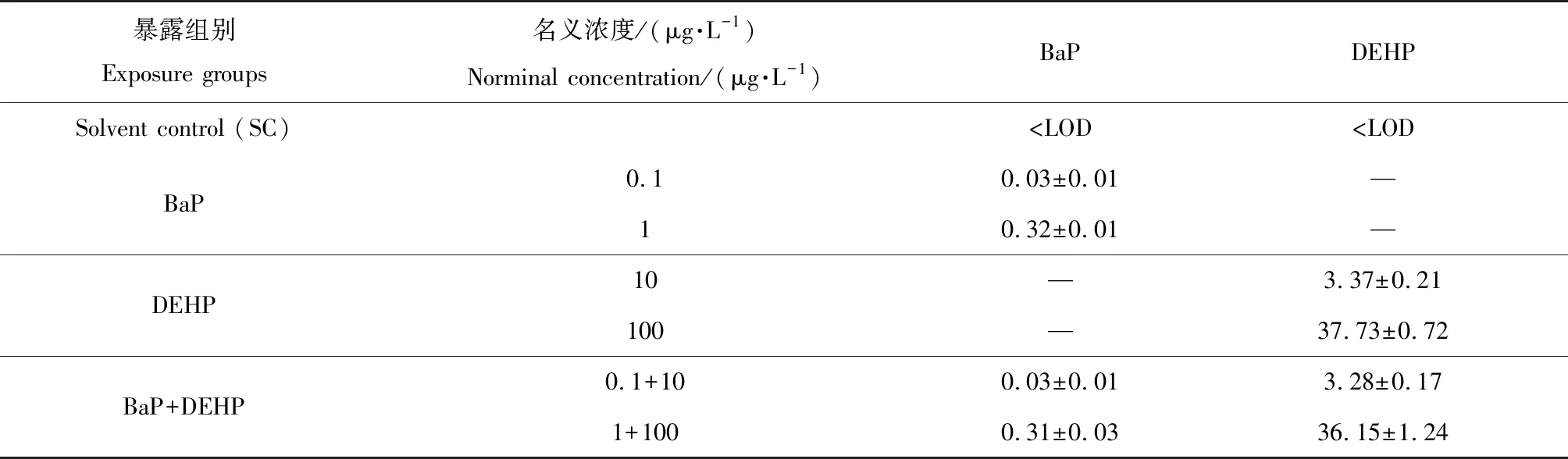
表2 利用GC-MS檢測各單獨或復合暴露組中苯并芘(BaP)和鄰苯二甲酸二(2-乙基己基)酯(DEHP)的濃度Table 2 The measured concentrations of benzo(a)pyrene (BaP) and di-(2-ethylhexyl)-phthalate (DEHP) in each single or co-exposure group by GC-MS analysis
注:實驗結果以平均值±標準誤表示;—表示沒有檢測,LOD為檢測限。
Note: Data are expressed as mean±SEM; — means not detected; LOD means limits of detection.

表3 稀有鮈鯽暴露于不同濃度BaP、DEHP和BaP+DEHP中28 d后體質系數的變化Table 3 Somatic indices of rare minnow after exposure to BaP, DEHP and BaP+DEHP
注:實驗結果以平均值±標準誤表示,每個濃度24條魚,*表示P<0.05,實驗組與對照組相比,差異顯著。
Note: Data are expressed as mean±SEM; there are 24 fish in each exposure concentration; *P<0.05 indicates the statistically significant differences compared to the control groups.

圖1 稀有鮈鯽暴露于不同濃度BaP、DEHP和BaP+DEHP中28 d血漿中睪酮(T)、雌二醇(E2)水平和T/E2比值的變化注:測定結果以平均值±標準誤表示,每個濃度4個平行樣,平均數后上標不同字母表示處理組間差異顯著(P<0.05)。Fig. 1 Effects on levels of serum testosterone (T), 17β-estradiol (E2) and T/E2 ratio in rare minnows after exposure to BaP, DEHP and BaP+DEHPNote: Data are expressed as mean±SEM; there are 4 replicates in each exposure concentration; different letters indicate the significant difference among the exposure groups (P<0.05).
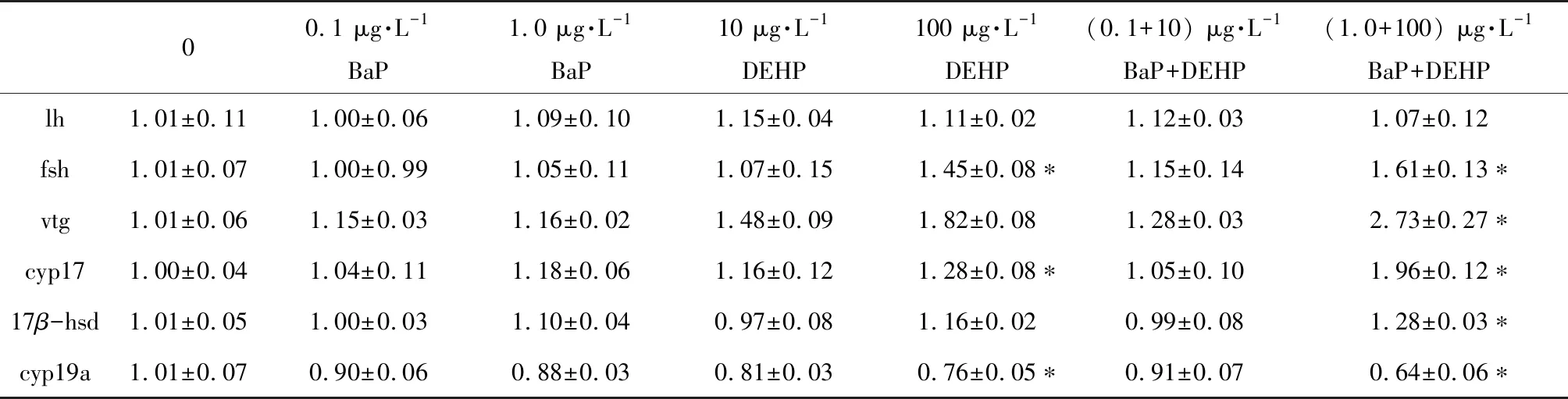
表4 稀有鮈鯽暴露于不同濃度BaP、DEHP和BaP+DEHP 28 d后雌魚HPG軸和肝臟中相關基因的表達水平Table 4 mRNA expression of related genes in HPG axis and liver of female rare minnows after exposure to BaP, DEHP and BaP+DEHP for 28 d
注:實驗結果以平均值±標準誤表示,*表示P<0.05。
Note: Data are expressed as mean±SEM; *P<0.05 indicate the statistically significant differences.
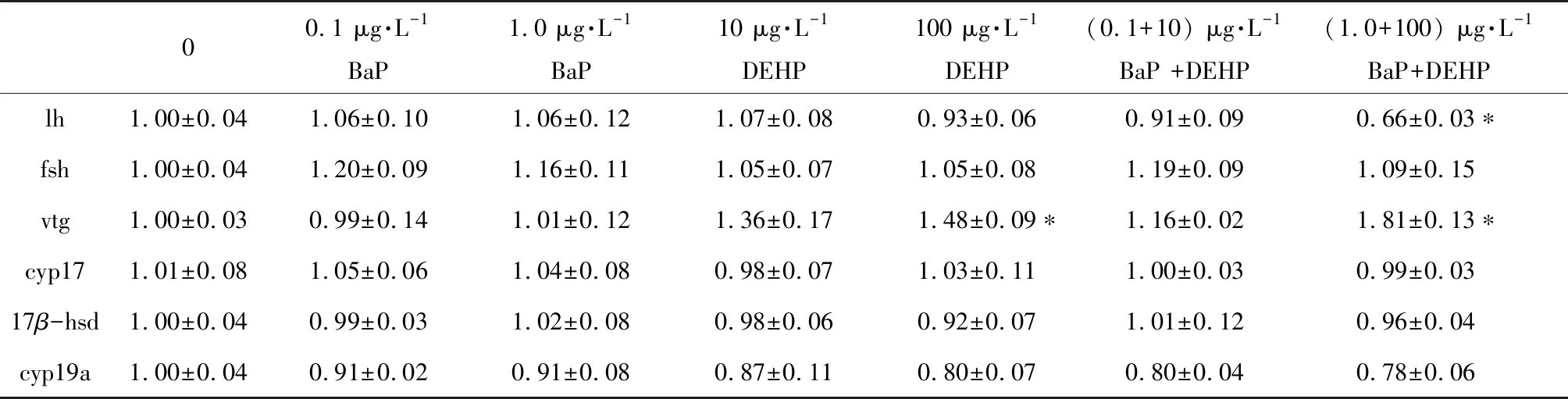
表5 稀有鮈鯽暴露于不同濃度BaP、DEHP和BaP+DEHP 28 d后雄魚HPG軸和肝臟中相關基因的表達水平Table 5 mRNA expression of related genes in HPG axis and liver of male rare minnows after exposure to BaP, DEHP and BaP+DEHP for 28 d
注:實驗結果以平均值±標準誤表示,*表示P<0.05。
Note: Data are expressed as mean±SEM; *P<0.05 indicates the statistically significant differences.
在毒理學研究中,性激素水平變化是評價生殖內分泌干擾效應的一個重要指標。在本實驗中,稀有鮈鯽經過28 d暴露后,1 μg·L-1BaP+100 μg·L-1DEHP暴露組的雌魚血漿中睪酮含量顯著升高但雌二醇含量顯著降低,表現出性別特異性和濃度依賴關系。以往研究表明,BaP和DEHP均是環境中普遍存在的內分泌干擾物,且二者對哺乳動物、魚類等生物均具有生殖內分泌干擾效應[11,21]。有研究人員用50 mg·kg-1的BaP注射性成熟的虹鱒(Oncorhynchusmykiss),發現無論雌魚還是雄魚,血漿中雌二醇和睪酮含量均顯著性降低[22]。同樣,石首魚(Micropogoniasundulates)經腹腔注射BaP后,血漿中睪酮和雌二醇含量也顯著受到抑制[23]。另外,筆者之前的研究結果表明,將稀有鮈鯽暴露于不同濃度的BaP 28 d后,3 μg·L-1BaP暴露后的雌雄魚體內的雌二醇含量顯著性降低[16]。雖然本實驗中BaP單獨暴露對稀有鮈鯽體內性激素水平沒有影響,但是這有可能是BaP暴露濃度較低導致的,這也與筆者之前實驗結果相符。對于DEHP的研究指出,將成年稀有鮈鯽暴露于環境相關劑量的DEHP(3.6、12.8、39.4和117.6 μg·L-1)中21 d后,在雌魚中,睪酮含量升高,雌二醇含量降低,T/E2比例增加[19]。除此之外,筆者將成年稀有鮈鯽暴露于環境相關劑量的DEHP(4.2、13.3和40.8 μg·L-1)中6個月,結果顯示,在雌魚體內,雌二醇和睪酮的含量均顯著性降低[17]。此外,將雄性黑頭呆魚(Pimephalespromelas)暴露于環境相關劑量(12 μg·L-1)的DEHP 28 d,明顯降低了黑頭呆魚體內E2的水平[24]。以上這些結果說明,DEHP暴露打破了動物體內激素系統的平衡,產生了干擾效應。在本實驗中,只有BaP和DEHP同時存在時,高濃度組的雌魚體內睪酮和雌二醇含量才會顯著性改變,表明在一定濃度范圍內,二者同時作用時會增強對稀有鮈鯽的生殖內分泌干擾效應,表現為協同效應。
在類固醇激素合成的過程中,一系列激素(如FSH、LH)和酶類(CYP17、17β-HSD和CYP19a等)發揮著重要作用[25]。魚類的FSH主要是刺激性腺分泌雌二醇和睪酮等性類固醇激素,LH與排精和排卵有關[26]。而類固醇合成酶對類固醇激素的產生同樣是至關重要的,編碼這些合成酶的基因上調或者下調,會導致類固醇激素(如T、E2)合成效率的升高或降低。本實驗1 μg·L-1BaP+100 μg·L-1DEHP中雌魚fsh表達量顯著上調可能是雌二醇顯著降低的一種負反饋機制。此外,在本實驗中還觀察到1 μg·L-1BaP+100 μg·L-1DEHP組中雌魚性腺中的cyp17和17β-hsd表達量顯著上調,而cyp19a表達量則受到顯著性抑制。在魚類類固醇激素合成的過程中,cyp17編碼的蛋白催化黃體酮轉化為17α-羥基黃體酮,繼續催化轉化為雄烷二酮,進而通過17β-HSD轉化為睪酮,而cyp19a編碼的芳香化酶可以催化睪酮轉化為雌二醇[25]。因此,cyp19a基因表達量受到抑制可能會抑制睪酮向雌二醇的轉化,導致血漿中睪酮水平的升高和雌二醇水平的降低,而cyp17和17β-hsd基因表達的上調可能是機體對于雌二醇下降的一種補償機制。先前有研究報道稱,DEHP可通過激活過氧化物酶體增殖物激活受體(PPARs)的表達來抑制芳香化酶的活性,從而抑制E2的產生[26]。但也有研究發現,DEHP和利谷隆復合暴露導致的雄性黑頭呆魚血清中睪酮含量降低并不是因為抑制了與類固醇生成相關的基因,也不是由于激活PPARs基因的表達,而是升高了類固醇激素分解代謝的水平如升高了肝臟中CYP3A4以及睪丸中磺基轉移酶的表達水平[24]。筆者先前的研究觀察到稀有鮈鯽暴露DEHP 21 d后,雌魚血漿中雌二醇含量降低,性腺中cyp17的表達量上調,而cyp19a的表達量下調[19]。同樣,在BaP單獨暴露時,也發現雌性斑馬魚(Daniorerio)性腺中cyp19a基因表達顯著下調的現象,并且肝臟中vtg表達量也顯著受到抑制[27]。以上結果說明,DEHP單獨或與其他化合物共存的情況下,可能通過不同的作用模式對魚類產生不良影響。在本研究中,BaP和DEHP復合暴露的情況下,可能通過抑制芳香化酶的活性導致T向E2轉化效率的降低,從而導致T的升高和E2的下降,E2的下降通過機體自身的負反饋機制上調了fsh基因的表達,但具體的作用機理需要后續進一步的研究。在魚類中,卵黃蛋白原(VTG)是卵子發生,卵子成熟及卵黃合成中必不可少的營養物質,是雌激素效應敏感的生物標志物。本實驗中觀察到的雌魚雌二醇含量降低而vtg基因表達量卻顯著升高的現象在之前的實驗中也有觀察到,例如,在長期低劑量DEHP暴露后,稀有鮈鯽雌魚血漿中雌二醇含量下降,而vtg表達量上調,猜測這可能是由于這些具有雌激素活性的化合物直接作用于雌激素受體,從而誘導vtg基因表達[17]。而在本次實驗中,觀察到除了高濃度的DEHP組和高濃度的復合暴露組中lh和vtg表達量改變之外,所有濃度組對雄性稀有鮈鯽基本無顯著影響。
本研究得出以下結論:較高濃度的BaP和DEHP同時存在時,會改變雌性稀有鮈鯽血漿中睪酮和雌二醇含量,同時引起了HPG軸和肝臟中相關基因表達量的改變,而低劑量的復合暴露以及單獨的BaP、DEHP處理并沒有引起激素或相關基因的改變。這一結果說明,BaP和DEHP共同存在時,會改變它們各自的毒性,表現出協同效應;此外,由于長江上游水體中BaP和DEHP含量遠低于本實驗觀察到的效應濃度,筆者推測,三峽庫區上游水體中的BaP和DEHP并不會對該區域的魚類產生生殖內分泌干擾效應。

