加權基因共表達網絡分析全氟和多氟烷基化合物對人間充質干細胞的毒性靶點
潘一帆,秦會,劉薇
大連理工大學環境學院 工業生態與環境工程重點實驗室,大連 116024
全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)的生產和使用逐漸被禁止后,新型替代品用量顯著升高,目前已有超過3 000種全氟多氟化合物(per- and polyfluoroalkyl substances, PFASs)被投入全球市場[1-2]。新型替代品的環境效應和健康風險未知,給PFASs的監管帶來了極大的挑戰。氯代多氟醚基磺酸(chlorinated polyfluoroalkyl ether sulfonates, Cl-PFESAs)作為鉻霧抑制劑在中國使用長達30余年,因其與PFOS相似的化學結構和理化性質,被視作PFOS的替代品[3]。初步研究發現,Cl-PFESAs具有肝臟毒性和發育毒性等有害效應,有必要進行深入的毒理學研究,揭示其敏感作用靶點[4-6]。傳統的動物實驗無法針對大量的化學品開展高通量研究,且與人體健康效應存在種間差異。因此,為揭示大量PFASs的毒性效應與敏感靶點,亟需敏感可靠的高通量毒理學模型。
人源干細胞由于具有增殖分化潛能,且其分化過程良好地模擬了人體的生長發育,是一類研究化學品潛在發育毒性的適宜模型[7-8]。基于人體解剖和動物實驗的研究表明,PFASs可于骨骼中蓄積,這提示骨骼可能是PFASs的作用靶組織[9]。流行病學研究指出,暴露于PFASs與骨密度降低和骨關節炎的發生有一定的關聯[10-11]。因此,來源于人骨髓的間充質干細胞(human bone marrow mesenchymal stem cells, hBMSCs)可能是PFASs的作用靶細胞。筆者在前期研究中發現,PFOS暴露干擾了hBMSCs的成骨和成脂分化[12]。這些線索提示,hBMSCs是PFASs毒性靶點研究的一種靈敏、準確的毒理學模型。
轉錄組學分析是分子毒理學研究的重要手段,通常按照表達規律對基因進行富集歸類,然后對已分類基因開展功能或調控分析。加權基因共表達網絡分析(weighted gene co-expression network analysis, WGCNA)基于多基因間的表達相關性,不僅可鑒定高度協同變化的基因模塊,同時也可根據基因模塊與特定性狀或表型之間的關聯鑒定生物標記基因和敏感靶點,廣泛應用于疾病發生與基因關聯分析,是篩選疾病治療靶點的出色工具[13]。本研究選擇hBMSCs體外模型,基于其基因表達譜,結合WGCNA方法探究Cl-PFESAs、PFOS、全氟己烷磺酸(perfluorohexane sulfonate, PFHxS)和全氟辛酸(perfluorooctanoic acid, PFOA)這4種PFASs暴露與特定基因模塊間的關聯,分析PFASs干擾的生物學過程和敏感靶基因。對PFOS和PFOA這2種全氟化合物已有較為深入的毒理學研究,而PFHxS和Cl-PFESAs則被選作2種代表性替代品。本研究將其與PFOS/PFOA暴露下細胞基因組學特征相比較,有利于預測和評估替代品的潛在毒性效應及分子靶點,以期為該類化學品的毒理學研究、安全性評價與監管提供依據。
1 材料與方法(Materials and methods)
1.1 試劑
工業級Cl-PFESAs產品購自上海中科合臣股份有限公司,該產品為8碳和10碳Cl-PFESA的混合物,商品名為F-53B(Cl(CF2)6O(CF2)2SO3K, CAS 73606-19-6),純度大于98%。純度≥98% PFOS (C8F17KO3S)、純度為95% PFOA (C8F15KO2)和純度≥98% PFHxS (C6F13SO3K)購自Sigma-Aldrich。二甲基亞砜(DMSO),純度大于99.5%,購自Panreac-Applichem(德國)。PFASs暴露液配制過程中均使用終濃度為0.1%的DMSO作為助溶劑。
1.2 細胞培養及處理
由廣州賽業生物提供的人骨髓間充質干細胞,取自健康供體,細胞常規檢測結果表明,細菌、真菌和支原體顯陰性,內毒素小于10 EU。細胞鑒定檢測結果表明,細胞復蘇貼壁率大于95.1%,可分化為成骨、成脂和成軟骨細胞。細胞表面標記分子檢測結果顯示,CD105、CD29、CD73和CD44呈陽性,CD34、CD45和CD11b呈陰性。
細胞置于37 ℃、5% CO2的培養箱中,利用hBMSCs基礎培養基(廣州賽業生物)進行培養及傳代。取第6代細胞接種于細胞培養板中,1 d后將基礎培養基換為含100 nmol·L-1的Cl-PFESAs、PFOS、PFHxS或PFOA的暴露培養基,以及含0.1% DMSO的溶劑對照培養基,持續暴露7 d,每2~3天更換培養基。
1.3 細胞RNA抽提、純化和芯片檢測
暴露7 d后,利用TRIzol(Life technologies,美國)抽提細胞總RNA。利用核酸定量儀測定RNA純度和濃度,并用瓊脂糖凝膠電泳判斷質量,然后進行芯片檢測。芯片雜交和掃描由上海伯豪生物公司完成。芯片雜交按照Affymetrix表達譜芯片(美國)的標準流程進行,使用GeneChip?Hybridization和Wash and Stain Kit試劑盒(Affymetrix),在滾動雜交爐(Hybridization Oven 645, Affymetrix)中45 ℃滾動雜交16 h,雜交完成后在洗滌工作站(Fluidics Station 450, Affymetrix)進行芯片的洗滌。掃描芯片結果(GeneChip?Scanner 3000, Affymetrix),用Command Console Software 4.0 (Affymetrix)讀取原始數據。原始數據已上傳于GEO數據庫(GSE115836)。芯片測試共分為5組(DMSO溶劑對照組、Cl-PFESA暴露組、PFOS暴露組、PFHxS暴露組和PFOA暴露組),每組3個平行。
1.4 加權基因網絡共表達分析
利用R語言軟件包WGCNA,按照默認參數構建加權基因共表達網絡,篩選代表性PFASs共同影響的生物學功能和敏感靶基因[13]。首先對芯片中總計49 293個探針進行初步篩選,排除多個探針對應同一基因的情況,共獲得20 014個基因。為篩選差異表達倍數差異較高的基因,計算了15個細胞樣本中20 014個基因各自差異表達倍數的方差,并選取方差較大的前25%的基因,共得到了5 004個基因用于后續分析[14-15]。對樣本進行皮爾遜相關性分析,篩查是否存在離群樣本。確保不存在離群樣本后,在基因間進行皮爾遜相關性分析,按照無尺度網絡標準構建鄰接矩陣。為降噪和更好地衡量基因網絡連通性,將鄰接矩陣轉化為拓撲重疊矩陣。然后利用動態剪切枝法劃分基因模塊,并將相似分支進行合并。
1.5 基因模塊與PFASs暴露相關性分析
為探究哪些基因模塊與PFASs暴露存在關聯,計算模塊特征向量(module eigengene, ME),并利用ME計算基因模塊與溶劑對照組以及PFASs暴露組細胞基因表達譜間的相關系數(correlation coefficient,r),將P≤0.05定義為顯著相關。
1.6 基因模塊功能注釋與樞紐基因篩選
提取基因模塊中的基因,利用Database for Annotation, Visualization, and Integrated Discovery(DAVID)進行功能注釋[16],并利用cytoscape對WGCNA構建的包含PFASs潛在靶點的基因共表達網絡進行可視化,依據連通性篩選網絡中的樞紐基因。
2 結果(Results)
2.1 PFASs作用下hBMSCs的基因共表達網絡構建
利用15個細胞樣本方差前25%的5 004個基因構建共表達網絡。首先用flashclust函數執行層次聚類分析,無明顯離群值。按無尺度網絡標準建立臨近矩陣,為使網絡節點連接度的對數與該節點出現概率的對數相關系數≥0.9(圖1(a)),計算確認臨近函數加權參數,可得軟閾值(β)為16,進行網絡構建,得到14個模塊(圖1(b)),此外有938個基因未能分配到任何一個模塊(灰色)。隨后對14個模塊進行層次聚類分析(圖1(c)),判別不同基因模塊間的關聯。
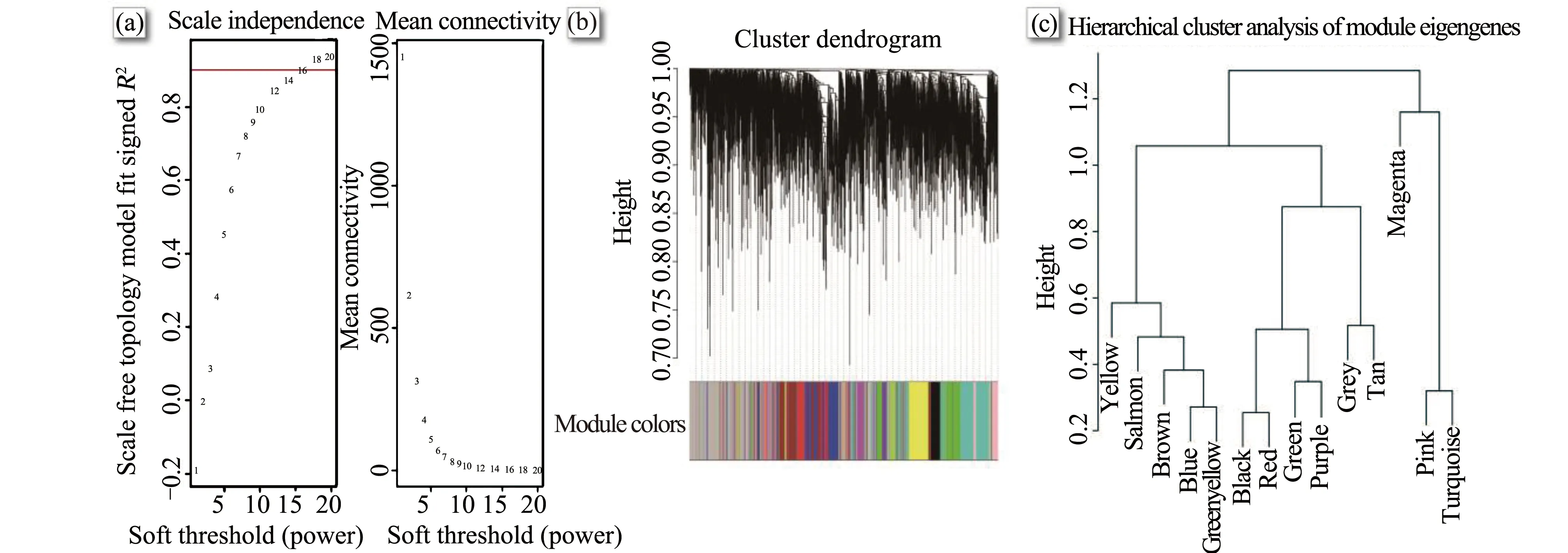
圖1 軟閾值確定(a)、基因聚類樹和模塊顏色劃分(b)和模塊聚類分析(c)Fig. 1 Identification of soft threshold (a), clustering dendrograms of genes together with assigned module colors (b) and module cluster analysis (c)
2.2 基因模塊與PFASs暴露的相關性分析
對基因模塊和PFASs暴露組樣本進行相關性分析,溶劑對照組與Brown(r=0.63,P=0.01)、Greenyellow(r=0.66,P=0.001)和Blue模塊(r=0.66,P=0.007)顯著正相關(圖2)。Cl-PFESA暴露組與Greenyellow模塊顯著負相關(r=-0.61,P=0.02),PFOS暴露組與Blue模塊顯著負相關(r=-0.62,P=0.01)。PFOA和PFHxS暴露組與Greenyellow和Blue模塊無顯著相關性。這表明,PFASs暴露組中Brown、Greenyellow和Blue模塊基因表達模式與對照組有較大差異,提示相關模塊中基因調控的生物學過程可能受到4種PFASs的影響,且模塊中可能包含4種PFASs共同作用的靶基因。此外,聚類分析結果發現,black模塊和red模塊相關度較高(圖1(b)),并與PFOS暴露顯著正相關(圖2),提示其調控的生物學過程可能受到PFOS的干擾。
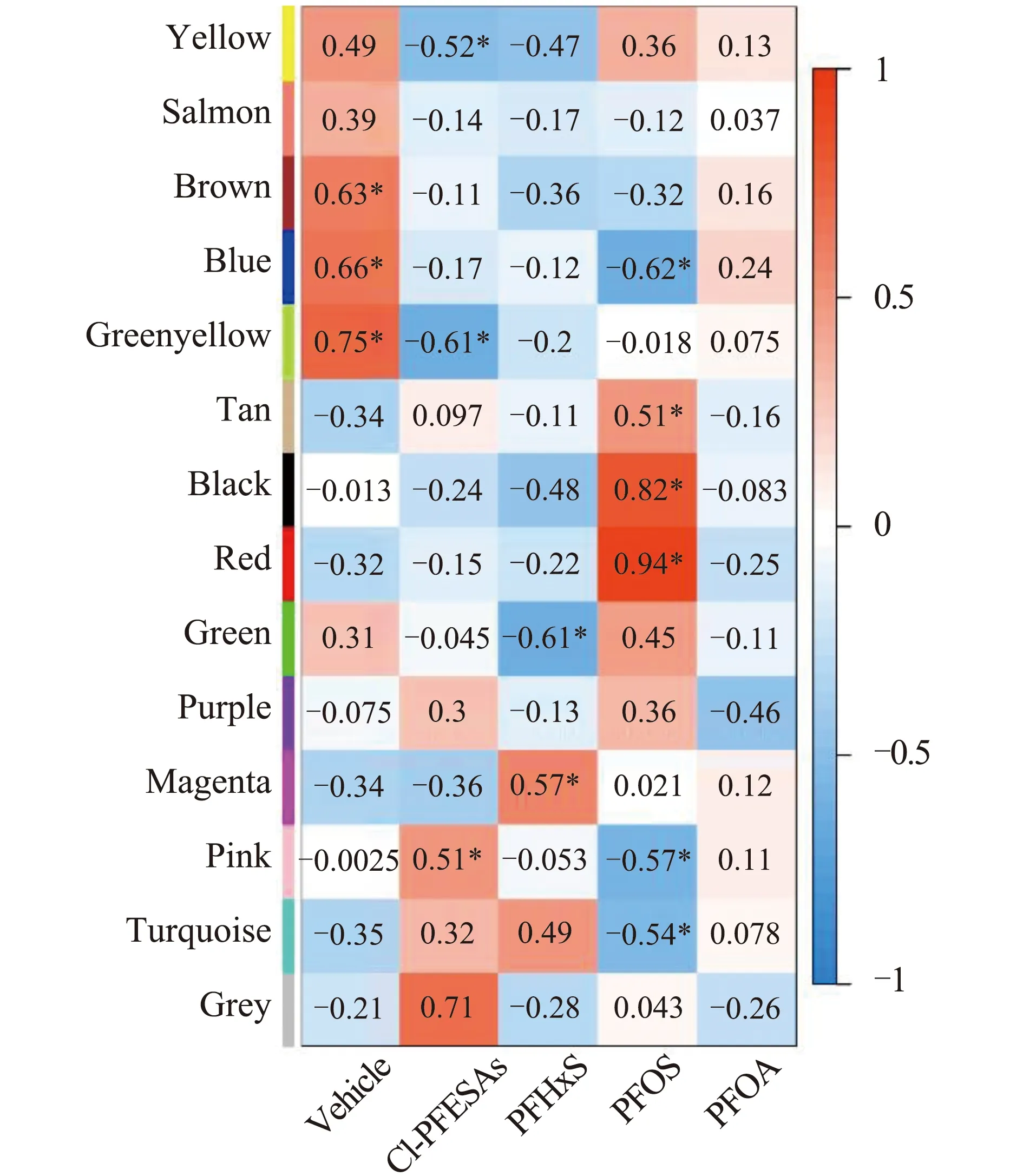
圖2 基因模塊與全氟多氟化合物(PFASs)暴露細胞樣本間的相關系數注:Cl-PFESAs表示氯代多氟醚基磺酸,PFHxS表示全氟己烷磺酸,PFOS表示全氟辛烷磺酸,PFOA表示全氟辛酸;* P≤0.05,顯著相關。Fig. 2 Correlation coefficients between modules and per- and polyfluoroalkyl substances (PFASs) exposed samplesNote: Cl-PFESAs, chlorinated polyfluoroalkyl ether sulfonates; PFHxS, perfluorohexane sulfonate; PFOS, perfluorooctane sulfonate; PFOA, perfluorooctanoic acid; *significance of correlation at P≤0.05 level.
2.3 PFASs影響基因模塊的生物學功能分析
為了解每個模塊所表征的生物學功能,筆者提取了每個模塊中的基因,并利用DAVID進行生物學過程富集分析。每個模塊中最顯著的3個生物學過程如圖3所示。Greenyellow模塊中顯著富集“骨髓白細胞分化負調控”以及“嘧啶和嘌呤核苷酸的代謝過程”,提示PFASs可能干擾核酸代謝以及免疫細胞分化。與PFOS暴露顯著相關的Red和Black模塊中分別富集出與糖酵解和線粒體氧化磷酸化相關的生物學過程,提示PFOS可能影響細胞呼吸過程。Blue模塊中富集出蛋白質合成的tRNA氨酰化以及膽固醇和異戊二烯的生物合成,提示PFASs可能干擾蛋白質合成以及脂質代謝等。此外,在Blue模塊中顯著富集出“成骨分化”,提示PFASs對hBMSCs成骨分化的干擾作用。Brown模塊中顯著富集“骨化”,并且與PFOS顯著相關的Tan模塊中顯著富集出“成骨分化正調控過程”,進一步提示PFASs對骨形成的干擾作用。
2.4 識別PFASs暴露干擾的模塊樞紐基因
由于Blue模塊中顯著富集出與脂質代謝相關的生物學過程,而干擾脂質代謝是PFASs的主要毒性效應之一[17],因此,進一步探究PFASs影響的Blue模塊的基因共表達,以及篩選樞紐基因。利用WGCNA輸出的模塊網絡文件結合Cytoscape的Blue模塊基因共表達網絡圖(基因節點間權重>0.1),并根據連通性篩選樞紐基因(圖4)。在Blue模塊中,連通性最高的4個樞紐基因分別為Delta(24)-sterol reductase (DHCR24)、Squalene monooxygenase (SQLE)、Laminin subunit alpha-1 (LAMA1)、3-beta-hydroxysteroid-delta(8), delta(7)-isomerase (EBP)。這4個樞紐基因均顯著下調(P≤0.5)(表1)。
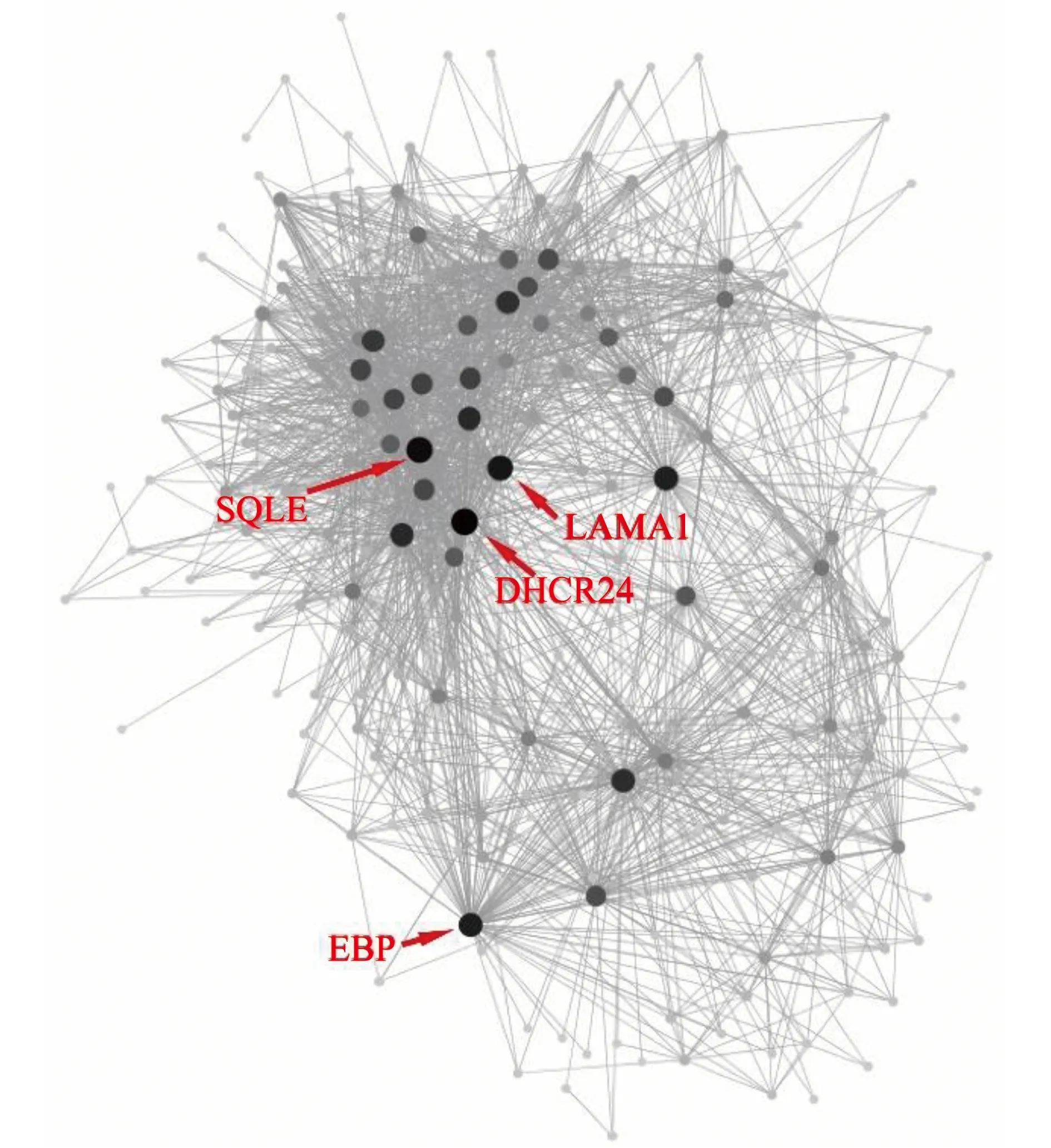
圖4 Blue模塊基因共表達網絡圖注:SQLE表示樞紐基因鯊烯環氧酶,LAMA1表示樞紐基因層粘連蛋白α1亞基,DHCR24表示樞紐基因24-脫氫膽固醇還原酶,EBP表示樞紐基因甾醇δ異構酶;基因節點大小、顏色與基因節點連通性呈正相關。Fig. 4 Gene co-expression network of Blue moduleNote: SQLE, squalene monooxygenase; LAMA1, hub gene laminin subunit alpha-1; DHCR24, hub gene delta(24)-sterol reductase; EBP, hub gene 3-beta-hydroxysteroid-delta(8), delta(7)-isomerase; size and color of gene node positively correlate with connectivity of gene node.
3 討論(Discussion)
利用WGCNA分析了4種PFASs暴露所影響的hBMSCs的關鍵生物學過程,并通過篩選相應生物學過程中的樞紐基因識別靶標基因。
基于PFASs暴露后hBMSCs的基因表達譜信息構建的14個基因模塊中,Brown、Blue和Greenyellow模塊中的基因表達模式在PFASs暴露組細胞中與對照組間存在較大差異。Greenyellow模塊中富集的最顯著的生物學過程是骨髓白細胞分化的負調控。Brieger等[18]研究了PFOS和PFOA體外暴露對人外周白細胞的影響,發現PFOA顯著增強了骨化三醇誘導的HL-60細胞株的單核細胞分化,并增加了巨噬細胞IL-6和TNF-α的釋放,而在脂多糖刺激后PFOS暴露降低了促炎細胞因子TNF-α的釋放。此外,Corsini等[19]發現全氟丁烷磺酸(perfluorobutane sulfonic acid, PFBS)、全氟癸酸(perfluorodecanoic acid, PFDA)、PFOS和氟調聚醇(fluorotelomer, 8:2 Telomer)均抑制了脂多糖誘導的TNF-α生成。動物實驗和流行病學研究均已發現PFOS等全氟烷酸化合物暴露與免疫功能異常之間的關聯[17],但目前尚無關于Cl-PFESA等新型替代品的免疫毒理學研究。本研究通過PFASs對轉錄組的影響和WGCNA分析,證明免疫功能是PFASs毒性效應的敏感靶標。骨髓是人體重要的免疫器官,hBMSCs在調節骨髓微環境及其免疫功能中起到關鍵作用[20]。因此,以hBMSCs為毒理學研究模型,對于揭示免疫干擾作用和機制具有重要意義。
Blue模塊中最顯著富集的生物學過程為膽固醇生物合成。此外,其基因共表達網絡中連通性最高的樞紐基因DHCR24、SQLE和EBP均與脂質代謝相關。DHCR24可催化甾醇中間體δ-24雙鍵的還原,此外還可通過降低氧化應激誘導的細胞凋亡過程中caspase 3的活性來保護細胞免受氧化損傷[21]。只要上游膽固醇合成過程未被完全抑制,DHCR24下調很可能導致膽固醇累積[22]。SQLE可催化甾醇生物合成中的第一個氧化步驟,是該途徑的限速酶之一,研究表明SQLE受到影響可干擾膽固醇穩態[23]。EBP可催化δ(8)-甾醇轉化為其相應的δ(7)-異構體[24]。PFASs暴露導致以上幾個基因表達下調,為進一步驗證DHCR24、SQLE和EBP為PFASs作用的潛在敏感靶基因,本研究利用比較毒理組學數據庫對PFOS和PFOA的互作基因進行了檢索[25]。結果表明,PFOA的2 731個互作基因和PFOS的2 001個互作基因中包含本研究富集出的膽固醇的生物合成過程14個基因中的13個,并且在PFOS和PFOA互作基因中都包含EBP和SQLE,而DHCR24包含于PFOA互作基因中。此外,來源于大鼠[26]、小鼠[27]和人肝癌細胞[28]等體內體外模型的研究表明,PFOS或PFOA可干擾DHCR24、SQLE和EBP基因或蛋白的表達,變化趨勢與暴露模式和受試生物的種類有關。比較毒理組學數據和實驗結果均支持本研究利用WGCNA分析hBMSCs基因組數據識別出的樞紐基因。
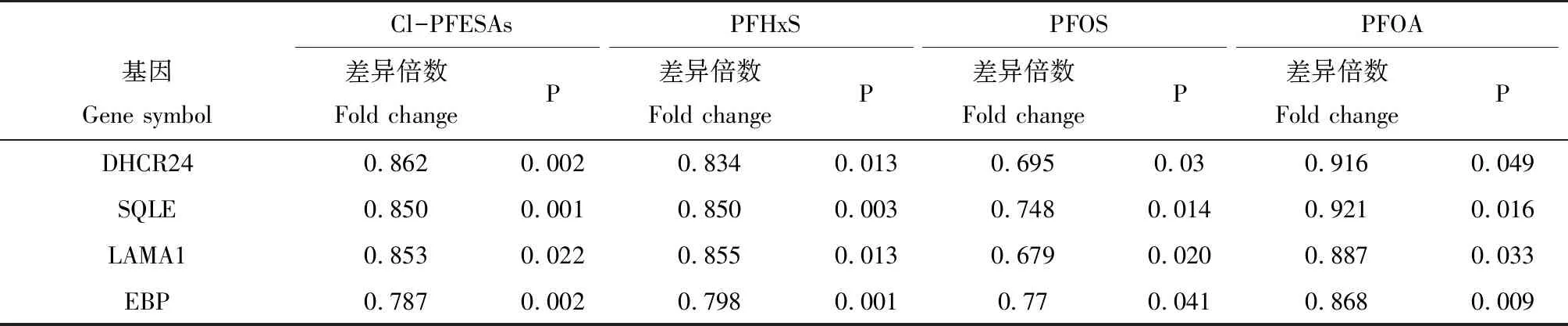
表1 PFASs暴露對Blue模塊中樞紐基因表達水平的影響Table 1 Effects of PFASs exposure on hub genes expression from Blue module
PFASs干擾嚙齒類動物脂質代謝過程的主要機制是激活PPARα這一脂質代謝的關鍵調控因子[17,29]。在脂肪干/祖細胞中,PFASs主要通過激活PPARγ促進細胞成脂分化[5,30]。hBMSCs是脂肪細胞和成骨細胞共同的祖細胞,其成骨成脂分化平衡異常與代謝疾病和發育相關疾病密切相關[31]。與PFOS顯著相關的Tan模塊中“成骨分化正調控過程”顯著富集(r=0.51,P=0.05),并且Blue和Brown模塊中分別顯著富集“成骨分化”和“骨化”,提示PFOS可干擾成骨/成脂分化平衡。前期筆者在基于細胞分化的分子標志物和表型標志物的研究中,發現PFOS在人體暴露相關濃度下即可促進hBMSCs成脂分化并抑制其成骨分化,部分原因可能是由于PFOS對Wnt信號通路的干擾,但可能仍存在其他機制,需要更深入研究[12]。而本研究結果提示,若繼續探究PFASs干擾成骨或成脂分化的機制,可圍繞本研究識別的相關樞紐基因展開。基于hBMSCs基因表達譜的WGCNA分析,有助于識別PFASs毒性作用敏感靶標,揭示PFASs干擾脂質代謝的分子機理。
綜上,本研究基于hBMSCs的基因表達譜,利用WGCNA方法對4種典型PFASs毒性作用干擾的敏感生物學過程和靶基因進行了篩選,發現免疫調控和脂質代謝是PFASs的敏感靶標,DHCR24、SQLE和EBP可能是PFASs干擾脂質代謝的敏感靶基因。可進一步利用hBMSCs體外模型研究PFASs的相關毒性作用和機制,有助于建立該類化學物毒性預測和篩選的生物標志物,為其安全性評價和監管提供科學依據和新方法。

