合歡枯萎病菌的分離鑒定和培養特性
蔡 悅,王儲炎,黃明華,程俊文,錢中一,葛春梅,*
(1.合肥學院 生物與環境工程系,安徽 合肥 230601; 2.中徽生態環境有限公司,安徽 合肥 230001; 3.浙江省林業科學研究院,浙江 杭州 310023)
合歡(AlbiziajulibrissinDurazz)又名絨花樹,分類上屬于豆科含羞草亞科合歡屬。因其樹姿優美,氣味芬芳,是城市綠化和庭院點綴的觀賞佳木,在園林綠化中被廣泛應用。吳玲等[1]于1990年首次發現合歡枯萎病,其病原為尖孢鐮刀菌變異型(Fusariumf. sp),具有極強的致病性。近年來,合歡樹因感染枯萎病死亡的問題日益凸顯,在北京、天津、山東、河北、河南、江蘇和安徽等多個地區均有報道[2-4]。由于病害發生具有隱蔽性,早期不易診斷而失去防治機會[5];而且傳播速度快,病菌定殖后根除困難,植株死亡率超過30%[6],嚴重影響合歡發揮綠化觀賞價值和生態效益,造成不可挽回的經濟損失。除此之外,合歡的藥用價值高,其提取物還具有抗抑郁作用[7]。由于巨大的商業價值合歡病害在國外已受到關注。Luongo等[8]通過研究發現Phytophthoratropicalis是造成意大利合歡樹根腐病的主要病原,該菌孢子囊易脫落且生存力強,已被視為農業和自然環境中的嚴重威脅。國內已報道的合歡枯萎病病原菌有尖孢鐮刀菌[9]、尖孢鐮刀菌變型[10-11]和尖孢鐮刀菌致病型[12]等。曹杰等[13]對合歡病樣進行分離純化后將病原鑒定為尖孢鐮刀菌,并通過灌根接種試驗發現,該菌分離物可使樹苗發生枯萎病癥,且獲得的菌絲和分生孢子與接種前的菌株在形態上一致。Baayen等[14]利用測序聯合擴增片段長度多態性(AFLP)方法對引起植物萎蔫病的F.oxysporum復合種進行系譜分析,結果顯示通常認為的非致病鐮刀菌并未在分子系統樹(基因家譜)中形成單獨分支,因此F.oxysporum復合種的命名體系尚存在缺陷。總體上看,目前國內主要關注對農作物、果樹和蔬菜等枯萎病害的篩選,對林業病害特別是景觀植物的研究力度還不夠;報道的合歡枯萎病原菌種類較單一,且大部分側重病原菌生物學特性和防治效果的研究,對病菌的鑒定結果主要依據形態學特征,少量的分子鑒定也僅停留在序列比對層面,并未對病菌組成和系統發育關系進行分類學研究。
由于化學防治不僅殺傷天敵、污染環境,還會破壞生態平衡,形成愈來愈嚴重的“3R問題”,枯萎病害的防治措施已逐漸向環境友好、對人畜安全的生物防治轉變。同時,生物防治中使用的微生物具有改善環境、獲得長期效益的作用,符合現階段植物病害控制的發展方向[15]。使用F.oxysporum復合種概念不僅在分類和系統演化上造成混亂,而且對開發防治藥劑也有不利影響。為探索合歡枯萎病病菌類型,本研究利用形態學和分子生物學方法,對來自罹病合歡根、莖、枝的病菌進行分類鑒定,進而考察碳源、氮源、溫度和pH對病菌生長的影響,以期明確菌種類型及其生長條件,為實踐中合歡病害檢測、預報及防治藥劑開發提供參考。
1 材料與方法
1.1 試驗材料
合歡枯萎病樣品采集于中徽生態環境有限公司園林培育基地,位于安徽省合肥市長崗鎮。2015年4月和6月分別從發病合歡樹根、莖、枝采集20份枯萎病標本。樣品帶回實驗室后置于4 ℃冰箱保存,1周內分離。
1.2 菌株分離純化
病菌分離采用組織塊分離法[16]。無菌條件下將病原組織接種至SDAY平板,每個平板接4個組織塊,每份樣品設置3個平行,置于28 ℃恒溫培養。待菌落長出,挑取不同特征菌落邊緣菌絲至PDA平板(含0.04%青霉素和0.1%鏈霉素)劃線分離,直至獲得單一的純菌株為止。將純化獲得的菌株保存于PDA斜面,置于4 ℃冰箱備用。
1.3 形態學與分子鑒定
1.3.1 培養性狀
供試菌株在PDA平板上活化3~5 d,在菌落邊緣取直徑5 mm的菌絲塊接至新平板;對產孢量較大的菌株,先于PDA培養液中培養3 d生成菌絲團,再挑取菌絲團轉接PDA平板[17]。28 ℃恒溫培養7 d,十字交叉法測量菌落生長直徑。觀察記錄菌落形態、色澤和生長狀況等宏觀培養性狀。
1.3.2 微觀形態特征
觀察分離純化的菌株,待產孢后挑取少許培養物至載玻片,制成臨時水封片,在Motic數碼顯微鏡下觀察菌絲、產孢結構和孢子形態,并用測微尺測量孢子大小。根據菌落形態和微觀特征將病菌初步鑒定到屬。
1.3.3 病菌分子生物學鑒定
采用改良的氯化芐法提取病原菌基因組DNA[18],擴增菌株的ITS1-5.8S-ITS2 rDNA序列,上游引物ITS5(5’-GGAAGTAAAAGTCGTAACAAGG-3’),下游引物ITS4(5’-TCCTCCGCTTATTGATATGC-3’)[19]。擴增反應在BIO-RAD公司S1000TMThermal Cycler上進行。反應體系:模板DNA 1 μL、10×Buffer(含Mg2+)2.5 μL、25 mmol·L-1dNTP 0.5 μL、10 mmol·L-1引物各1 μL、5 U·μL-1Taq酶0.2 μL,ddH2O補足體系至25 μL。ITS-PCR反應條件:95 ℃預變性1 min;95 ℃變性30 s,54 ℃退火30 s,72 ℃延伸45 s,35個循環;72 ℃延伸10 min。PCR產物使用1%瓊脂糖凝膠電泳檢測,委托生工生物工程(上海)股份有限公司進行序列測定。
擴增獲得的rDNA-ITS序列在NCBI網站在線Blast比對,搜索相似性序列,確定匹配值最高的菌株。從GenBank下載相關菌株的同源ITS區序列,BioEdit軟件編輯后使用PAUP*4.0b10軟件進行系統發育分析。以最大簡約法(MP)構建系統進化樹,采用啟發式搜索和TBR分支交換算法,比對后缺失的堿基視為空格,字符狀態轉換到最佳。通過1 000次自舉值檢驗分支的支持率[20]。結合形態學和分子生物學鑒定結果將致病菌鑒定到種。
1.4 致病力測定
采用室內離體枝條接種法進行致病力測定。將菌株接至PDA平板28 ℃培養5 d,選取典型菌株1-2、2-3、3和4備用。從中徽生態環境有限公司培育基地選取長約40 cm,直徑10~20 mm健康合歡枝條,75%乙醇擦拭消毒,無菌水沖洗3次后自然晾干,枝條兩端用石蠟封口。沿菌落邊緣取直徑5 mm的菌絲塊接種于枝條上,每個枝條等間距接種3個點。枝條分無傷和刺傷2種處理,每處理5根枝條,重復3次,以接種無菌PDA培養塊為對照。接種后置于密封保濕的保鮮盒內,25 ℃恒溫培養,觀察并記錄發病情況。
1.5 病菌的培養特性
1.5.1 碳源對病菌生長的影響
以PDA為基礎培養基,其中葡萄糖分別用等量碳的蔗糖、乳糖、甘油、可溶性淀粉等替代,配制為不同的碳源培養基。從已活化菌株的菌落邊緣取直徑5 mm菌絲塊分別接種于不同培養基,每個處理3次重復。28 ℃恒溫培養,逐日觀察菌落形態,4 d后采用十字交叉法測量菌落直徑[21]。
1.5.2 氮源對病菌生長的影響
以改良的PDA培養基(馬鈴薯200 g、葡萄糖20 g、乙酸銨1.5 g、瓊脂20 g、水1 000 mL)為基礎培養基,乙酸銨分別用等量氮的草酸銨、硝酸鈉、硫酸銨、磷酸氫二銨等替代,配制為不同的氮源培養基。接種和測量方法同1.5.1節。
1.5.3 pH對病菌生長的影響
菌絲塊接種于不同pH值(pH 3.0~11.0)的PDA平板。置于28 ℃下培養,每個處理3次重復[22]。測量方法同1.5.1節。
1.5.4 溫度對病菌生長的影響
菌絲塊接種于PDA平板上,分別置于不同溫度(20~36 ℃)下培養,每個處理3次重復[22]。測量方法同1.5.1節。
2 結果與分析
2.1 病菌的分離和形態學
2.1.1 培養性狀
樣品經過常規分離得到7株鐮刀菌,各菌株的宏觀形態、色澤和生長狀況等培養性狀如下:菌株1-2,菌落呈圓形,灰白色、直徑6 cm,絨毛狀,菌絲密集,表面有水分分泌;菌株2-3,菌落灰白、圓形,直徑7.5 cm,菌絲密集,菌落表面有水分分泌;菌株3,菌落直徑7.5 cm,圓形,產生大量氣生菌絲,生長旺盛,呈淺粉色;菌株3-1,菌落近圓形,中部淺黃色,周邊呈淺橙色,直徑6.7 cm,菌絲密集;菌株3-2,菌落圓形、灰白色,直徑7 cm,絨毛狀,菌絲密集,背面中心呈淺橙色;菌株4,菌落圓形,外邊緣處有灰白色的圓環,菌絲稀疏粘滑,直徑約7 cm;菌株10,圓形,白色棉絮狀,菌絲稀疏,背面呈現淡黃色,直徑6.5 cm。
2.1.2 微觀特征
菌株1-2營養菌絲細長,小型分生孢子單生于瓶梗,在梗頂端形成淡色的孢子團;孢子橢圓形,大小(4.8~9.5)μm×(2.6~4.6)μm,長寬比1.86,大型分生孢子缺或很少(圖1)。菌株2-3孢梗束較長,多分枝,小型分生孢子在產孢細胞端部呈球狀團簇,鐮刀形或新月形,大小(4.8~8.0)μm×(1.6~3.1)μm,長寬比2.72;大型分生孢子未見(圖2)。菌株3分生孢子梗單生或形成孢子座,大型分生孢子長橢圓形或鐮刀形,無色,內有分隔,中部膨大兩端漸尖或呈鳥嘴狀,多為3~4分隔,大小(18.7~31.0)μm×(2.5~4.9)μm,長寬比5.35;孢子梗表面光滑,有分支并在頂端產孢;小型分生孢子少見(圖3)。菌株3-1營養菌絲孢子梗光滑,端部膨大形成小泡,分生孢子在孢梗束上頂生或者側生,大型分生孢子長棒狀或月牙形,大小(15.5~28.4) μm×(3.4~4.8)μm,長寬比5.35(圖4)。菌株3-2營養菌絲茂密,小型分生孢子產于有柄單生孢梗,有隔,數量較多,易形成孢子團;孢子中部膨大兩端變窄,呈長橢圓形或卵形,大小(5.7~11.1)μm×(2.7~5.5)μm,長寬比1.94;大型分生孢子數量少或缺(圖5)。菌株4孢子多產于單瓶梗頂端,瓶梗較長;小型分生孢子0~1隔,卵形或腎形,大小(4.5~10.3)μm×(1.5~3.4)μm,長寬比1.85;大型分生孢子分隔1~4個,多為3分隔;兩端較鈍,茄形、橢圓形或鐮刀形,大小(9.4~29.3)μm×(2.5~6.3)μm,長寬比4.41(圖6)。菌株10分生孢子梗較長,孢子產生于瓶梗頂端,小型分子孢子數量多,橢圓形和卵形,無隔或1隔,單生或假頭狀著生,大小(3.5~7.2)μm×(1.9~3.6)μm,長寬比1.95;大型分生孢子以3分隔居多,3分隔以上少見,兩端略彎曲較鈍,卵形或月牙形;孢子大小(8.5~36.2)μm×(2.7~6.6)μm,長寬比4.81;還存在少量厚垣孢子,多呈球形(圖7)。
2.2 病菌的分子鑒定

圖1 菌株1-2的顯微形態特征Fig.1 Microscopic characteristics of strain 1-2

圖2 菌株2-3的顯微形態特征Fig.2 Microscopic characteristics of strain 2-3

圖3 菌株3的顯微形態特征Fig.3 Microscopic characteristics of strain 3

圖4 菌株3-1的顯微形態特征Fig.4 Microscopic characteristics of strain 3-1

圖5 菌株3-2的顯微形態特征Fig.5 Microscopic characteristics of strain 3-2

圖6 菌株4的顯微形態特征Fig.6 Microscopic characteristics of strain 4
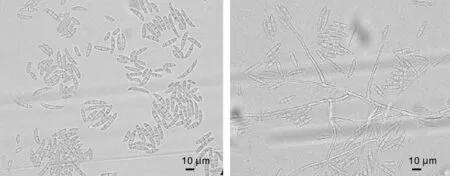
圖7 菌株10的顯微形態特征Fig.7 Microscopic characteristics of strain 10
2.2.1 序列特征
以ITS5/ITS4為引物,擴增獲得病菌rDNA-ITS區序列(圖8)。各菌株序列比對信息結果見表1。
2.2.2 系統發育樹
序列分析比對結果表明:7株致病菌均為鐮刀菌屬(Fusarium),該屬真菌在罹病合歡組織中廣泛存在,是導致合歡染病的重要因子。從Gen-Bank中下載Fusarium屬18個代表種rDNA-ITS序列,以叢赤殼屬(Nectriasp.)為外群構建系統發育樹。建樹序列總長540 bp,保守位點376個,變異位點51個,簡約信息位點113個。樹長253,一致性指數0.794 5,類似指數0.205 5,保留指數0.904 2,調整后的一致性指數為0.718 4。建樹結果表明,菌株3和3-1與F.equiseti明顯地聚為同一分支(自舉檢驗值98),2-3與F.proliferatum聚為一支,而菌株4和10與F.oxysporum聚為一類,1-2和3-2則與F.solani聚為一類。盡管菌株4的ITS序列與F.solani(KM268684)相應位點的覆蓋率和相似度分別達到100%和99%,在系統發育樹中4和10一起以99的支持率與F.oxysporum(KJ573079)聚為一支,而與F.solani(KJ573076)的距離較遠,意味著菌株4應與F.oxysporum在同一進化水平。綜上所述,將菌株3、3-1鑒定為木賊鐮刀菌(F.equiseti),2-3為層出鐮刀菌(F.proliferatum),4、10為尖孢鐮刀菌(F.oxysporum),1-2、3-2為腐皮鐮刀菌(F.solani)。
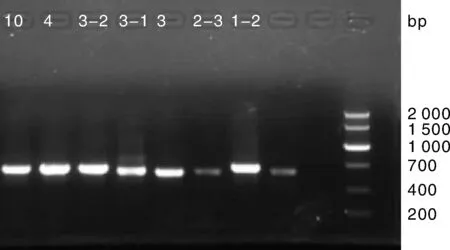
10、4、3-2、3-1、3、2-3、1-2為菌株編號。10, 4, 3-2, 3-1, 3, 2-3, 1-2 were strain No.圖8 致病菌rDNA-ITS產物電泳圖Fig.8 Electrophoresis of rDNA-ITS products of pathogens
表1菌株ITS區產物比對結果
Table1Blast description based on ITS sequences

菌株編號StrainsITS產物ITS products/bp覆蓋率Query cover/%相似度Identity/%Blast比對結果Blast descriptionGenBank登錄號GenBank accession number1-25959899F. solaniKY3077862-358510099F. proliferatumHF93059435739999F. equisetiKR3645973-157610099F. equisetiEU3262023-25849799F. solaniFJ914886459510099F. solaniKM2686849999F. oxysporumJF439472105809999F. oxysporumJF439472

Bootstrap支持率≥50%已在分支上分別顯示,GenBank登錄號在菌種名稱后注明。Nodes that received ≥50% bootstrap support values were indicated. GenBank accession number were followed the species.圖9 基于ITS序列的Fusarium屬系統進化樹Fig.9 Phylogeny of Fusarium based on ITS sequence
2.3 病菌致病力
離體枝條接種試驗表明,菌株4在刺傷處理下可使枝條發病。接種8 d,刺傷處理表面菌絲開始蔓延,部分枝條出現褐色斑點;接種15 d后刺傷處理組菌絲生長旺盛,枝條接種處出現褐色病斑并被菌絲覆蓋,部分病斑處有淡黃色液體滲出。接種20 d后刺傷處理表面被菌絲和分生孢子完全覆蓋,接種處深褐色并向四周擴展,樹枝開始干枯,皮孔開裂并溢出汁液。無傷處理表面接種的菌種生長緩慢,部分枝條接種處有顏色變深現象,但整體無明顯變化;而菌株1-2、2-3和3刺傷接種20 d,只有少數枝條出現輕微感染病狀,菌絲生長緩慢,用酒精棉擦去菌絲觀察,并未發現維管束褐變,表明這3種病菌對合歡的致病力弱。所有對照組枝條均未發病。從發病枝條上分離純化致病菌,獲得的菌株與原接種物的培養性狀和微觀特征一致,證明接種菌為合歡枯萎病原菌。
2.4 病菌的培養特性
2.4.1 碳源對病菌生長的影響
由圖11可知致病菌均可利用供試碳源。其中,菌株1-2在以蔗糖和乳糖為碳源的培養基上生長最佳,甘油和葡萄糖次之,可溶性淀粉較差;菌株2-3在以乳糖和甘油為碳源的培養基上生長最好,蔗糖次之,葡萄糖和可溶性淀粉較差;菌株3在以蔗糖為碳源的培養基上生長最佳,乳糖、甘油和可溶性淀粉次之,葡萄糖較差;菌株3-1在以蔗糖和乳糖為碳源的培養基上生長最佳,顯著優于甘油、可溶性淀粉和葡萄糖。說明F.equiseti(菌株3、3-1)對蔗糖利用最佳,而葡萄糖較差。菌株4在以蔗糖為碳源的培養基上生長最好,其次是葡萄糖、乳糖和甘油,在可溶性淀粉為碳源的培養基上生長最慢。菌株3-2和10在不同碳源培養基上的菌落直徑無顯著差異。

A,枝條刺傷處理15 d;B,枝條無傷處理15 d;C,刺傷處理枝條發病癥狀。A, wounded-inoculated branch 15 days; B, Nonwounded-inoculated branch 15 days; C, Symptoms of wounded-inoculated branch.圖10 菌株4的致病力測定Fig.10 Pathogenicity test of strain 4 on the branch
2.4.2 氮源對病菌生長的影響
致病菌均可利用所供氮源且在以硝酸銨為氮源的培養基上生長最好,因此硝酸銨為最佳氮源。除硝酸銨外,F.equiseti(3、3-1)在硫酸銨上生長較好,而草酸銨最差;F.oxysporum(4、10)在磷酸氫二銨上較好,草酸銨最差;F.solani(1-2,3-2)則偏好乙酸銨,草酸銨上同樣最差。F.proliferatum(2-3)在乙酸銨平板上生長最慢,此特性與其他病菌均不同。綜合菌株對碳(氮)源的利用情況,病菌在不同培養基上的生長速率有較大差異。以F.equiseti為例,在供試的碳氮源中,最大菌落直徑與最小菌落直徑差異分別為9.7 mm
和46.9 mm,說明氮源對F.equiseti生長的影響程度大于碳源,其他菌株的情況類似。
2.4.3 pH對病菌生長的影響
由圖13可知,所有病菌在pH為3.0時生長最慢,菌落直徑均顯著低于pH為5~11時。除2-3外,各菌株在pH為7.0時生長最快,而2-3在pH 9.0時菌落直徑最大(59.1 mm),pH 11.0時也達到52.6 mm且與pH 7時沒有顯著差異,說明F.proliferatum較其他病菌更耐受偏堿性條件。菌株3、3-1在pH為7.0時生長最快,pH 9.0次之,然后為pH 5.0和11.0;菌株4和10也表現為同樣的趨勢。總體上看,中性環境有利于致病菌生長,各菌株對不同pH的耐受力存在差異。
2.4.4 溫度對病菌生長的影響
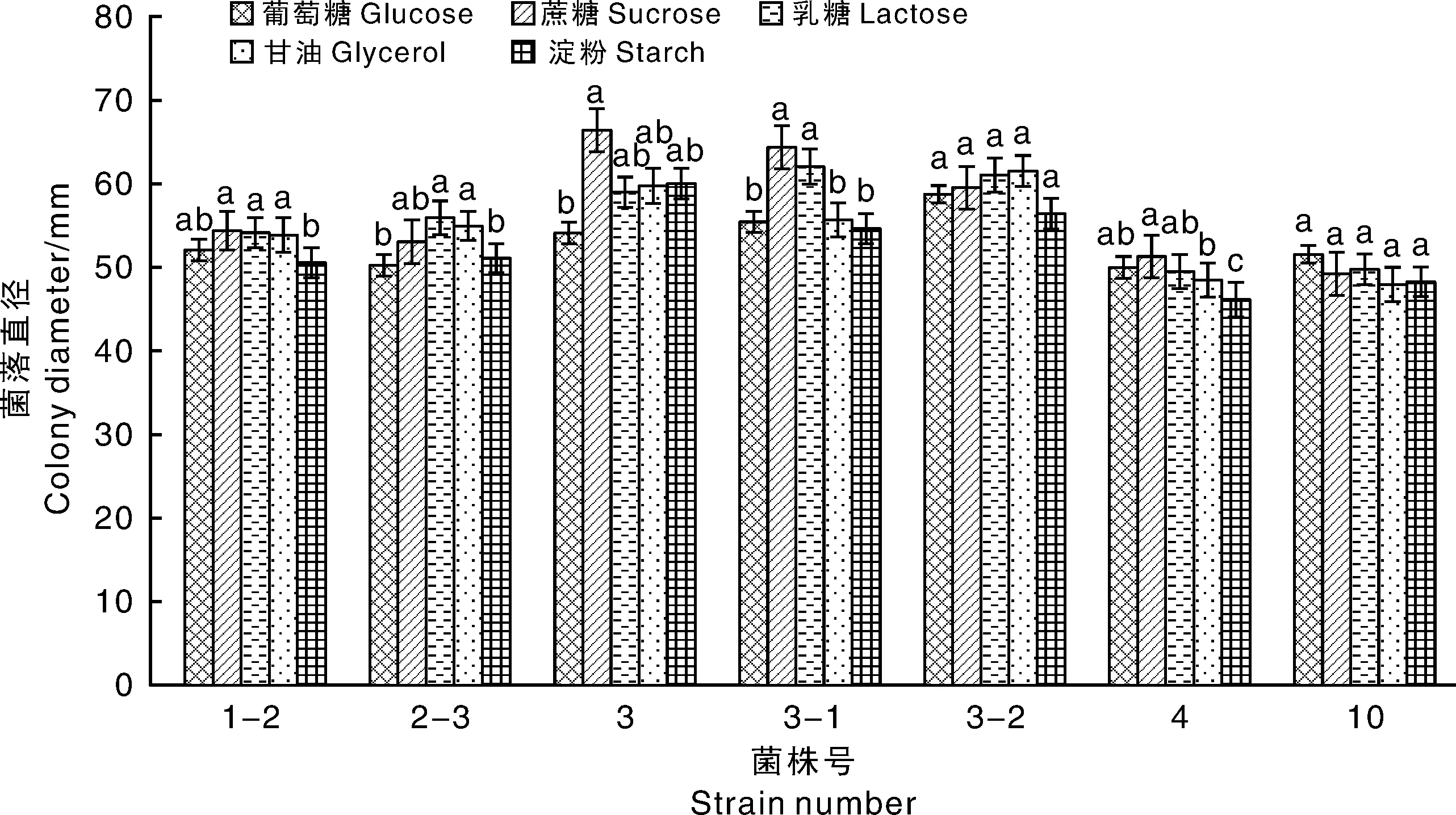
柱上無相同小寫字母表示差異顯著(P<0.05)。下同。Data on the bars marked without the same lowercase letter indicated significant differences at P<0.05. The same as below.圖11 碳源對病菌生長的影響Fig.11 Effect of carbon on mycelia growth of pathogens

圖12 氮源對病菌生長的影響Fig.12 Effect of nitrogen on mycelia growth of pathogens

圖13 pH對病菌生長的影響Fig.13 Effect of pH on mycelia growth of pathogens
由圖14可知,各菌株在20~36 ℃均能生長,20~32 ℃菌落直徑顯著大于36 ℃,且32 ℃生長最佳。在20~32 ℃,除3-1外,各菌株的菌落直徑隨著溫度降低而顯著降低。菌株3-1在28~32 ℃、20~24 ℃的生長情況均不存在顯著差異,菌株3在20 ℃時的菌落直徑顯著大于24 ℃,表明F.equiseti較其他病菌更耐受20~28 ℃的低溫環境。總體上看各致病菌生長的最適溫度為32 ℃。
3 討論
由致病性鐮刀菌(Fusarium)侵染引起的植物枯萎病是一種世界性的土傳真菌病害,可感染包括甜瓜、番茄、棉花和香蕉等在內的100余種作物[23]。在《Molecular Plant Pathology》基于科學和經濟重要性提名的十大植物病原真菌中,F.graminearum和F.oxysporum分別位列第四和第五位[24]。隨著森林生態效益優勢的逐漸顯現,開展林木病害菌的篩選和防治工作,將有力促進森林健康,更好維護環境可持續發展[25]。
了解合歡枯萎病菌的種類和生物學特性是開展有效防治的前提和基礎,本研究根據形態學和rDNA-ITS序列分析方法對采集的合歡枯萎病樣進行分離鑒定,結果表明7株致病菌均為鐮刀菌屬,分別為F.equiseti(3、3-1),F.oxysporum(4、10),F.solani(1-2、3-2)和F.proliferatum(2-3),其中,F.oxysporum對合歡有強致病力與已有報道一致,而F.solani、F.equiseti、F.proliferatum的致病力較弱。這一差異可能與樣本材料選擇、采集區位置和氣候條件、分離方法等因素有關。盡管前期很多報道將合歡枯萎病原菌描述為F.oxysporum及其變異型,但也有研究發現除尖孢鐮刀菌外[26],其他如腐皮鐮刀菌(F.solani)與潮濕鐮刀菌(F.udum)或層出鐮刀菌(F.proliferatum)也可能是枯萎病致病菌[27]。考慮到本研究在進行分離時選用SDAY平板,可能忽視生長慢、不易產孢的菌株,在今后的研究中應注意改進分離方法,以期盡可能獲得應有的病原[28]。合歡枯萎病很可能不是由單一病原菌引起,而是多種病原共同作用的結果。鐮刀菌是一個龐大而復雜的屬,還有許多致病種有待分離和描述,這些病菌通常在基因序列上的親緣關系更為密切,每種菌的致病作用都可能相當[29]。今后可利用多基因位點對F.oxysporum復合種進一步分割,并選擇更多的人工接種方法分別進行致病力測定,以模擬最佳田間發病情況。

圖14 溫度對病菌生長的影響Fig.14 Effect of temperature on mycelia growth of pathogens
在枯萎病菌的生物學特性研究中,鄭莉等[30]報道F.oxysporium生長最適pH值為6~9,菌絲致死溫度為65 ℃,可利用多種糖類碳源和硝酸鈉、尿素、硫酸銨等氮源。馮雪等[2]認為合歡枯萎病菌對環境有較強的適應力,最適pH為6,最適溫度30 ℃,對蔗糖和可溶性淀粉、硝酸鈉和硝酸鈣的利用較好。浦冠勤等[10]發現,F.oxysporun最適生長溫度為23~29 ℃,在中性偏堿的環境下生長更好,在PDA和PSA培養基上長勢一致。綜上所述,本研究中F.oxysporum生長最適溫度32 ℃與馮雪等[2]的研究接近,盡管最適溫度高于上述報道,但與枯萎病發病癥狀在5月出現,流行期為6~8月的特點較為一致[31]。病菌的最適pH為7.0且F.proliferatum(2-3)和F.oxysporum(10)對堿性條件的耐受力較酸性更強,與浦冠勤等[10]的研究結果一致。除可溶性淀粉外,病菌對供試碳源的利用率較高,與鄭莉等[30]結論相同;而最佳氮源為硝酸銨,普遍對草酸銨利用較差的結果與曹君等[21]報道一致。合歡枯萎病菌的培養特性存在若干差異,可能與發病時間、生長環境、植株種類等條件不一致有關。后續研究應圍繞菌株致病力、主要入侵途徑和綜合防治措施等方面展開。
郭甜等[32]通過調查認為,定植合歡屬植株有利于土壤有機碳固持,增強種植土壤微生物的活性,提高土壤質量。不同的合歡種類對枯萎病的抗病能力會存在差異,可根據種植的地理位置、環境溫度、土壤酸堿度等特征總結枯萎病發生的規律,為今后合歡種植中病害檢測、預防和研究提供參考[33]。在合歡枯萎病的防治中應盡可能采取生物防治為主導的綜合措施,不宜大量使用殺菌劑。同時避免采用硝酸銨類肥料,通過其他酸性肥料抑制病原菌生長。這對保持種植區土壤生態環境,提高合歡對枯萎病菌的抗性具有重要意義。

