硝酸的性質在中學化學試題中“隱”與“露”
海南 夏繼文 李 莉
硝酸作為中學化學中最常見的三大強酸之一,它具有與鹽酸和稀硫酸相似的化學性質,但又因為濃、稀硝酸具有較強的氧化性而使它顯示出很多特殊的性質。而中學化學試題中往往將這一特殊性以顯或隱的形式體現在試題中,是學生丟分的重災區。
一、“露”即直接考查硝酸的性質
硝酸作為一種常見的酸,物理性質具有揮發性,化學性質具有酸性、不穩定性和強氧化性。不穩定性體現在見光會分解,強氧化性體現在和金屬反應時不生成氫氣,也能與不活潑的金屬或非金屬單質反應,還會與一些具有還原性的物質發生氧化還原反應。
1.揮發性之“露”
【例1】將下列固體物質溶于水,再將其溶液加熱、蒸發結晶、灼燒,得到化學組成與原固體物質相同的是
( )
①膽礬 ②氯化鐵 ③硫酸鋁 ④硝酸銅
A.③ B. ①④
C. ②③④ D.全部
【解析】膽礬溶于水將其溶劑蒸干、灼燒最后得到無水硫酸銅,氯化鐵、硝酸銅溶液蒸發時會發生水解反應產生揮發性的鹽酸和硝酸,使水解反應完全進行,生成對應的氫氧化物,灼燒后生成對應的氧化物,硫酸鋁溶液水解生成的硫酸是不揮發性的酸,最后蒸干得到硫酸鋁本身,故答案 A正確。
2.不穩定性之“露”
【例2】將少量濃硝酸置于試管中,采用強光照射或者稍加熱,立即觀察到溶液上方有紅棕色氣體(NO2)產生。據此現象可推知濃硝酸具有________(填一種化學性質),寫出該化學性質的化學方程式:_______,通過上述實驗可知,實驗室應如何保存濃硝酸?_______。
【解析】這個實驗說明濃硝酸在加熱或光照時會發生分解,即硝酸具有不穩定性,分解產生的NO2氣體又溶解在濃硝酸中,因此長期放置的濃硝酸顯黃色,所以實驗室在保存濃硝酸時必須將濃硝酸放置于避光的陰涼處,同時又因為其有較強的氧化性,所以盛硝酸溶液的試劑瓶必須是玻璃塞。
3.氧化性之“露”
【例3】下列離子方程式正確的是
( )




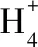
【例4】(2015·海南卷·7)下列敘述正確的是
( )
A.稀鹽酸可除去燒瓶內殘留的MnO2
B.可用磨口玻璃瓶保存NaOH溶液
C.稀硝酸可除去試管內壁的銀鏡
D.煮沸自來水可除去其中的Ca(HCO3)2
【解析】除去試管內壁的MnO2只能用熱的濃鹽酸,故A錯;磨口玻璃瓶會與NaOH溶液反應生成Na2SiO3,使瓶口與瓶塞粘在一起,故B錯;銀與稀硝酸反應生成硝酸銀,故C正確;Ca(HCO3)2加熱會分解成碳酸鈣而沉淀,故D正確。故答案選CD。
二、“隱”即題干中沒有出現硝酸這種物質
1.硝酸可以與不活潑金屬反應,與活潑金屬反應時也不產生氫氣之“隱”
【例5】稀硫酸中插一塊銅片,銅片沒有被腐蝕,再加入下列哪一種物質可使銅片迅速被腐蝕
( )
A.稀鹽酸
B.KNO3晶體
C.KCl晶體
D.Na2SO4晶體
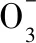
【例6】100 mL 6 mol/L的硫酸與足量鋅粉反應,一定溫度下,為了減慢這個反應的速率又不影響產生氫氣的總量,可向反應物中加入適量
( )
A.碳酸鈉溶液
B.水
C.硫酸鉀溶液
D.硝酸鈉溶液
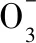
2.濃硝酸與金屬鐵、鋁在常溫時發生鈍化反應之“隱”
【例7】原電池的電極名稱不僅與電極材料的性質有關,也與電解質溶液有關。下列說法中正確的是
( )

A.①②中Mg作負極,③④中Fe作負極





【例8】在酸性溶液中能大量共存的離子組是
( )

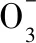
C.K+、Na+、I-、Fe3+
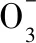


( )
A.向硝酸亞鐵溶液中滴入適量鹽酸,溶液綠色加深
B.蒸干硝酸亞鐵溶液并灼燒,可以得到FeO
C.保存硝酸亞鐵溶液時應加入少量鐵粉
D.配制Fe(NO3)2溶液時,為防止其水解,應加入少量稀硝酸
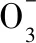
另外,硝酸作為含氧酸,它還易與有機物中的醇類反應生成對應酯,常見的有乙醇硝酸酯和甘油硝酸酯等。


