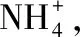雜化軌道和大π鍵在高中化學教學和考試中的應用初探
重慶 王 明 胡家強
普通高中化學教科書選修3和選修5中都有關于有機物結構和性質的內容,在選修3中以甲烷、乙烯、乙炔為例分析σ鍵和π鍵,并以甲烷為例引入雜化軌道理論。在選修5中以科學視野的方式呈現雜化軌道理論分析理解甲烷、乙烯、乙炔分子的空間結構,并通過分析苯的空間結構引入了大π鍵。從高考命題方向的發展和演變來看,高中化學教學應重視學科內部融合,因此物質結構的相關理論與元素及化合物、有機物的結構及性質的融合考查是高考命題的重要方向之一,近年高考已初見端倪。筆者從高考試題中涉及較多的雜化軌道和大π鍵入手,初步闡述雜化軌道和大π鍵的知識建構及其在解題中的應用,為深入探討開一扇窗,以期拋磚引玉。
一、基本知識構建
1.雜化軌道基本理論
價層電子對數=σ鍵電子對數+中心原子的孤電子對數。
σ鍵電子對數=與中心原子連接的原子數目。

通式:AYZ,A為中心原子,Z表示價層電子對數。
(1)凡符合VSEPR模型的AY4的分子或離子的中心原子A都采用sp3雜化。
凡符合VSEPR模型的AY3的分子或離子的中心原子A都采用sp2雜化。
凡符合VSEPR模型的AY2的分子或離子的中心原子A都采用sp雜化。
(2)VSEPR模型與中心原子的雜化軌道類型關系如表1所示:

表1
(3)C、N原子雜化類型的判斷技巧
C或N雜化軌道類型的判斷是高考的常見考點,在此類化合物中中心原子不止一個,按正常的價層電子對互斥理論(VSEPR理論)計算中心原子的價層電子對數比較繁瑣,此時靈活運用必修2中的結構式相關知識能起到奇效。C、N的成鍵特點相似,可以把N上的一對孤電子對看成一對共用電子對。現簡單歸納如表2所示(鏈狀結構):

表2
另外,C族、N族、O族、鹵素原子與其他原子全部成單鍵時,中心原子均為sp3雜化。
2.大π鍵理論
分子中數個相鄰原子上都有平行的p軌道(每個p軌道可以容納2個電子、1個電子或為無電子的空軌道),這時即會產生多軌道多電子的大π鍵。高中常見物質中有如下幾類可考慮大π鍵對性質的影響。

(2)雙鍵或苯環直接與O、N、X(鹵素)等有孤對電子的原子連接。
(3)多個雙鍵處于共軛體系(雙鍵中間隔一個單鍵的體系)。
二、高中教學中的應用
在高中化學教學中,適時利用教材相關物質為載體,使雜化軌道和大π鍵理論不斷得以應用、鞏固和強化,有利于學生理解某些物質的特殊結構和性質。
3.石墨:層狀結構的每一層內部,每個C以sp2雜化軌道形成σ鍵骨架結構,每個C原子均余下一個未參與雜化的p軌道,所有的p軌道相互重疊,形成范圍很廣的大π鍵。
4.C60:每個C原子以sp2雜化軌道形成籠狀足球形的結構,每個C原子均剩下一個未參與雜化的p軌道,肩并肩重疊在一起形成球狀的大π鍵。


圖1
三、經典試題研究
[例1]有如下幾種化合物分子:CH3OH、N2H4、HCOOH、COCl2、N2F2。試回答下列問題。
(1)以上分子中C原子和N原子為sp3雜化的有,C和N原子為sp2雜化的有。
(2)寫出N2F2的電子式,并結合烯烴的順反異構寫出N2F2的所有可能結構式。
[解析](1)根據前面分析C、N全成單鍵連接即為sp3雜化,成一個雙鍵為sp2雜化。故CH3OH、N2H4中的C、N為sp3雜化;HCOOH、COCl2和N2F2(F—N=N—F)中為sp2雜化。


(2)[2016·全國卷Ⅲ·37節選]AsCl3分子的立體構型為,其中As的雜化軌道類型為。
(3)[2017·全國卷Ⅲ·35節選]硝酸錳是制備上述反應催化劑的原料,Mn(NO3)2中的化學鍵除了σ鍵外,還存在。

(2)As為氮族元素,全部成單鍵故為sp3雜化;分子中有一對孤電子對,故真實構型為三角錐形。



[例4](1)[2017·全國卷Ⅱ·35節選]經X射線衍射測得化合物R的晶體結構,其局部結構如圖2所示:
①下列選項中從結構角度分析,R中兩種陽離子的相同之處為,不同之處為。

圖2
A.中心原子的雜化軌道類型
B.中心原子的價層電子對數
C.立體結構
D.共價鍵類型
(2)[2018·全國卷Ⅱ·35節選]氣態三氧化硫以單分子形式存在,其分子的立體構型為形,其中共價鍵的類型有種;固體三氧化硫中存在如圖3所示的三聚分子,該分子中S原子的雜化軌道類型為________。

圖3