價——態推測模型
廣東 陳彬城
氧化還原反應方程式的書寫是近幾年高考的熱點和難點。最常見的考查模式是根據題目給定的情景(如某些反應物、生成物、反應的酸堿性或圖表等信息)書寫陌生氧化還原反應方程式。廣義的氧化還原反應方程式還包括電化學的電極反應(原電池和電解池的電極反應)。這類題目要求考生能夠運用元素化合物的知識、氧化還原反應原理以及其他的基本反應原理(如強酸制弱酸、水解、產物共存等原理)對題目進行綜合分析,推測生成物,然后配平、補充物質,按步驟完成化學方程式。
推測生成物是完成題目的關鍵,也是很多考生最感到頭疼的步驟,以下介紹一種以元素化合價存在形態二維圖(以下簡稱“價——態二維圖”)為核心,用于氧化還原反應產物(包括電化學反應產物)推測的模型即價——態推測模型。
一、價——態推測模型
1.價——態推測模型簡介
價——態推測模型是指根據元素不同化合價在各種條件下(如酸性、堿性、中性等)的存在形態,結合題目信息及必要反應原理(如水解、產物共存等原理),推測產物的思維模型。其主要流程如下:


從④到⑤是方程式的最后環節,主要比較④的方程式左右兩端H、O的數目,結合反應條件補充H+、OH-或H2O。
2.價——態二維圖
價——態二維圖是以外界條件(無水、酸性、中性、堿性等)為橫坐標,以元素的化合價為縱坐標,在二維平面內繪制元素的各種化合價在不同條件下存在形態的圖象。可用于推測化學方程式的反應物、生成物或判斷方程式的正誤。以下是H、C、O、S、Fe等元素的價——態二維圖:

圖1 氫元素的價——態二維圖

圖2 氯元素的價——態二維圖
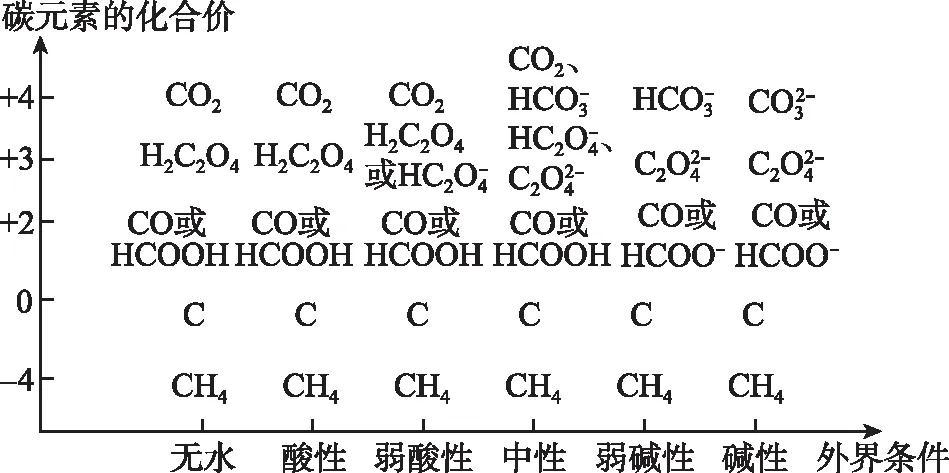
圖3 碳元素的價——態二維圖

圖4 硫元素的價——態二維圖

圖5 錳元素的價——態二維圖

3.氧化還原反應的配平
這里主要配平氧化劑、還原劑、氧化產物、還原產物,要求熟悉電子守恒法配平。
4.物質的補充
這一塊的重要原則是“先配平后補充”,因為只有配平氧化劑、還原劑、氧化產物、還原產物后,才能知道需要補充哪些反應物和生成物。常見的補充原則如下:
(1)若左邊缺少氫原子,酸性條件下,直接補充H+再配平即可;堿性或中性條件下,應補充H2O生成OH-(每一個H2O失去一個H+生成一個OH-),再配平即可。
(2)若左邊缺少氧原子,酸性或中性條件下,直接補充H2O生成H+再配平即可;堿性條件下,應補充OH-生成H2O(每兩個OH-失去一個O生成一個H2O),再配平即可。
(3)若左邊多氫原子,酸性或中性條件下,生成H+;堿性條件下,應補充OH-生成H2O。
(4)若左邊多氧原子,酸性條件下,補充H+生成H2O;堿性或中性條件下,應補充H2O生成OH-。
5.產物共存原理
產物共存原理指的是同一體系的產物之間不再發生反應,能共存。若產物之間會繼續反應,則要寫出繼續反應后的產物,直至產物之間不再發生反應。
如堿性條件下:



二、典例分析
例1.SO2通入酸性高錳酸鉀溶液的離子方程式



觀察以上式子,可發現左邊缺少2O,在酸性溶液中,只能從水補充,應加上2H2O,而水失去氧后+1價的H以H+形式存在,右邊補充4H+。

例2.草酸(H2C2O4)使酸性高錳酸鉀褪色

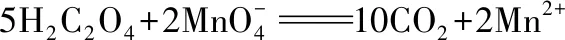
觀察以上式子,可發現左邊多8O和10H,應結合為5H2O剩下3個-2價的O,根據圖2 氧元素的價——態二維圖,可知在酸性溶液中,-2價的O以H2O形態存在,故應補充6H+,再生成3H2O,總數為8H2O。

例3.書寫甲烷燃料電池的電極反應式(①電解質溶液為氫氧化鉀②電解質溶液為稀硫酸)








例4.書寫電解堿性食鹽水的電極反應式


三、真題分析
例5.(2018·全國卷Ⅰ·27節選)Na2S2O5可用作食品的抗氧化劑。在測定某葡萄酒中Na2S2O5殘留量時,取50.00 mL葡萄酒樣品,用0.010 00 mol·L-1的碘標準液滴定至終點,消耗10.00 mL。滴定反應的離子方程式為。




