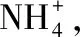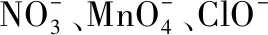高考離子反應試題中陷阱的布設和預警
甘肅 車 琳
新一輪課改化學學科提出五大核心素養,究其核心,關鍵還是思維能力培養。根據高考題型及化學學科的特點,對學生的訓練,我們的策略是“先死后活,活中有死”,即知識儲備要豐富;只有在豐富的知識儲備基礎上,才能擁有活躍的思維。而高考試題也正是基于上述兩點要求,特別在思維的難度、跨度、靈敏度要求上較高,其題型特點往往會布設許多陷阱,或是提供多重信息,設置許多干擾因素,增加試題的難度;總結這些試題的規律特點,有助于提高學生的思維能力。事先明確其可能的陷阱,以防止學生掉入陷阱;才能提高做題的正確率和臨場考試的應變能力。


氣體,則溶液的顏色變化為
( )
A.綠色變深 B.淺綠色變得更淺
C.變黃 D.無明顯變化
【解析】本題考查學生接受、吸收、整合化學信息的能力,試題中隱藏硝酸根離子在酸性環境中具有強氧化性的特性,學生易忽略硝酸亞鐵這個信息;思維集中到水解平衡移動上,導致錯誤。同時這個試題要求學生對離子在溶液中的顏色也要熟悉,才能做出正確的判斷。如果把硝酸亞鐵變換為硫酸亞鐵,那結果截然不同。
【答案】C
二、通過多信息干擾,增加試題難度,因此要深刻挖掘

( )
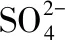
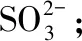
【答案】BC
三、看似單一信息,埋伏兩面性
例3(2015·江蘇·6)常溫下,下列各組離子一定能在指定溶液中大量共存的是
( )
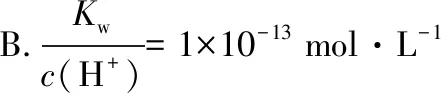
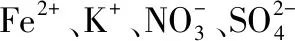
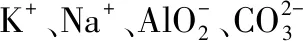
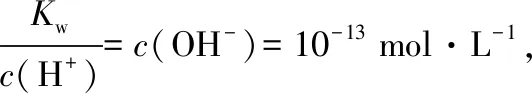
【答案】B
四、多重矛盾的干擾,造成不確定性,因此要注意多方情況
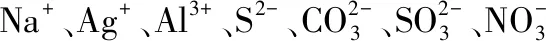
( )
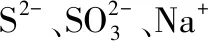
C.一定沒有Ag+、Al3+

【答案】C
五、肯定中的否定,要注意思維的聯想性
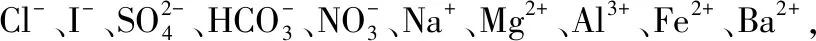
①加幾滴甲基橙試液,溶液變紅色;
②濃縮,加銅片和濃H2SO4,加熱,有無色氣體產生,后在空氣中又變成紅棕色;
③加BaCl2溶液,立即生成白色沉淀,取上層清液,加AgNO3溶液,出現白色沉淀,且不溶于HNO3;
④加NaOH溶液,有白色沉淀生成,當NaOH過量時沉淀部分溶解。
(1)溶液中肯定存在的離子是。
(2)溶液中肯定不存在的離子是。
(3)為進一步確定其他離子,應該補充的實驗是。
(4)寫出實驗④中所有反應的離子方程式:。
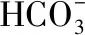
(3)不能確定的是Na+、Cl-,需要進一步檢驗Na+、Cl-。鈉離子采用焰色反應檢驗,若火焰呈現黃色,則說明原溶液中含有Na+;氯離子檢驗方法:取少量原溶液,加入Ba(NO3)2溶液后,取上層清液加入AgNO3溶液和稀HNO3,若有沉淀生成,證明存在Cl-,否則不存在。
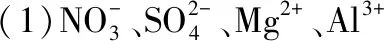
(3)首先取少量原溶液進行焰色反應,其次取少量原溶液,加入Ba(NO3)2溶液后,靜置,取上層清液加入AgNO3溶液和稀HNO3



六、信息雜亂,利用思維導圖,化繁為簡
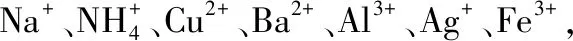
①五種鹽均溶于水,水溶液均為無色。
②D的焰色反應呈黃色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈堿性。
④若在這五種鹽的溶液中分別加入Ba(NO3)2溶液,只有A、C的溶液不產生沉淀。
⑤若在這五種鹽的溶液中,分別加入氨水,E和C的溶液中生成沉淀,繼續加氨水,C中沉淀消失。
⑥把A的溶液分別加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
請回答下列問題:
(1)五種鹽中,一定沒有的陽離子是;所含陰離子相同的兩種鹽的化學式是。
(2)D的化學式為,D溶液顯堿性的原因是(用離子方程式表示)。
(3)A和C的溶液反應的離子方程式是;E和氨水反應的離子方程式是。
(4)若要檢驗B中所含的陽離子,正確的實驗方法是
。
【解析】根據①~⑥的實驗現象,因信息量大,防止造成混亂,可用下面的思維圖式,因水溶液均為無色,可排除有色離子Cu2+、Fe3+,可直接從以下離子入手,根據共存情況和可能的組合,畫出思維導圖,化繁為簡,從紛亂中理出頭緒:
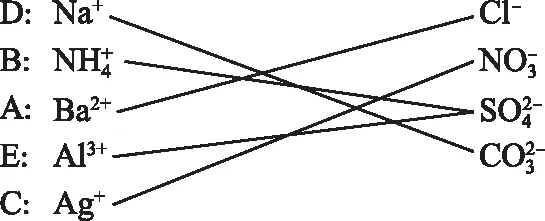
可判斷出A為BaCl2,B為(NH4)2SO4,C為AgNO3,D為Na2CO3,E為Al2(SO4)3,據此解答,思路清晰,防止造成混亂。
【答案】(1)Cu2+、Fe3+(NH4)2SO4、Al2(SO4)3