肺部磨玻璃結節的低劑量HRCT篩查與診斷
向守洪 戚躍勇 秦 芬 王 兵 曾 燕 陸 明 汪天虎 嚴 敏
隨著低劑量高分辨力CT(high resolution CT, HRCT)作為體檢的普及和解剖性肺段切除術的廣泛開展,越來越多的肺部磨玻璃結節(ground-glass nodule, GGN)病變被發現,國內外多年及多項研究表明,肺GGN與早期肺癌具有明顯相關性[1]。早期肺癌可以達到臨床治愈,晚期肺癌患者5年生存率不足5%。因此,如何精準識別GGN的良、惡性成為影像科與相關臨床專科(呼吸科、胸外科、腫瘤科等)研究的重點、熱點及難點[2]。美國全國肺癌篩查試驗證明,LDCT篩查可降低20%的肺癌死亡率,是目前最有效的肺癌篩查工具[3]。美國專業詞匯命名委員會于1996年將磨玻璃結節密度定義為:HRCT上呈模糊樣密度增高影,其內能見到肺血管或支氣管結構,縱隔窗上病灶往往不能顯示或僅能顯示磨玻璃結節病灶中實性成分[4]。GGN在肺癌的早期和治療上具有重要的作用,本文分析38例GGN病例的低劑量HRCT表現,報道如下。
材料與方法
一、一般資料
選擇2018年1月至2018年12月就診于我院的38例GGN病變患者,其中男性28例,女性10例,年齡33~71歲(中位年齡為53.1歲)。28例男性均有吸煙史。納入標準:既往無惡性腫瘤病史及其他臨床癥狀者;行體檢低劑量HRCT檢查者;HRCT發現肺內直徑≤3.0 cm的GGN病灶者。排除標準:GGN病灶未行手術和病理學確診者;影像資料不能行回顧性高分辨薄層三維后處理者。
同期行低劑量胸部HRCT體檢時發現了一組肺內淋巴結(intrapulmonary lymph nodes, IPLNs)病例,IPLNs是指支氣管第四級分支以下的肺實質內的淋巴結,為增生的淋巴小結,常常沒有特征性的臨床癥狀[5]。為了與GGN進行HRCT鑒別,本研究收集了同期體檢發現并經手術病理學確診的26例IPLNs進行對照。
二、設備與方法
1. 設備儀器: 采用GE Optima 64排CT,GE Revolution 256排CT,西門子雙源炫速CT(SOMATOM definition flash),東芝Toshiba Aquilion ONE 320排動態容積CT機。掃描前訓練患者憋氣,要求患者呼吸均勻,每次均在吸氣末訓練憋氣,憋氣持續時間35 s左右。患者吸氣末一次屏氣完成全肺掃描,開啟自動管電流調制技術,100 kV,50 mA~100 mA,0.5 s/圈,5 mm層厚,0.625 mm重建間隔,螺距0.938:1,掃描視野完全包含患者胸部,非檢查部位鉛衣保護。
2. 處理方法: 掃描結束后數據傳至后處理工作站,采用多平面重建技術(multiplane reconstruction, MPR),調節肺窗的窗寬與窗位以最佳地顯示病灶的特點,通過支氣管的MPR重建確定GGN所在的準確解剖學分段。通過最大密度投影法(Maximum intensity projection, MIP)調節重建層厚以顯示GGN與周圍血管的關系。通過容積成像(volume rendering, VR)分別顯示GGN所在肺段的肺動脈、肺靜脈、支氣管和GGN病灶,賦予它們不同顏色,然后融合在一起,圍繞GGN所在肺段的肺門處肺動脈、肺靜脈和支氣管進行三維旋轉,然后保存將行解剖性肺段切除術時電視胸腔鏡下的肺門處手術視野的立體解剖結構。
將手術切除病變所在的完整肺葉或肺段即刻送至CT室進行標本充氣后CT病灶定位。將留置針刺入肺葉或肺段標本最近端支氣管內并縫合固定。經留置針用50 ml注射器向標本手動反復充氣,對漏氣的地方進行縫合,肺充氣完全后關閉留置針。在肺葉或肺段標本上放置CT引導穿刺定位器并固定,將標本放置在自制的泡沫固定支具上。當切除肺標本膨脹較為完全時,改為高壓注射器以維持一定壓力充氣,并即刻進行CT定位掃描。掃描結果顯示局部肺組織充氣不佳者需繼續充氣后掃描,直至靶病灶清晰顯示。選擇靶病灶顯示層面,記錄該層面進床位置,設定穿刺進針角度和深度。打開CT定位光標,移床到靶病灶顯示層面,同CT引導穿刺定位器一起確定進針點。去除CT引導穿刺定位器,用留置針的金屬針芯經進針點按擬定的穿刺角度和深度進行穿刺。經CT重復掃描顯示針芯的針尖是否在靶病灶內或緊靠靶病灶,否則需調整留置針的穿刺角度和深度。保留并固定針芯在標本上,將其送到病理科,向病理科技師交代并記錄針芯針尖與靶病灶的位置關系。說明需要同CT征象進行對照的層面和方向,讓病理切片方向與盡量之一致。
三、統計學方法
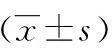
結 果
一、患者良惡性GGN病灶的HRCT結果
38例GGN病例中,HRCT表現為單純磨玻璃密度結節(pure ground-glass nodule, pGGN)16例,伴有實性成分的混合磨玻璃結節(mixed ground-glass nodule, mGGN)22例。16例pGGN患者中,惡性3例;22例mGGN患者中,惡性14例,差異具有統計學意義(P<0.05)。良惡性GGN病灶在空泡征和支氣管充氣征的HRCT表現方面無統計學差異(P>0.05),但在GGN病灶的大小、分葉征、毛刺征、胸膜凹陷征、血管集束征的HRCT表現方面有統計學差異(P<0.05)。良惡性GGN病灶的HRCT的比較,見表1。
二、兩組患者病灶的HRCT結果比較
38例GGN患者與26例IPLNs病灶患者的HRCT比較,見表2。GGN病灶的HRCT表現在大小、分布、病灶邊緣是否光滑、病灶周圍有無線樣密度影等方面與IPLNs具有統計學差異(P<0.05)。

表1 良惡性GGN病灶的HRCT結果比較
注:與惡性GGN組比較,aP<0.05,bP<0.01

表2 GGN與IPLNs病灶的HRCT結果比較
注:與IPLNs組比較,aP<0.05,bP<0.01
討 論
2011年IASLC/ATS/ERS多學科肺腺癌的分類為浸潤前病變和浸潤腺癌兩大類,其中浸潤前病變包括不典型腺瘤樣增生(atypical adenomatous hyperplasia, AAH)、原位腺癌(adenocarcinoma in situ, AIS),AIS是指病灶直徑≤3 cm且無間質浸潤、胸膜侵犯及脈管瘤栓的支氣管肺泡癌。浸潤腺癌包括微浸潤性腺癌和浸潤性腺癌[6]。GGN在病理學上可為良性GGN和惡性GGN。良性GGN包括局限性炎癥、局限性肺纖維化、局限性肺出血和肺癌浸潤前病變等,惡性GGN主要是浸潤腺癌[7]。GGN在HRCT上分為pGGN和mGGN,pGGN又稱肺部磨玻璃影(ground-glass opacity, GGO),最早將GGO的CT表現描述為“朦朧增高的密度”或“細顆粒樣外觀”[8]。2013年Fleischner 學會在其指南[8]中表明:對于孤立的直徑≤5 mm的pGGN,不需CT隨訪觀察;對于孤立的直徑>5 mm的pGGN,需3個月后行CT復查以觀察病灶變化,如果病灶仍存在且無變化,則每年CT隨訪復查,持續至少3年,期間不推薦使用PET/CT。相反,對于mGGN,尤其是實性成分>5 mm的病變,3個月后復查發現病灶生長者應考慮其惡性可能,需積極手術處理。
本組病例采用解剖性肺段切除術,它相對于楔形肺切除術更容易獲得合適的切緣,可更徹底地切除肺段及段間引流的淋巴管,從而降低腫瘤的復發。行解剖性肺段切除時需先檢查肺裂發育情況,如葉間裂發育良好則從葉間裂入路打開肺動脈鞘膜,然后根據不同的肺段依次處理肺段的動脈、支氣管、靜脈,而術中準確判定靶段血管、支氣管和肺段界限是手術的難點和關鍵[9]。本組患者通過術前CT三維成像有助于明確肺裂發育情況,有助于術中顯示和分離肺門處靶段肺動脈、支氣管和肺靜脈。為了顯示擬切除肺段的界限,本組患者采用切斷靶段支氣管之前后充氣法,即先給整個肺充氣,再阻斷靶支氣管和肺血管,擬保留的肺組織因具備氣體交換功能而塌陷,從而便于使用切割縫合器清晰地顯示并切除充氣狀態肺段組織。該方法可最大限度地切除沒有氣體交換功能的充氣狀態的靶肺段組織,而切除的靶肺段組織因其處于充氣狀態更有利于術后行標本的CT病灶定位。
GGN的CT病理學基礎是各種原因導致的局限性肺泡部分萎陷、肺泡腔的不完全填充或毛細血管的血容量增加,主要的原因有:①腫瘤或腫瘤樣細胞沿肺泡壁匍匐生長,如AAH為肺Clara細胞襯覆在肺泡壁,表現為界限清楚的立方形柱狀或釘樣細胞;②局限性的肺間質和肺泡壁因炎癥、纖維組織增生等原因而增厚;③局限性的肺泡氣腔內有液體部分充盈,如水腫或出血。有時GGN的細胞學診斷也需結合其HRCT表現進行綜合判斷[10]。良性GGN多為pGGN,如AAH的HRCT特征表現為類圓形的邊界清晰的低至中等密度均勻的磨玻璃樣陰影,邊緣部分有分葉,但無毛刺及胸膜凹陷征的改變,部分病灶內可見含氣支氣管征或空泡征,含氣支氣管的形態多規則,可稍擴張,管壁增厚不明顯。肺部感染或肺出血等GGN在短期隨訪中,如果合理治療會明顯縮小,如病情進展則會迅速增大。局灶性肺間質纖維化導致的GGN其HRCT特征表現為凹凸不平的多角形或不規則形,是因為肺間質纖維化對周圍肺組織有牽拉作用。而惡性GGN多為mGGN,實性成分比例越高,其惡性概率就越大。惡性GGN的HRCT特征表現為:病灶的形態為圓形或類圓形,邊緣可見分葉征和毛刺征,病灶密度不均勻,周圍可見血管集束征及胸膜凹陷征。在GGN的HRCT鑒別診斷方面,本組患者通過與同期手術切除的IPLNs病灶進行HRCT對照,總結IPLNs的HRCT表現特點如下:病灶主要分布在氣管分叉平面以下肺實質,多位于胸膜下15 mm以內,呈單發的圓形或橢圓形密度均勻的小結節。如果結節周圍的肺實質可見小葉間隔增厚或線樣密度影,為淋巴引流所致,可高度提示IPLNs的診斷[11]。總之,低劑量HRCT檢查能較好的篩查和診斷肺部磨玻璃結節,有利于減少肺癌的CT誤診。

