外電場下c-C4F8和C3F7CN分子福井函數與電負性研究
李亞莎, 周 筱, 謝云龍, 劉國成
(三峽大學 電氣與新能源學院,宜昌 443002)
1 引 言
六氟化硫(SF6)因其優良的絕緣性能和滅弧性能被大量運用于電力行業,研究表明,SF6氣體具有較強的溫室效應[1];所以,電力行業正大量減少甚至完全替換SF6的使用[2]. 目前,新絕緣氣體有三氟碘甲烷(CF3I)、全氟丙烷(C3F8)、六氟乙烷(C2F6)、八氟環丁烷(c-C4F8)、氟氯代烷、C3F7CN氣體等等,多數是通過實驗進行擊穿特性、分解產物、混合氣體等研究,但往往實驗得到的現象和結果缺乏合理的理論解釋.在高壓絕緣技術領域可利用分子模擬技術從微觀機制角度研究絕緣材料的性能,為實驗手段提供有力的理論支撐與參考. 廖瑞金等[3]采用密度泛函理論[4-6]對絕緣紙抗熱老化性能進行了量子化學研究.李亞莎[7]等采用密度泛函理論研究了電場下鹽交聯聚乙烯分子結構和能量變化,分析前線軌道在外場下的成分和紅光光譜的變化.吳學科[8]等基于密度泛函理論研究了SF6在外電場作用下的分子結構和紅外光譜.段逸群[9]等基于密度泛函研究了CF3I分子在外電場中的物理和光譜性質.張曉星[10]等采用反應分子動力學和量子化學相結合的方法,探究了 C3F7CN/CO2混合氣體的分解路徑及產物分布等特性.
絕緣氣體需要承受電氣設備運行環境的考驗,如溫度、濕度、電場、雜質等等,那么氣體分子本身的化學穩定性十分關鍵,多種指標可以反應分子的化學活性,主要分為局部活性參數和全局活性參數,大多數化學反應主要與原子、原子團或分子中的特定位點有關,系統的化學反應活性由電子密度對擾動的敏感性決定,福井函數(Fukui function, FF)是較常用的局部反應參數之一,將福井函數收縮到每一個原子上則得到簡縮福井函數(Condensed Fukui function, CFF).而全局反應參數有助于分析理解所研究系統的行為,并通過量化數據提供原理性的支撐,電負性(Electronegativity)就是一種全局反應參數,更重要的是絕緣氣體為滅弧阻斷放電需要具備高電負性,電負性是耐電強度、滅弧阻斷放電能力的有效體現,也是替代型絕緣氣體必須考察的絕緣性能之一,有研究表明分子結構中存在鹵族元素、環狀、雙鍵或者三鍵都能夠提升氣體電氣性能[11].目前,對絕緣氣體反應位點以及電負性的量化研究鮮少.
本文采用密度泛函理論計算了c-C4F8和C3F7CN分子的電子密度和能量,進而計算出外電場作用下的福井函數、簡縮福井函數和電負性,并分析了外電場對三者的影響,即量化了c-C4F8和C3F7CN在外電場作用下的化學穩定性與滅弧性能,為它們的工程應用提供了一定的數據、理論支撐,也為今后絕緣氣體的相關研究提供了參考.
2 理論方法和模擬方法
2.1 理論方法
概念密度泛函理論(Conceptual density functional theory)[12]又稱為密度泛函反應理論,是密度泛函的新化學活性理論,化學反應理論研究的是分子在不同類型試劑攻擊下的變化趨勢.
預測反應位點的理論方法有多種,第一類方法從頭算動力學模擬對反應過程考慮全面,但計算成本太高;第二類方法過渡態理論計算反應勢壘過程較為繁瑣.所以采用基于反應物自身性質,僅考慮反應物自身電子結構特征來預測反應位點的方法尤為方便有效.在概念密度泛函中,福井函數主要與系統密度函數在恒定外勢約束下對電子數變化的響應有關,它能夠有效反應分子中不同局部的反應活性.福井函數早在1984年由Parr和Yang等人[13]提出,它比前線軌道理論(Frontier molecular orbital theory,FMO)表現出更良好的準確性,是由電子總數N的變化引起的電子密度的微分變化,也等效于系統的化學勢μ對外部勢能的響應,定義為
(1)
式中,N為當前體系的電子數,ρ(r)為該位點的電子密度,ν原子核對電子產生的吸引勢.由于電子密度相對于電子數的不連續性,根據有限差分近似計算式(1)的左導數和右導數以及兩者的平均值,即
f+(r)=ρN+1(r)-ρN(r)≈ρLUMO(r)
(2)
f-(r)=ρN(r)-ρN-1(r)≈ρHOMO(r)
(3)
(4)
ρN、ρN-1和ρN+1分別表示分子在中性狀態、陽離子狀態和陰離子狀態的電子密度.f+(r)表征親核反應,通過加入電子后電子密度變化的響應來測量,在(r)位點的f+(r)值越大,則在電子增益的親核攻擊中它可以接受的電子越多,因此分子在f+(r)較大的位點易受親核攻擊;同理,f-(r)表征親電反應,通過失去電子后電子密度的變化來測量,f-(r)越大的位點易受親電攻擊;f0(r)表征自由基反應.福井函數值越大,相應位點的反應活性越大.
為了進一步定量比較原子層面的反應活性,計算出每個原子上的福井函數值,稱之為簡縮福井函數[14]. 分子中某原子a的簡縮福井函數表示如公式(5)和(6),
(5)
(6)

電負性在1932年由Pauling[16]首次提出,它量化了原子或官能團吸引電子朝向自身的內在能力,電負性計算依賴于原子或分子的其他性質.Parr 等人在1978年建立了密度泛函化學勢和電負性之間的關系[17],即
(7)
χ為電負性,μ為化學勢,E為能量,N為電子數,ν是所研究分子系統的外部電勢,遵從電負性均衡原理,在定量DFT計算中存在計算化學勢和電負性的實用方法,根據 Mulliken 方法[18],
(8)
這一標度簡明直觀,式中IE為分子的第一電離能(單位為eV, l a.u.=27.21138 eV),第一電離能是基態的氣態原子失去最外層的一個電子所需能量,數值越小越容易失去電子;EA為電子親和勢,電子親和勢是基態的氣態原子得到電子變為氣態陰離子所放出的能量,數值越大得電子傾向越大.其中,
IE=E(N-1)-E(N)
(9)
EA=E(N)-E(N+1)
(10)
式中,E(N)、E(N-1)、E(N+1)分別是分子中性狀態、陽離子狀態和陰離子狀態的能量.
2.2 模擬方法
在量化程序中搭建c-C4F8和C3F7CN的分子模型如圖1所示,設置計算參數,其中泛函選擇B3LYP,基組選擇6-311G*,沿x軸方向施加步長為0.005 a.u.,范圍為-0.03 a.u.至0.03 a.u.的電場,電場關鍵詞為field=x-N nosymm,即N取值為-300至300,步長為50.使用關鍵詞int=ultrafine增加積分的空間格點數來確保收斂,在計算窗口中對無電場中性分子進行幾何優化,讀取優化后的分子坐標在加電場條件下對中性分子進行幾何優化,陽離子和陰離子計算單點.讀取結果文件中的能量,計算分子的電負性,同時將結果文件輸入到Multiwfn[19, 20]軟件中計算福井函數以及簡縮福井函數值,并利用可視化軟件作等值面圖.
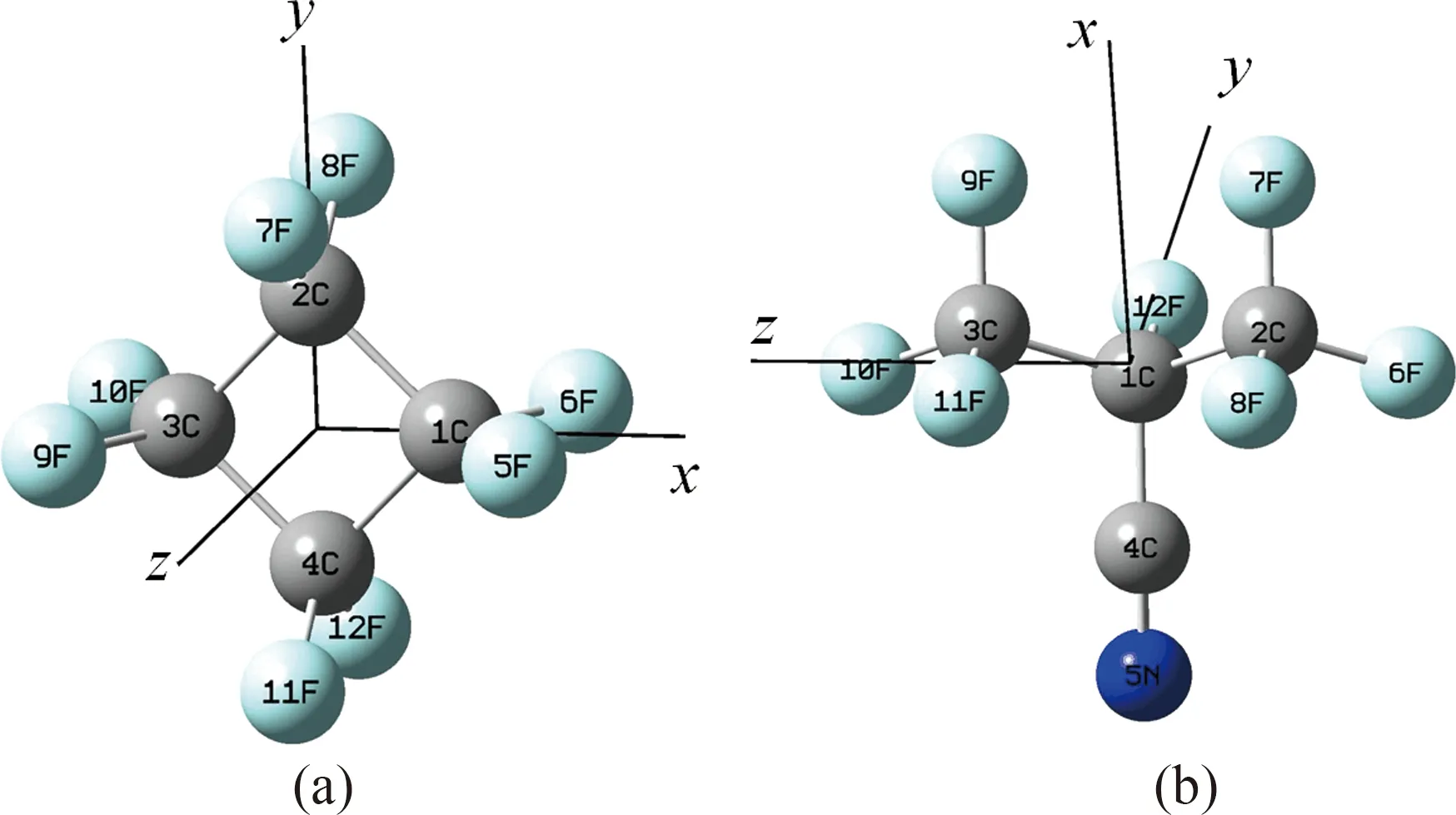
圖1 (a)c-C4F8分子模型;(b)C3F7CN分子模型Fig. 1 (a) molecular model of c-C4F8, (b) molecular model of C3F7CN
3 結果和分析
3.1 外電場對c-C4F8和C3F7CN分子化學反應活性的影響
福井函數是一個三維函數,考察其分布的最直觀方法就是作等值面圖,從福井函數計算公式可知其本質即電子密度差,在可視化軟件中設置并將此密度差映射到初始狀態電子密度上得到可反應福井函數大小的等值面圖,稱之為“福井函數投影到電子密度等值圖”.c-C4F8分子和C3F7CN分子在無電場情況下的福井函數投影到電子密度等值圖分別如圖2和圖3所示,圖中藍色越深的區域表示反應活性越強.
觀察圖2可知,c-C4F8分子內的F原子反應活性最強,親電反應位點和親核反應位點均在F原子上,即在化學反應中8個F原子容易得失電子.觀察圖3可知,C3F7CN分子內5N、4C、12F三個原子的反應活性比較強,且活性由強到弱依次為5N>4C>12F,即C3F7CN分子內親電反應位點和親核反應位點為5N、4C、12F.分別計算出上述反應位點的簡縮福井函數值如表1、表2和表3所示.

圖2 c-C4F8福井函數投影到電子密度等值圖: (a) 正面的親電反應活性;(b) 反面的親電反應活性;(c) 正面的親核反應活性;(d) 反面的親核反應活性Fig. 2 Isograms of Fukui function projecting into electron density of c-C4F8: (a) electrophilic reactivity in the front, (b) electrophilic reactivity in the reverse, (c) nucleophilic reactivity in the front, (d) nucleophilic reactivity in the reverse
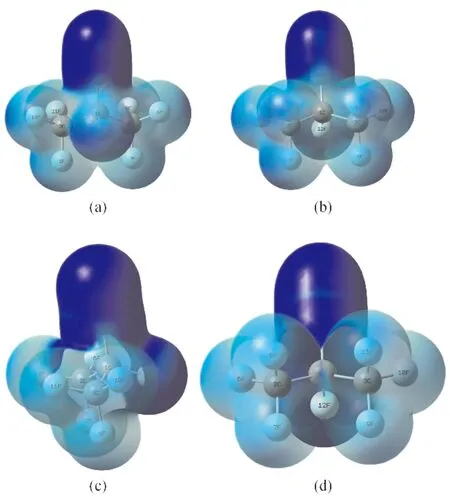
圖3 C3F7CN親電福井函數投影到電子密度等值圖: (a) 正面的親電反應活性;(b) 反面的親電反應活性;(c) 正面的親核反應活性;(d) 反面的親核反應活性Fig. 3 Isograms of Fukui function projecting into electron density of C3F7CN: (a) electrophilic reactivity in the front, (b) electrophilic reactivity in the reverse, (c) nucleophilic reactivity in the front, (d) nucleophilic reactivity in the reverse
根據表1、表2和表3可以看出,分子內反應位點的反應活性對電場強度有一定的依賴性.在表1和表2中,當外電場為0時,所有氟原子的親電簡縮福井函數值和親核簡縮福井函數值分別相同,5F和6F、7F和8F、9F和10F、11F和12F的簡縮福井函數以及隨外電場的變化均兩兩相同,c-C4F8的分子結構有極高的對稱性,每個C原子上兩個F原子的變化保持一致.在-0.03 a.u.到0.03 a.u.電場范圍內,5F與9F的簡縮福井函數隨外電場的變化互逆,而7F與11F的簡縮福井函數隨外電場的變化完全一致,這是因為外電場沿x軸方向變化,5F和6F、9F和10F在X軸向上,7F、8F與11F、12F關于x軸對稱.綜上,5F的簡縮福井函數f-隨著外電場的變化逐漸減小,即該位點失去電子愈發困難,親電反應活性越來越弱,f+隨著外電場的變化逐漸增大,即該位點愈發容易得到電子,親核反應活性越來越強,其變化規律如圖4所示;7F的簡縮福井函數f-和f+均隨外電場的變化先增大后減小,即該位點的親電反應與親核反應活性先增強后減弱,電場為0時達到最大值,最大值分別為0.092370和0.084616,整個變化過程較為緩慢,其變化規律如圖5所示;9F的簡縮福井函數f-隨外電場的變化逐漸增大,即該位點親電反應活性越來越強,f+隨外電場的變化逐漸減小,即該位點親核反應活性越來越弱,其變化規律如圖6所示.
在表3中,電場從-0.03 a.u.變化至0.03 a.u.時,5N的簡縮福井函數f-逐漸增大,且增幅較大,即該位點的親電反應活性大幅增強,f+逐漸減小,減幅較緩,即該位點的親核反應活性緩慢減弱,其變化規律如圖7所示;4C的簡縮福井函數f-大幅增大,即該位點的親電反應活性大幅增強,f+逐漸減小,即該位點的親核反應活性逐漸減弱,其變化規律如圖8所示;12F簡縮福井函數f-逐漸減小,即該位點的親電反應活性越來越弱,f+逐漸增大,增幅較小,即該位點的親核反應活性緩慢增強,其變化規律如圖9所示.
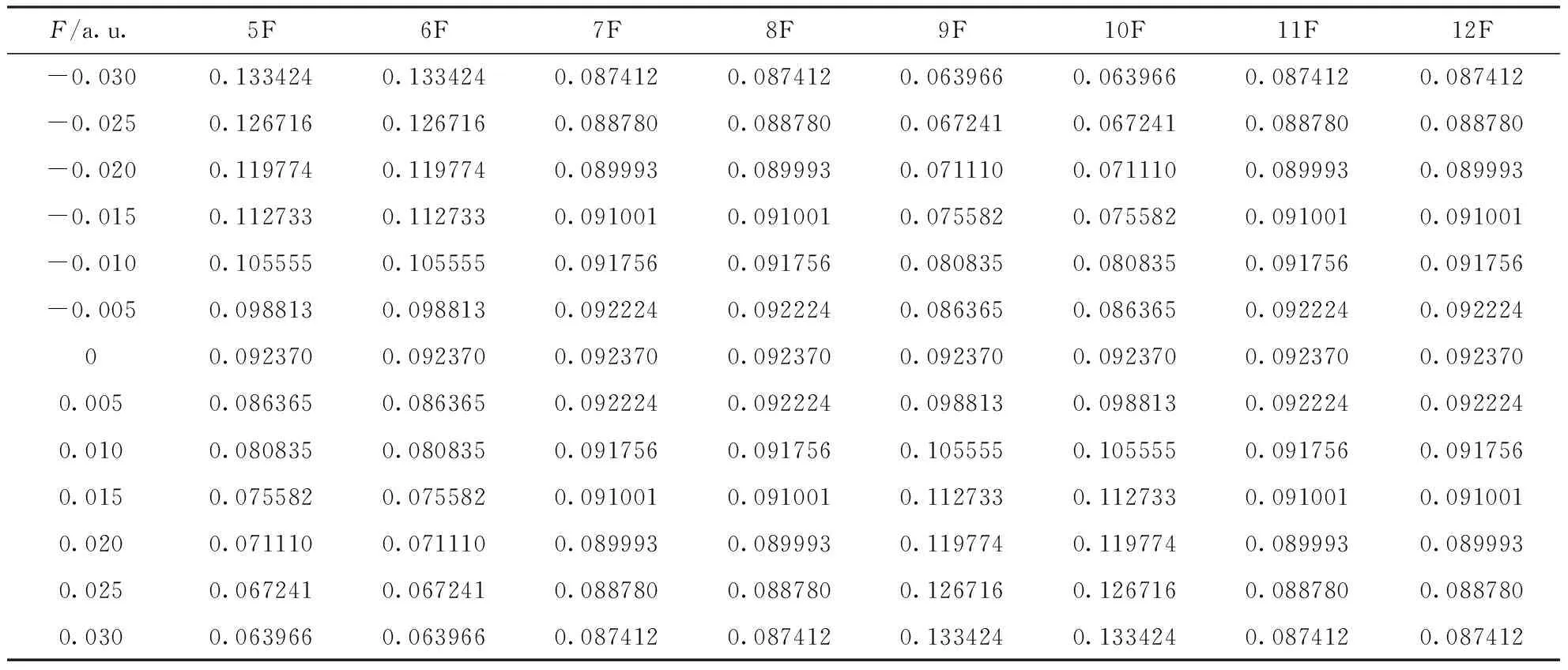
表1 不同電場強度下c-C4F8分子內F原子的親電簡縮福井函數
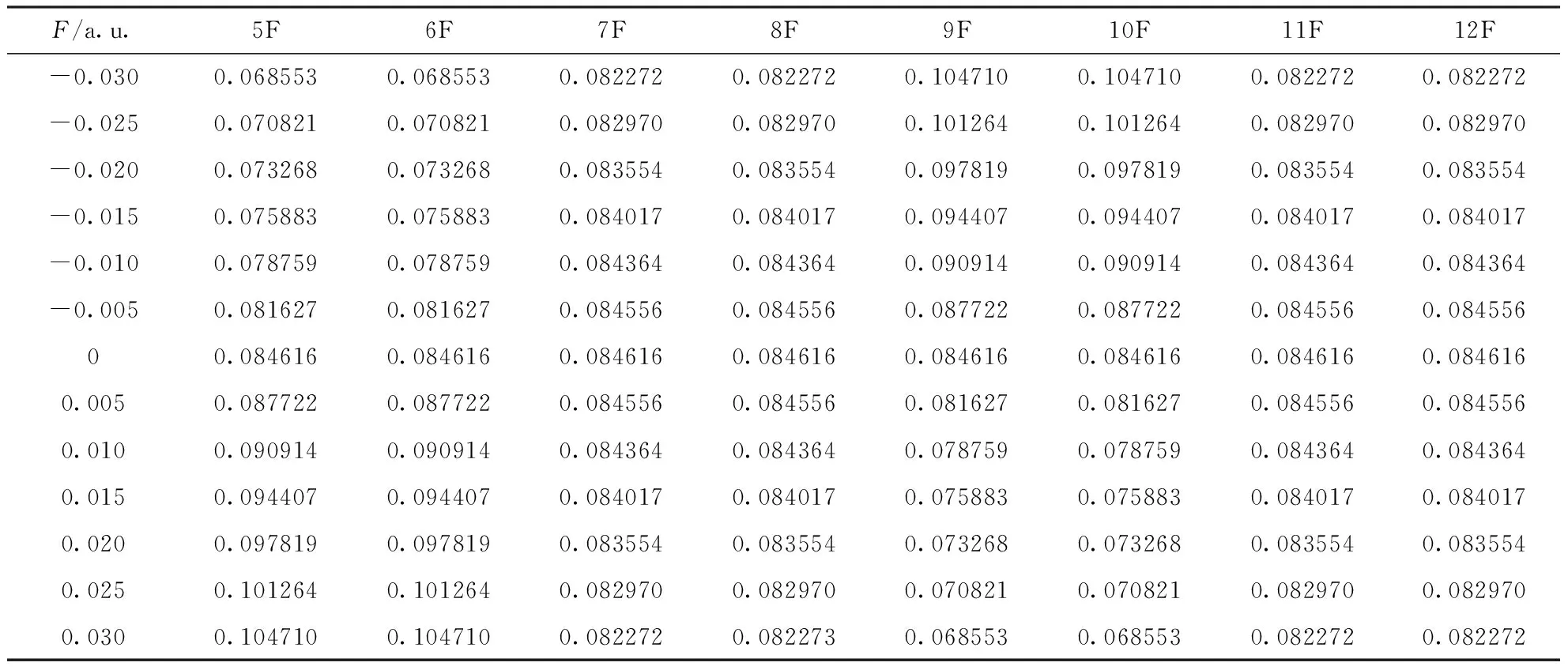
表2 不同電場強度下c-C4F8分子內F原子的親核簡縮福井函數
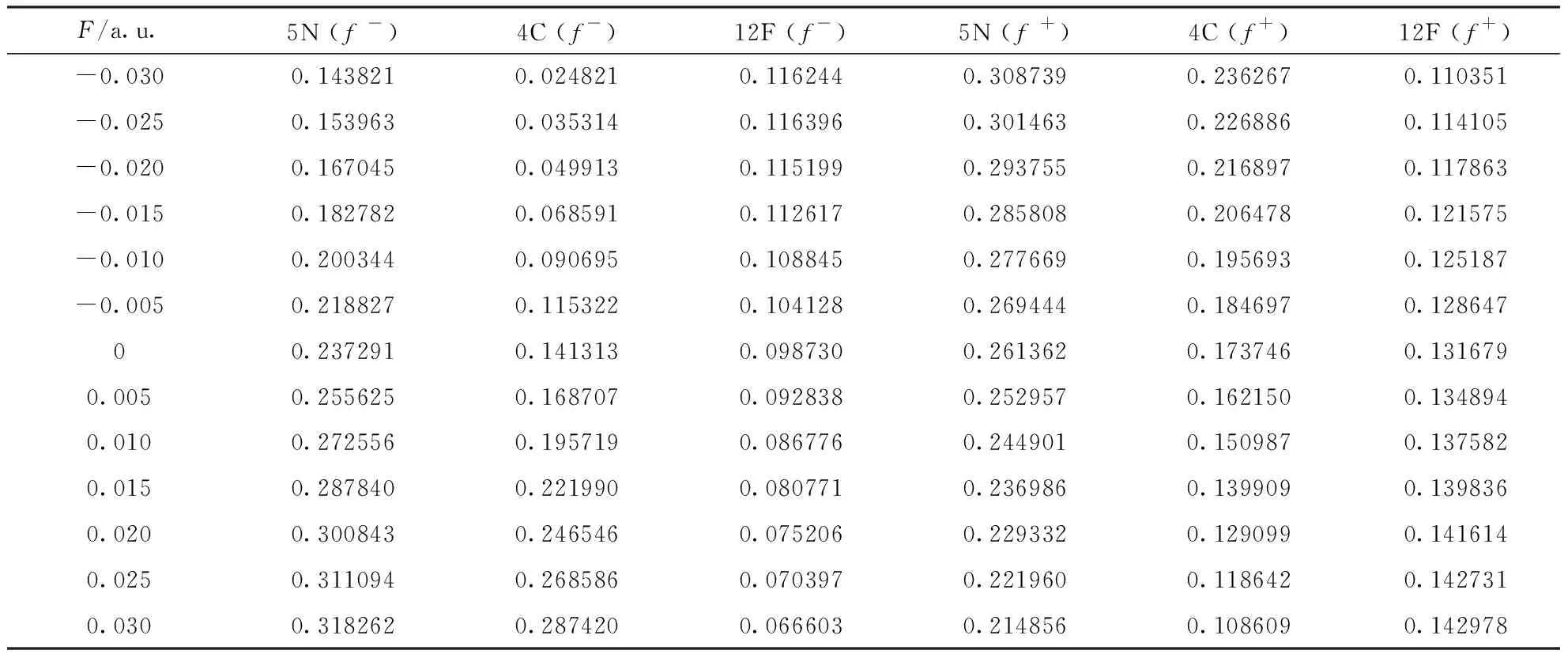
表3 不同電場強度下C3F7CN分子內反應位點的親電、親核簡縮福井函數
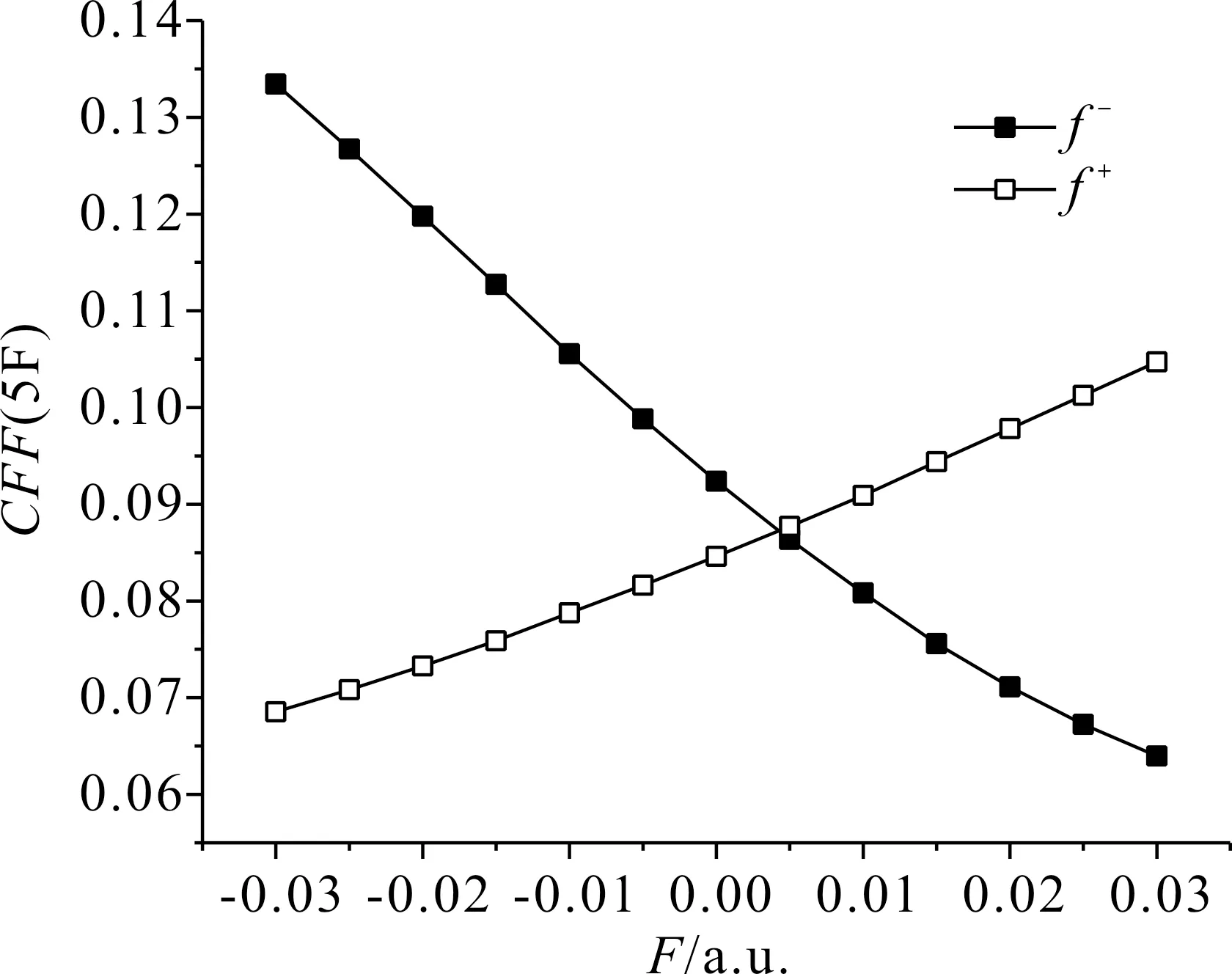
圖4 c-C4F8中5F簡縮福井函數隨電場強度的變化Fig. 4 Variation of the CFF(5F in c-C4F8) with electric field intensity
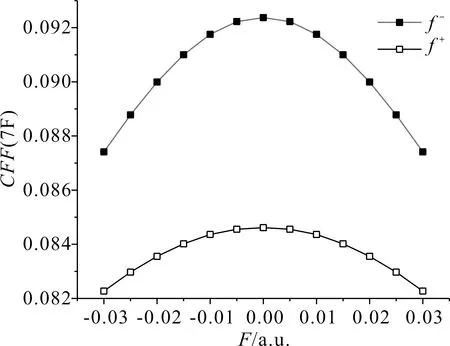
圖5 c-C4F8中7F簡縮福井函數隨電場強度的變化Fig. 5 Variation of the CFF(7F in c-C4F8) with electric field intensity
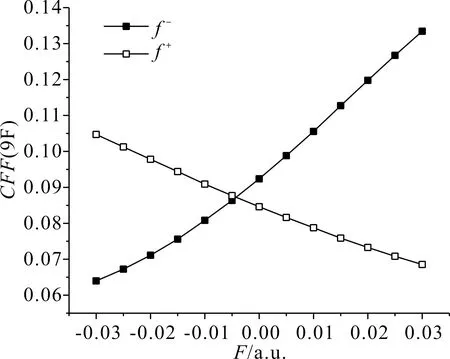
圖6 c-C4F8中9F簡縮福井函數隨電場強度的變化Fig. 6 Variation of the CFF(9F in c-C4F8) with electric field intensity
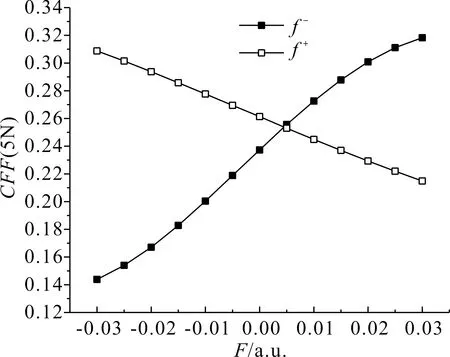
圖7 C3F7CN中5N簡縮福井函數隨電場強度的變化Fig.7 Variation of the CFF(5N in C3F7CN) with electric field intensity
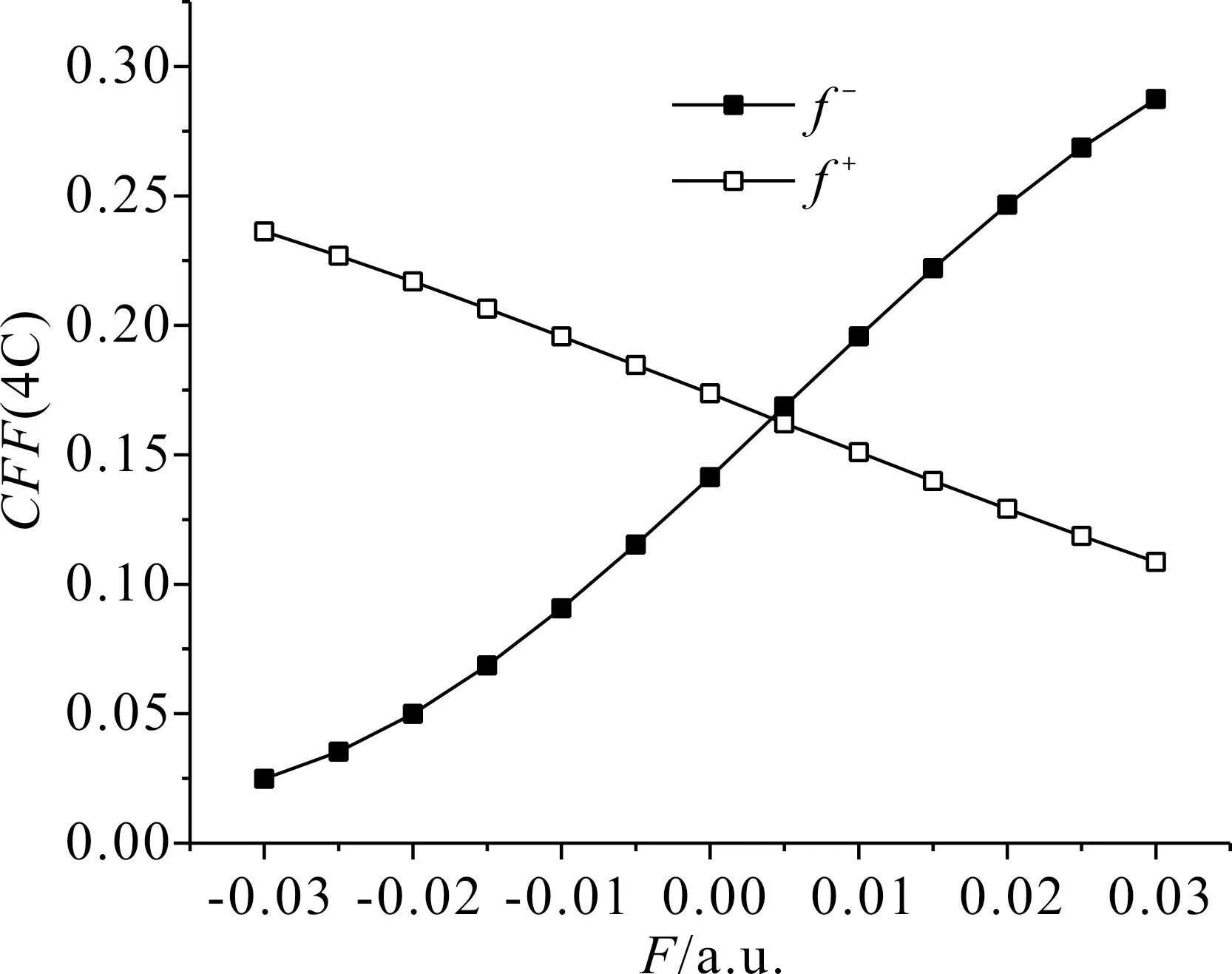
圖8 C3F7CN中4C簡縮福井函數隨電場強度的變化Fig. 8 Variation of the CFF(4C in C3F7CN) with electric field intensity
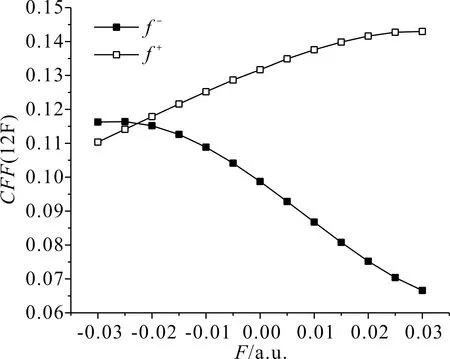
圖9 C3F7CN中12F簡縮福井函數隨電場強度的變化Fig. 9 Variation of the CFF(12F in C3F7CN) with electric field intensity
3.2 外電場對c-C4F8和C3F7CN電負性的影響
c-C4F8分子結構完美對稱,隨著外電場從-0.03 a.u.變化到0.03 a.u.,第一電離能、電子親和勢以及分子的電負性均與外電場方向無關,僅與外電場絕對值大小有關.表4為 c-C4F8在外電場作用時分子的總能量、第一電離能、電子親和勢以及電負性數據.電場絕對值越大,c-C4F8分子總能量越小,其主要原因是電場增大時原子上的電子發生偏移,電荷布局數發生變化,從而使得體系的哈密頓量H的勢能增大,進而使得體系的總能量降低[21].隨著電場絕對值的增大,第一電離能逐漸減小,電子親和勢逐漸增大.分子電負性逐漸增強,并且增幅逐漸加大,其變化規律如圖10所示.
表4 不同電場強度下 c-C4F8的總能量、第一電離能、電子親和勢以及電負性
Table 4 Total energies, the first ionization energies, electron affinities and electronegativities of c-C4F8under different electric field intensities
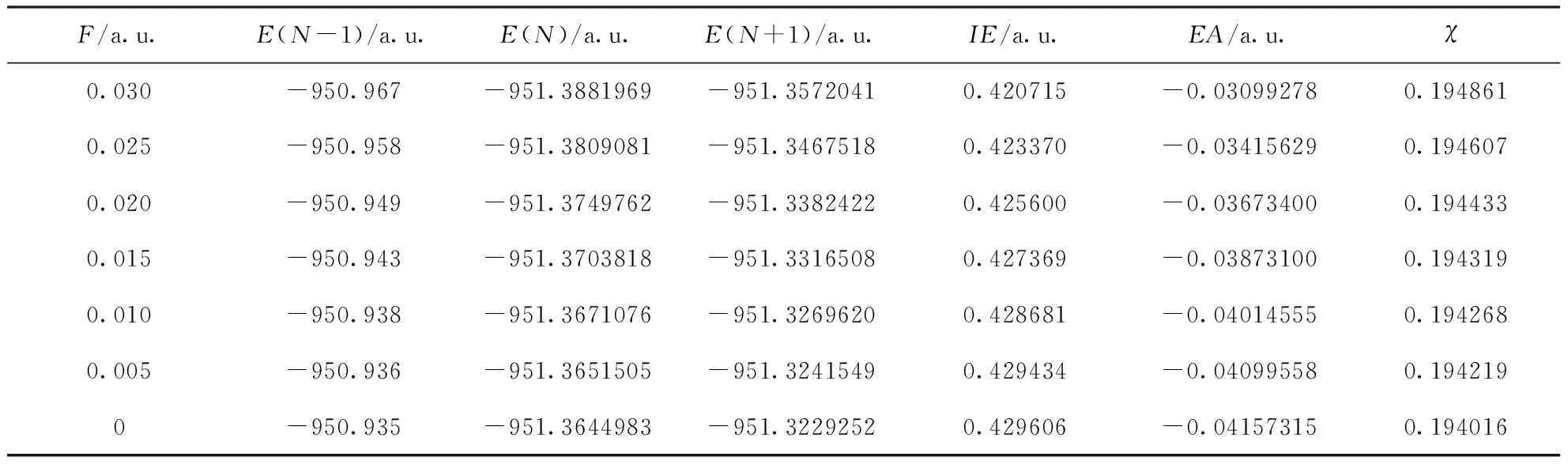
F/a.u.E(N-1)/a.u.E(N)/a.u.E(N+1)/a.u.IE/a.u.EA/a.u.χ0.030-950.967-951.3881969-951.35720410.420715-0.030992780.1948610.025-950.958-951.3809081-951.34675180.423370-0.034156290.1946070.020-950.949-951.3749762-951.33824220.425600-0.036734000.1944330.015-950.943-951.3703818-951.33165080.427369-0.038731000.1943190.010-950.938-951.3671076-951.32696200.428681-0.040145550.1942680.005-950.936-951.3651505-951.32415490.429434-0.040995580.1942190-950.935-951.3644983-951.32292520.429606-0.041573150.194016
表5為C3F7CN在外電場作用下分子的總能量、第一電離能、電子親和勢以及電負性數據.分子總能量在電場強度-0.03 a.u.至0.01 a.u.范圍內逐漸增加,且增幅逐漸變緩,在電場強度為0.01 a.u.時得到最大能量-906.2853531 a.u..在電場強度0.01 a.u.至0.03 a.u.范圍內逐漸減小,且減幅增大.第一電離能逐漸減小,電子親和勢大幅減小.分子電負性逐漸減小,其變化規律如圖11所示.
表5 外電場作用下 C3F7CN 的三種狀態總能量、第一電離能、電子親和勢以及電負性
Table 5 Total energies, the first ionization energies, electron affinities and electronegativities of C3F7CN under different electric field intensities

F/a.u.E(N-1)/a.u.E(N)/a.u.E(N+1)/a.u.IE/a.u.EA/a.u.χ-0.030-905.8429993-906.3372064-906.3580.494207070.021238630.257723-0.025-905.8314587-906.3244745-906.3360.493015840.011427560.252222-0.020-905.8223367-906.3135608-906.3160.491224100.002097950.246661-0.015-905.8158367-906.3044427-906.2980.48860604-0.006780500.240913-0.010-905.8120238-906.2971025-906.2820.48507870-0.015155660.234962-0.005-905.8110024-906.2915276-906.2680.48052522-0.023093040.2287160-905.8128873-906.2877093-906.2570.47482203-0.030434440.2221940.005-905.8172776-906.2856513-906.2490.46837368-0.037048120.2156630.010-905.8246943-906.2853531-906.2420.46065884-0.043363380.2086480.015-905.834831-906.2868282-906.2380.45199720-0.049038120.2014800.020-905.8476948-906.2900963-906.2360.44240146-0.054060720.1941700.025-905.863201-906.2951872-906.2370.43198628-0.058383260.1868020.030-905.8812725-906.3021425-906.2400.42086999-0.061944910.179463

圖10 c-C4F8電負性隨電場強度的變化Fig. 10 Variation of the c-C4F8 electronegativity with electric field intensity
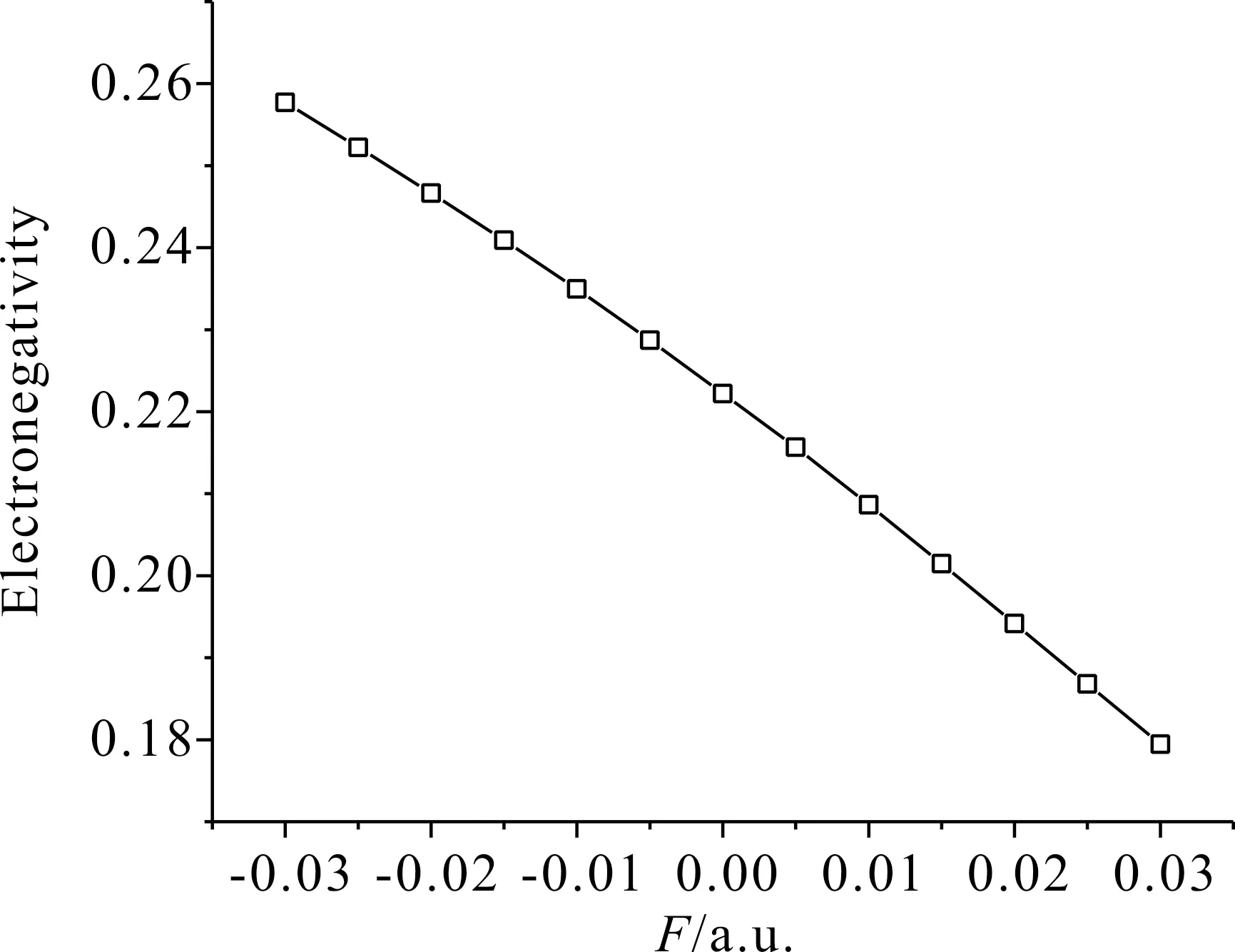
圖11 C3F7CN電負性隨電場強度的變化Fig. 11 Variation of the C3F7CN electronegativity with electric field intensity
所以,c-C4F8與C3F7CN分子的電負性受外電場影響有明顯變化,且無外電場作用時,兩者的電負性與SF6電負性的相對關系如表6所示,c-C4F8電負性達到SF6的0.67倍,C3F7CN電負性達到純SF6的0.77倍,相比c-C4F8電負性,C3F7CN電負性有顯著增強,表明在4個C的結構中碳氮三鍵相較于碳環更能提升分子電負性.
表6 無外電場作用時c-C4F8、C3F7CN、SF6的電負性以及相對電負性數據
Table 6 The electronegativities and relative electronegativities of c-C4F8, C3F7CN and SF6without electric field

F/a.u.χ(c-C4F8)相對電負性(相對于SF6)χ(C3F7CN)相對電負性(相對于SF6)χ(SF6)00.1940160.6747110.2221940.7727010.287555
4 結 論
本文采用DFT/B3LYP方法在6-311G*基組水平上對不同外電場下c-C4F8和C3F7CN分子的福井函數、簡縮福井函數與電負性進行了計算研究,發現外電場對分子簡縮福井函數和電負性影響明顯,得到結論如下:
(1)無外電場作用時,c-C4F8分子內部親電反應位點和親核反應位點均在四周的F原子上,即分子化學活性主要在F原子上;C3F7CN分子內部親電反應位點和親核反應位點為5N、4C和12F,即這三個位點最容易得失電子.
(2)原子的簡縮福井函數值對外電場的變化呈現出明顯的規律.由于c-C4F8分子結構完美的對稱性,關于電場方向對稱的兩組氟原子的CFF變化一致,而沿電場方向分布的兩組氟原子的CFF隨外電場的變化互為相反狀態.同時電負性僅與電場絕對值大小相關,電場增大,電負性增強.而C3F7CN分子電負性受到電場大小和方向兩者的影響,隨著電場的變化逐漸減弱.
(3)無外電場時,c-C4F8電負性達到純SF6的67%,C3F7CN電負性達到純SF6的77%.基于兩者的結構組成,碳氮三鍵相較于碳環對增強分子電負性有更好的效果.

