超聲輔助木瓜蛋白酶改性對米糠蛋白溶解性和乳化性的影響
常慧敏,楊敬東,田少君
(1.河南工業大學 糧油食品學院,鄭州450001; 2.蘭州潤民糧油有限公司,蘭州730070)
米糠蛋白中含3%~4%賴氨酸,高于水稻胚乳蛋白或其他谷物蛋白或豆類蛋白,生物效價(2.0~2.5)與牛奶中酪蛋白(2.5)相近,易于消化,不易致敏[1-2],還具有降低膽固醇、抗動脈粥樣硬化、抗疲勞和抗癌等作用。但是米糠蛋白與其他物質(如糖類,脂類)的強烈聚合,分子間通過大量的二硫鍵交聯使得其溶解性差,進而影響其他功能特性。因此,需要采用改性技術提高米糠蛋白功能特性。
蛋白質水解產物是含有若干種氨基酸的小分子肽,具有較好的功能特性,而且其產品具備更高的營養價值。Zhang等[3]研究了堿性蛋白酶酶解經過高溫穩定化及脫脂處理的米糠蛋白,Yeom等[4]研究了用兩種混合酶(堿性蛋白酶和風味蛋白酶)酶解米糠蛋白。這些措施都顯著提高了米糠蛋白功能性。但是對于木瓜蛋白酶酶解米糠蛋白的研究少有報道。木瓜蛋白酶是最便宜的植物來源蛋白酶之一,而且已經通過FDA批準可用于食品配方和食品加工中。木瓜蛋白酶主要作用于蛋白質親水氨基酸賴氨酸(Lys)、精氨酸(Arg)和苯丙氨酸(Phe)的羧基端,這樣可以避免C—末端為疏水性氨基酸的苦味肽的產生。然而,傳統的酶解具有水解度低和反應時間長的缺點[5],因此許多研究采用超聲處理來促進酶解反應。超聲波產生的空化作用所引起的機械和熱效應,可以改變蛋白質的構象和特性,從而有利于增加底物與酶之間的接觸頻率[6],縮短酶反應時間。Li等[7]的研究顯示,超聲預處理大米蛋白可以提高堿性蛋白酶酶解反應速率和蛋白質水解度。
本研究首先利用超聲對米糠蛋白進行預處理,破壞蛋白空間結構,暴露出更多的酶作用位點,再進行限制性酶解,改善米糠蛋白溶解性和乳化性。并從改性前后米糠蛋白二硫鍵、表面疏水性和二級結構的變化規律中,分析超聲輔助酶解反應的機理。
1 材料與方法
1.1 實驗材料
新鮮米糠,河南新鄉八素米業有限公司;大豆油,山東萬德福實業集團有限公司;木瓜蛋白酶(60萬U/g),南寧龐博生物工程有限公司;其他試劑均為化學純或分析純。
K1160全自動凱氏定氮儀;高速剪切乳化機,德國 FLUKO流體機械制造公司;磁力攪拌器;恒溫水浴振蕩器;高速離心機;722S可見分光光度計;PHS-3C 型精密酸度計;LGJ-25型冷凍干燥機;超聲波細胞粉碎機;傅里葉紅外光譜儀;RF-5301熒光分光光度計,日本Shimadzu公司。
1.2 實驗方法
1.2.1 米糠蛋白的制備
將脫脂米糠以料液比1∶10加入蒸餾水→45℃下調pH至9.0→磁力攪拌2 h后離心20 min(4 500 r/min)→取上清液,調pH至4.5→離心20 min (4 500 r/min)后收集沉淀→用20%乙醇溶液洗兩次后離心→沉淀復溶,調pH到7.0→冷凍干燥→米糠蛋白。米糠蛋白存放于-20℃備用。經凱氏定氮法測定其蛋白質含量為(60.35±0.31)%。
1.2.2 超聲輔助酶改性米糠蛋白
米糠蛋白溶液在超聲功率密度5 W/mL,超聲時間30 min,蛋白質量濃度4 g/100 mL條件下進行預處理,然后調節pH、溫度,添加一定量的木瓜蛋白酶反應一定時間,在反應過程中分別用0.1 mol/L NaOH和HCl溶液維持pH恒定,反應結束后置于85℃水浴中10 min進行滅酶,冷卻后得酶解液, 一部分使用蒸餾水稀釋至質量濃度為1 g/100 mL,測定其水解度(DH)、溶解性和乳化性,另一部分經過冷凍干燥用于結構的測定。
1.2.3 水解性的測定[8]
采用茚三酮比色法測定,計算公式見式(1)。
DH=酶解后游離氮含量/酶解前游離氮含量×100%
(1)
1.2.4 溶解性的測定[4]
用移液槍吸取1.2.2中10 mL酶解液于燒杯中,調節pH為7.0,室溫下磁力攪拌1 h,在4 500 r/min下離心20 min。吸取4 mL上清液,用半微量凱氏定氮法測定蛋白質含量,按式(2)計算溶解性。
溶解性=水溶性氮含量/樣品總氮含量×100%
(2)
1.2.5 乳化性的測定[9]
用移液槍吸取1.2.2中18 mL酶解液于50 mL離心管中,調節pH為8.0,室溫下磁力攪拌1 h,在4 000 r/min下離心8 min后,加入6 mL大豆油,使用10 000 r/min的均質剪切機剪切1 min,立即從容器底部吸50 μL新鮮乳液,用0.1 g/100 mL SDS溶液稀釋100倍,立即于500 nm波長下測吸光值(A0),10 min后繼續測吸光值(A10),乳化活性指數和乳化穩定性分別按式(3)和式(4)計算。
EAI=2×2.303×A0×N/(C×φ×10 000)
(3)
ESI=A0/(A0-A10)×10
(4)
式中:EAI為乳化活性指數,m2/g;N為稀釋倍數 100;C為乳液形成前蛋白溶液中蛋白質量濃度, g/mL;φ為乳液中油的體積分數,取值0.25;ESI為乳化穩定性,min。
1.2.6 游離巰基二硫鍵的測定[10]
采用 5,5′-二硫代二硝基苯甲酸鹽比色法測定米糠蛋白總巰基和游離巰基含量,以13 600 mol/(L·cm)消光系數進行計算。總巰基與游離巰基差值的一半即為二硫鍵含量。
1.2.7 表面疏水性的測定[10]
取100 mg米糠蛋白溶解于0.01 mol/L pH 7磷酸鹽緩沖液中,室溫下磁力攪拌2 h后5 000 r/min離心20 min,收集上清液。用磷酸鹽緩沖液將蛋白質量濃度稀釋在0.005~0.5 mg/mL之間。取4 mL蛋白溶液,加入20 μL 0. 008 mol/L 1-苯氨基萘-8-磺酸,混合均勻,在激發波長390 nm和發射波長470 nm下測定熒光強度。以熒光強度對蛋白質量濃度作圖,采用最小二乘法進行曲線擬合,直線斜率即為蛋白的表面疏水性。
1.2.8 傅里葉紅外光譜分析
取2 mg米糠蛋白和200 mg KBr混合,研磨均勻后制作透明薄片,以純KBr為參照樣,室溫干燥環境進行傅里葉紅外光譜掃描,掃描范圍400~4 000 cm-1。
對米糠蛋白的紅外吸收曲線進行二級求導,光譜數據用Peakfit4.12軟件進行分析。參考Wang等[11]的方法對二級結構進行鑒定:α-螺旋結構,1 650 ~1 658 cm-1;β-折疊結構,1 600~1 640 cm-1;β-轉角結構,1 660~1 700 cm-1;無規卷曲結構,1 640~1 650 cm-1。
1.2.9 數據統計與分析
單項實驗重復3次,結果表示為“平均值±標準差”。采用IBM SPSS Statistics 20軟件對數據進行單因素方差分析,如果方差分析差異性顯著(P<0.05),則使用Duncan’s進行多重比較。采用Origin8.5軟件進行圖表制作。
2 結果與分析
2.1 超聲預處理對酶解米糠蛋白水解度的影響
在預處理中,以乳化性和溶解性為指標,對米糠蛋白進行超聲改性,確定了最佳超聲條件為:超聲功率密度5 W/mL,超聲時間30 min,蛋白質量濃度4 g/100 mL。經超聲預處理的米糠蛋白再進行限制性酶處理,固定酶解條件為酶添加量2.5 g/100 mL、pH 7、酶反應溫度50℃,考察不同酶反應時間下超聲預處理對米糠蛋白水解度的影響,結果見圖1。

圖1 酶反應時間對米糠蛋白水解度的影響
由圖1可知,在相同酶反應時間內,與酶改性米糠蛋白相比,超聲輔助酶改性米糠蛋白具有較高水解度,表明超聲預處理促進蛋白質水解。可能因為超聲產生的空化效應有助于破壞溶質-基質間的相互作用,其中涉及范德華力、氫鍵和分子間的偶極子吸引力,使蛋白質分子伸展,暴露出較多的酶作用位點。另外,適當的預處理與酶解相結合,往往可以使酶解產物獲得更好的功能特性[12]。
2.2 超聲輔助木瓜蛋白酶改性米糠蛋白
在上述最佳超聲條件下,對米糠蛋白進行預處理后,進行酶改性處理,探討木瓜蛋白酶反應條件對其溶解性和乳化性的影響。
2.2.1 酶添加量的影響
在酶反應溫度50℃、pH 7、酶反應時間3 h下,考察酶添加量對米糠蛋白溶解性和乳化性的影響,結果見圖2、圖3。
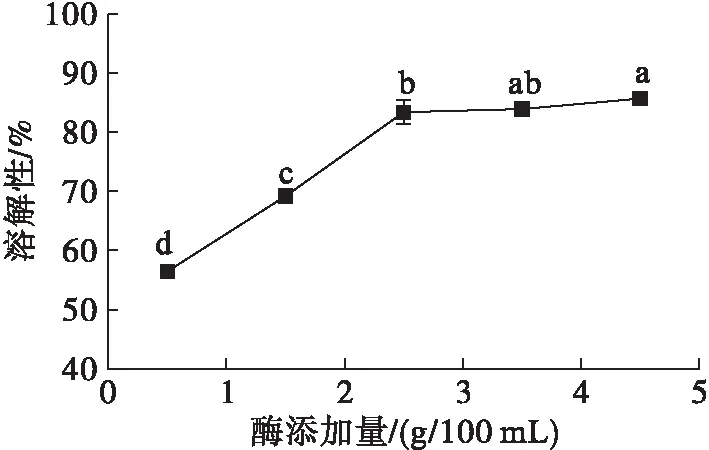
圖2 酶添加量對米糠蛋白溶解性的影響
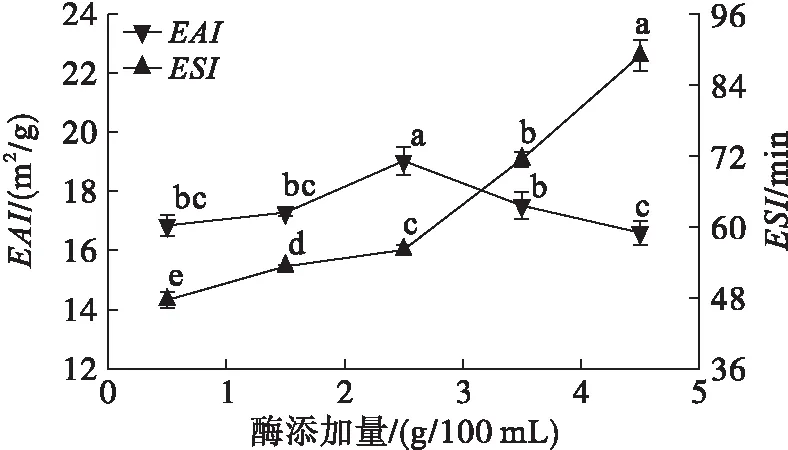
圖3 酶添加量對米糠蛋白乳化性的影響
由圖2可知,酶添加量超過2.5 g/100 mL后米糠蛋白溶解性增加幅度不大。由圖3可知,隨著酶添加量的增加,米糠蛋白乳化活性先增大后減少,酶添加量2.5 g/100 mL時達到最大,乳化穩定性則不斷升高。這可能因為酶添加量增大,蛋白質分子與酶接觸頻率增加,進而被水解成更多的小分子肽,而小分子肽能夠快速溶解并吸附在油水界面上,形成黏彈性保護膜,從而提高米糠蛋白的乳化活性。但當酶添加量到一定程度后,小分子肽被分解為更低相對分子質量的肽,它們可能不具有足夠的兩親性以表現出良好的乳化性質[13],使得乳化活性降低。而水解后的小分子肽增加了離子化基團的數量和分布,在形成的乳狀液中液珠間吸引作用小于排斥作用,二者不易聚集,并且蛋白質疏水基團外露,液珠中蛋白質分子與油滴的吸引作用增強,乳化穩定性提高[14]。雖然酶添加量較高時乳化穩定性較好,但乳化活性降低,而且酶解成本增加。因此,選擇酶添加量2.5 g/100 mL。
2.2.2 酶反應時間的影響
在酶反應溫度50℃、pH 7、酶添加量2.5 g/100 mL下,考察酶反應時間對米糠蛋白溶解性和乳化性的影響,結果見圖4、圖5。

圖4 酶反應時間對米糠蛋白溶解性的影響

圖5 酶反應時間對米糠蛋白乳化性的影響
由圖4可知,酶解3 h后米糠蛋白溶解性增加不顯著。由圖5可知,當酶反應時間延長,米糠蛋白乳化活性先增大后減小,在3 h達到最大。而乳化穩定性不斷升高。這與Bandyopadhyay等[9]研究結果一致。考慮到酶反應時間過長乳化活性降低及過度水解引起營養價值的改變[15],選擇酶反應時間3 h。
2.2.3 酶反應pH的影響
在酶反應溫度50℃、酶反應時間3 h、酶添加量2.5 g/100 mL下,考察酶反應pH對米糠蛋白溶解性和乳化性的影響,結果見圖6、圖7。
由圖6、圖7可知,米糠蛋白溶解性、乳化活性和乳化穩定性在pH 5~7時增加,pH 7~8時降低。這可能因為在適宜pH下,酶的活力最高,水解充分,二者達到最高。當pH 8~9時米糠蛋白溶解性及乳化性出現了增大現象,可能因為米糠蛋白在堿性條件下發生了水解,提高了其溶解度和乳化性,但pH較高時會破壞或改變必需氨基酸,降低蛋白質的質量[4]。因此,選擇酶反應pH 7。

圖6 酶反應pH對米糠蛋白溶解性的影響
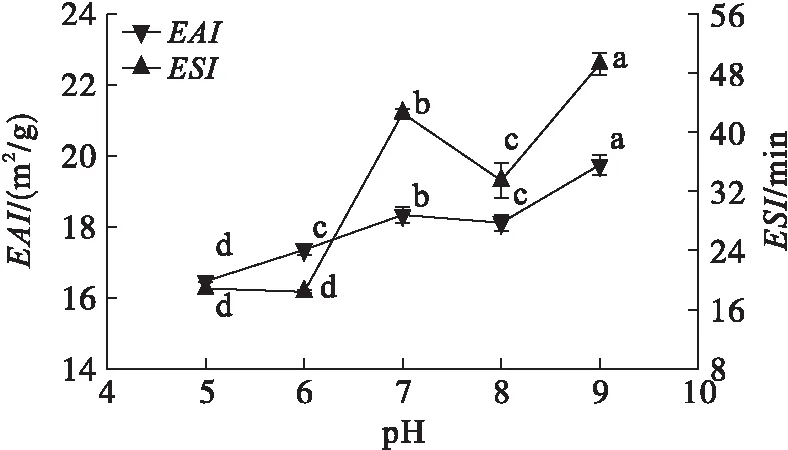
圖7 酶反應pH對米糠蛋白乳化性的影響
2.2.4 酶反應溫度的影響
在酶反應pH 7、酶添加量2.5 g/100 mL、酶反應時間3 h下,考察酶反應溫度對米糠蛋白溶解性和乳化性的影響,結果見圖8、圖9。
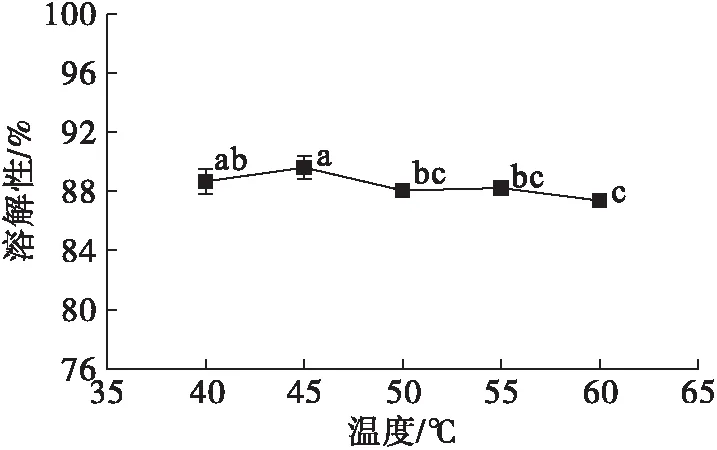
圖8 酶反應溫度對米糠蛋白溶解性的影響
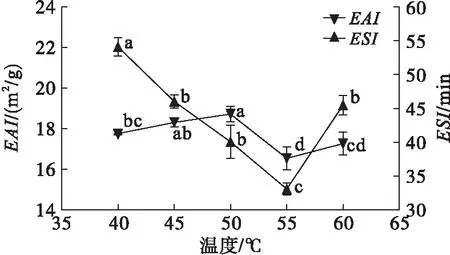
圖9 酶反應溫度對米糠蛋白乳化性的影響
由圖8可知,在酶反應溫度范圍內米糠蛋白溶解性變化幅度不大。由圖9可知,米糠蛋白乳化活性在40~50℃時增加,50~55℃時降低。乳化穩定性在40℃時最大,而55℃最小。這可能因為溫度影響了酶活。55℃后繼續升高溫度,米糠蛋白的乳化活性及乳化穩定性又有增高趨勢,可能因為米糠蛋白里混有的淀粉發生了糊化[4],增加了液體的黏度,使得二者增高。雖在低溫下乳化穩定性較高,考慮到溫度過低,酶活較弱,降低了乳化活性和延長了酶解時間,因此確定酶反應溫度為50℃。
2.2.5 驗證實驗
根據單因素實驗結果對米糠蛋白改性做綜合的驗證實驗,實驗共分為3組,各組的工藝參數見表1,并對比了改性前后米糠蛋白溶解性和乳化性,結果見表2。
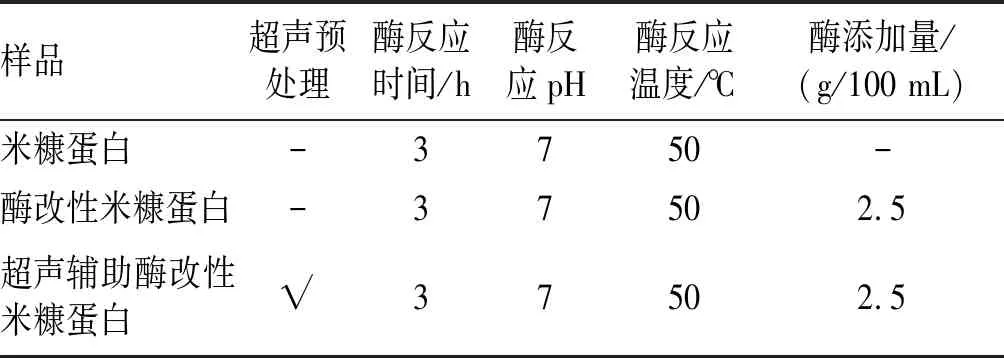
表1 驗證實驗參數
注:超聲預處理參數為超聲時間30 min,超聲功率密度5 W/mL,蛋白質量濃度4 g/100 mL。

表2 改性前后米糠蛋白溶解性和乳化性的對比
由表2可知,超聲輔助酶改性米糠蛋白溶解性比米糠蛋白提高了207.3%,可能因為米糠蛋白中不溶性蛋白質被酶解成可溶性小分子肽。乳化活性提高了54.94%,是由于米糠蛋白具有較低的表面疏水性,不利于其與脂質之間的相互作用[16],而酶解后,結構展開,疏水基團暴露于表面,提高了其在油水界面上的吸附作用,從而較易形成內聚性膜。但乳化穩定性降低了38.25%,可能因為米糠蛋白被水解成小分子的多肽,不能較好地包裹在油滴表面,降低了蛋白膜的穩固性[17]。但是,與酶改性米糠蛋白相比,超聲預處理使其溶解性、乳化活性及乳化穩定性均有所提高。
2.3 改性前后米糠蛋白二硫鍵含量(見表3)

表3 改性前后米糠蛋白二硫鍵含量
二硫鍵對于維持蛋白質的空間結構具有重要作用,其含量的增加表明蛋白質發生了交聯,而含量減少表明蛋白質主干結構被破壞[18]。由表3可知,超聲改性米糠蛋白二硫鍵含量減小,這與Zhou[19]等研究超聲預處理小麥胚芽蛋白的結果一致。可能因為超聲引起的剪切作用促使蛋白質發生了去折疊。另外,超聲輔助酶改性米糠蛋白二硫鍵含量減小效果比單獨酶法改性明顯,可能因為其多肽鏈更加伸展,進而使更多的包埋于蛋白質內部的親水和疏水基團暴露出來,提高了溶解度和乳化性。
2.4 改性前后米糠蛋白表面疏水性(見表4)

表4 改性前后米糠蛋白表面疏水性
由表4可知,超聲改性米糠蛋白表面疏水性增加,這與Jiang等[20]研究超聲處理黑豆蛋白的結果一致。表明更多的疏水區域暴露于蛋白表面,可能由于超聲打開蛋白質空間結構,進而促使酶更容易作用于蛋白質上,導致水解度提高,引起表面疏水性增加,促進其在溶液中擴散以及在油水界面上快速分布,增強乳化性,這與Cheetangdee[21]的研究結果一致。
2.5 改性前后米糠蛋白二級結構變化(見表5)
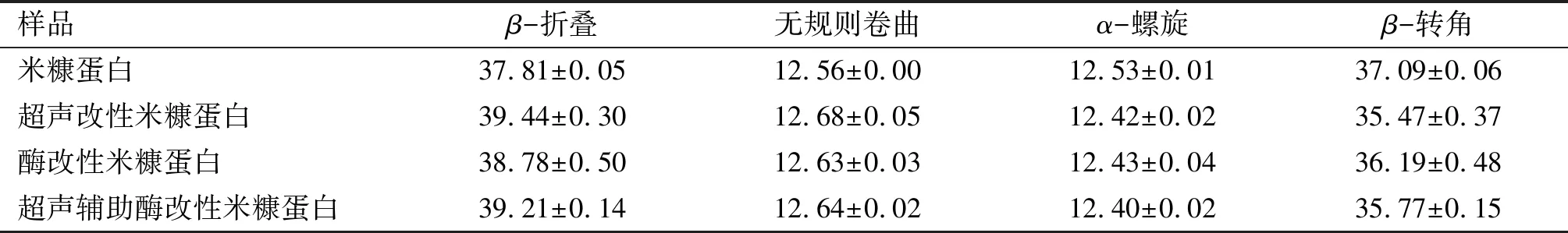
表5 改性前后米糠蛋白二級結構 %
β-折疊和無規則卷曲含量增加,β-轉角含量下降,表明蛋白質變得更加疏松與伸展[22]。從表5可知,超聲改性使米糠蛋白這種結構發生改變,進而使得酶與蛋白質分子更易于接近,從而提高酶解程度,促使溶解性增大。同時蛋白酶解后形成的小分子肽會促進α-螺旋結構向無規卷曲結構轉變,無規則卷曲可以為蛋白質分子提供柔性結構單元。而柔性越大,乳化性越好[23]。
3 結 論
米糠蛋白在超聲功率密度5 W/mL、超聲時間30 min、蛋白質量濃度4 g/100 mL條件下預處理后,進行酶解反應,當酶添加量2.5 g/100 mL、酶反應時間3 h、pH 7、酶反應溫度50℃時,超聲輔助酶改性米糠蛋白溶解性為89.61%,比未改性的提高了207.3%,乳化活性指數為19.29 m2/g,比未改性的提高了54.94%,乳化穩定性為50.00 min,比未改性的降低了38.25%。由于超聲促進酶催化位點暴露,所以與酶改性米糠蛋白相比,超聲輔助酶改性米糠蛋白的溶解性和乳化性均得到提高。
米糠蛋白經超聲輔助酶改性后,二硫鍵含量減少,表明蛋白質多肽鏈得到伸展,表面疏水性升高。β-折疊和無規則卷曲含量增大,α-螺旋和β-轉角含量減小,說明蛋白質結構發生伸展和重組,分子柔性增強。這些結構上的變化,改善了米糠蛋白的溶解性和乳化性。

