環靶明對前列腺癌PC3細胞株生長的影響及其作用機制研究*
冷 俊,周 曄,施利琴,張 莉
(上海交通大學醫學院附屬新華醫院崇明分院檢驗科,上海 202150)
近年來,由于人均壽命的增加及診療水平的提高,前列腺癌發病率呈顯著增長趨勢。我國前列腺癌患者在初診后多采用雄激素阻斷為主的綜合治療,但是這類患者經過一定時間后,許多病例仍將進展為雄激素非依賴性的前列腺癌,生存期明顯縮短,目前缺乏有效的干預手段[1]。鑒于前列腺癌對老年男性健康已造成了重大威脅,因此當前對前列腺癌研究的一個重要方面在于進一步闡明雄激素非依賴性前列腺癌的發病機制以及尋找更加有效的治療藥物。
環靶明(cyclopamine)是一種來源于藜蘆屬植物的甾體生物堿,有文獻[2]報道環靶明可通過抑制Hedgehog信號通路來抑制癌細胞的增殖、侵襲和轉移。本研究采用環靶明干預體外培養的雄激素非依賴性PC3細胞株,觀察其對PC3細胞生長的影響并探討其可能的作用機制。
1 材料與方法
1.1 材料 人前列腺癌PC3細胞株購自中國科學院細胞庫;環靶明購自美國Biomol International公司;碘化丙啶(PI)、Annexin V凋亡試劑盒,胰蛋白酶購自美國Sigma公司;總RNA抽提試劑TRizol為Invitrogen產品;熒光定量PCR試劑盒購自大連寶生物公司;F12培養基為Gbico產品;PCR platinum Mix購自Tiangen公司。
1.2 方法
1.2.1 細胞培養:將PC3細胞培養于F12培養基,內含10 ml/dl的胎牛血清,青、鏈霉素100 U/ml,置于37℃,5 ml/dl CO2,100%飽和濕度的孵箱內培養。視細胞生長情況換液、傳代。
1.2.2 MTT比色法:取對數生長期的PC3細胞接種于96孔培養板中,每孔約含2×104個細胞,放入培養箱,待細胞貼壁后,分5組進行實驗:終濃度為1,5,10和15 μmol/L的環靶明組和只加F12培養液的空白組,每組設3個復孔。繼續培養,在24,48和72 h各時間點分別取一板進行測定。空白孔調零,490 nm波長測定各孔吸光度A值。環靶明對細胞增殖活性的影響用抑制率表示(抑制率=1-細胞存活率,細胞存活率=實驗組平均A值/對照組平均A值)。
1.2.3 流式細胞儀(FCM)檢測細胞周期:取對數生長期的PC3細胞,以1×105個/ml的密度接種于6孔培養板內,加藥處理,方法同上,環靶明的最終濃度為1,5,10和15 μmol/L,空白組不加任何藥物;將培養板放入CO2孵箱中繼續培養,于72 h后回收細胞。以胰酶消化法收集并4℃離心 (1 000 r/min×5 min)細胞,PBS清洗3次,70 ml/dl冰乙醇固定,用RNase A(終濃度為0.1 g/L)消化30 min,加入0.05 g/L碘化丙啶(PI)250 μl,室溫避光染色30 min后上機檢測。
1.2.4 流式細胞儀(FCM)測定細胞凋亡率:按檢測細胞周期方法加藥處理細胞72 h后,用不含EDTA的胰酶進行消化(防止出現假陽性),收集細胞,用預冷的PBS洗兩遍。加入500 μl Binding Buffer重懸細胞,加入5 μl Annexin V-FITC和5 μl PI,輕輕混勻,室溫避光反應15 min,在1 h內上機檢測。
1.2.5 Real-time PCR檢測Gli1,Bax和Bcl-2的mRNA表達水平:實驗組分別加入終濃度為1,5,10和15 μmol/L的環靶明混合培養液,對照組加入等量F12培養液,于72 h后收集細胞。用Trizol試劑抽提細胞總RNA,按TaKaRa公司的SYBR Prime Script RT- PCR Kit說明書進行逆轉錄和實時熒光PCR。采用20 μl反應體系, 應用Light Cycler (Roche Diagnostics公司)進行熒光定量分析。以GAPDH為內參,上游引物:5’-GGTGTGAACCATGAGAAGTATGA-3’,下游引物:5’-GAGTCCTTCCACGATACCAAAG-3’,擴增長度為123bp;Gli1上游引物:5’-AGCTAGAGTCCAGAGGTTCAA-3’,下游引物:5’-TAGACAGAGGTTGGGAGGTAAG-3’,擴增長度為102bp;Bax上游引物:5’-GTTTCATCCAGGATCGAGC-3’,下游引物:5’-GATCATCCTCTGCAGCT CC-3’,擴增長度為138bp;Bcl-2上游引物:5’- TGTGTGGAGAGCGTCAACAG-3’,下游引物:5’-TCCACAAAGGCGTCCCAGC-3’,擴增長度為237bp,以 2-ΔΔCt值分析結果。
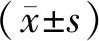
2 結果
2.1 環靶明對PC3細胞增殖的影響 見圖1。MTT結果顯示:在1 μmol/L的環靶明組中,PC3細胞的增殖未受到明顯抑制,而經5,10和15 μmol/L的環靶明處理后,PC3細胞的生長抑制率明顯升高,且與藥物濃度高低和作用時間長短呈一定正相關關系。

圖1 PC3細胞在經環靶明作用不同時間后的細胞生長抑制率
2.2 環靶明對PC3細胞周期的影響 見表1。流式細胞儀分析顯示,PC3細胞經藥物處理后,1,5 μmol/L環靶明組的各期細胞數量無明顯變化,而10和15 μmol/L環靶明組G0/G1期細胞數量逐漸增加,S期、G2/M細胞數量下降。
2.3 環靶明對PC3細胞凋亡率的影響 環靶明作用于PC3細胞72 h后,對照組,1,5,10和15 μmol/L組的凋亡率分別為3.55%±0.46%,4.97%±1.27%,7.54%±1.19%,12.47%±2.11%,24.15%±3.40%。除1 μmol/L組以外(t=1.820,P=0.143),其余各組與對照組相比,差異均有統計學意義(t=5.414,7.159,10.413;P=0.018,0.002,0.000),且隨著濃度的升高,凋亡率顯著增加。

表1 PC3細胞在經環靶明作用72 h后細胞周期的變化
2.4 環靶明對細胞中Gli1,Bax和Bcl-2的mRNA表達影響 經環靶明作用72 h后,Gil1的mRNA表達水平有下降趨勢,但與對照組相比,僅15 μmol/L組的差異有統計學意義(F=1.932);除1 μmol/L組以外,其他藥物濃度干預組Bax的mRNA表達水平均顯著增加(F=133.750),Bcl-2的mRNA表達水平顯著下降(F=13.518),差異有統計學意義(P<0.05),且有一定的劑量效應關系。

(*P<0.05 vs 對照組,** P<0.01 vs 對照組,n=3)
3討論近年來Hedgehog信號通路在前列腺癌發生發展中的作用受到越來越多的重視。正常情況下,在胚胎發育成熟后,Hedgehog信號通路便進入了失活狀態。在某些因素的作用下,Hedgehog信號通路被異常激活,可引起C-myc,VEGF等下游靶基因的表達,導致細胞增殖過度,誘發腫瘤[3]。文獻報道Hedgehog信號通路的異常活化可誘發多種內胚層腫瘤,如:非小細胞肺癌、食道癌、胃癌、結腸癌等[4-6]。同樣作為內胚層起源的前列腺癌中亦存在相似的變化[7]。
由于前列腺癌中存在Hedgehog信號通路的異常激活,那么環靶明作為Hedgehog信號通路拮抗劑有可能會成為治療前列腺癌的有效藥物。本研究用MTT法證實,經5,10和15 μmol/L的環靶明處理后,可有效抑制體外培養的PC3細胞生長增殖活性,且抑制率與藥物濃度和作用時間呈正相關關系,與熊永江等[8]人的報道一致。
本研究還用流式細胞術檢測環靶明對PC3細胞周期和凋亡率的影響,低濃度的環靶明(1,5 μmol/L)作用72 h對PC3的細胞周期影響不明顯,自10 μmol/L起,環靶明可將PC3細胞阻滯于G1期,G0/G1期細胞數量逐漸增加,S期、G2/M細胞數量逐漸下降。陳新宇等[9]人報道8 μmol/L環靶明作用48h對PC3細胞周期分布影響較弱,兩者間的差異可能與藥物濃度高低和作用時間長短有關系。5,10,15 μmol/L環靶明作用PC3細胞72 h后,細胞的凋亡率明顯增加,說明環靶明可誘導其凋亡,且隨著藥物濃度增大,細胞凋亡率升高,有一定的濃度依賴關系。文獻報道[10],環靶明處理前列腺癌DU145細胞后凋亡率亦明顯升高,升高程度與藥物濃度呈正相關,與本研究結果類似。
本研究進一步檢測了Hedgehog通路下游轉錄因子Gli1和凋亡相關基因Bax,Bcl-2的mRNA表達水平。Bax和Bcl-2是線粒體凋亡途徑中重要的調控蛋白,Bax可誘導細胞凋亡,而Bcl-2則抑制細胞凋亡,兩者的平衡在決定細胞是否發生凋亡中起重要作用[11]。在許多腫瘤中存在Bcl-2表達升高,而Bax表達下降[12-13]。本研究發現,經5,10和15 μmol/L環靶明處理72 h后,PC3細胞中Bax的 mRNA表達水平顯著上升,而Bcl-2的mRNA表達水平則顯著下降,兩者的平衡被打破,對細胞凋亡的發生有促進作用。Gil1的mRNA表達水平有下降趨勢,但與對照組相比,僅15 μmol/L組的差異有統計學意義,推測在環靶明抑制PC3細胞株生長的過程中,Hedgehog信號通路的下調可能并非占主導作用。
綜上所述,本研究證明環靶明對前列腺癌PC3細胞株的增殖有明顯抑制作用,其作用機制可能與影響細胞周期、提高Bax和下調Bcl-2基因表達水平、進而誘導細胞凋亡有關,為尋找非雄激素依賴性前列腺癌的治療藥物提供了一定的實驗依據。

