液體治療的劑量對擇期腹部手術病人的影響
李志強,史軍卿,王冠達,王雅靖,夏春輝
作者單位:華北理工大學附屬醫院重癥醫學科,河北 唐山 063000
圍手術期液體治療的劑量和類型對術后病死率和并發癥發生率有至關重要的影響,因此越來越受到關注[1-2]。在大手術、創傷、休克等許多臨床情況下液體復蘇通常是治療成敗的關鍵,其原理在于快速補充有效循環血容量,維持內環境穩定,從而保證組織器官灌注及氧合,防止繼發性器官功能障礙的發生[3]。
外科手術病人的液體管理通常由容量狀態、液體維持量、第三間隙損失量來決定[4],然而,血流動力學指標變化(血管擴張、心肌抑制)和全身炎癥改變(血管通透性增加)也是影響液體治療的因素[5-6]。另外,最新研究表明液體治療的量、類型和時機可能會影響手術病人的臨床預后。比如,人工合成膠體可能增加急性腎損傷的風險[7-9],在膿毒癥早期采用限制性液體治療可能改善病人預后[10-11],對急性肺損傷病人延遲液體治療可能增加機械通氣治療時間[12],此外,連續液體正平衡可能增加病人術后并發癥發生率和病死率[13-15]。因此,本研究的目的在于評估圍手術期液體治療的劑量和類型對擇期腹部手術病人術后ICU住院時間、病死率、術后并發癥發生率的影響。
1 資料與方法
1.1 納排標準和方法屬性(1)納入標準:2014年1月1日至2016年1月1日接受擇期腹部手術后入住在華北理工大學附屬醫院ICU>48 h的病人。
(2)排除標準:①年齡<18周歲;②ASA>Ⅲ級;③單獨或聯合接受骨科、胸外科、心臟外科、神經外科、血管外科、整形外科和產科手術;④創傷病人;⑤≥2次入住ICU的病人,包括二次手術病人;⑥實施姑息手術的病人;⑦術后病人或代理人要求限制性治療的病人。
(3)試驗方法:病例對照研究。
(4)倫理問題:本研究符合《世界醫學協會赫爾辛基宣言》相關要求。病人或其近親屬對治療知情同意。
1.2 液體類型的定義晶體液包括0.9%生理鹽水、乳酸林格液和平衡鹽溶液;膠體液包括人工膠體(低分子右旋糖酐、羥乙基淀粉、琥珀酰明膠)和血液制品(人血清蛋白、血漿)。因臨床實踐中不以紅細胞、血小板或冷沉淀作為液體治療,所以上述血液制品的輸注量計入到每日總液體入量中,但不列入本課題研究的液體類型中。
1.3 資料收集采用紙質的統一的數據填寫表格收集以下數據:人口學數據,包括年齡和性別,體質量,基礎疾病,圍手術期急性生理與慢性疾病評估(Acute Physiology and Chronic Health Evaluation,APACHE-Ⅱ),手術名稱,手術時間,術中是否使用升壓藥物。液體治療:術中液體入量、術中液體出量。術后(最長記錄到轉出ICU或術后第5天)液體入量和輸液類型。計算每天液體平衡量,累計液體平衡量,并計算累計晶體-膠體容積比。臨床結局指標,主要結局指標包括ICU病死率、住院病死率,次要結局指標包括術后并發癥發生率,例如急性腎損傷(KDIGO標準),需腎臟替代治療;心血管并發癥(包括急性心力衰竭、心肌梗死和心律失常);呼吸系統并發癥(包括呼吸衰竭、肺水腫、肺炎和胸腔積液);傷口感染;胃腸道并發癥(包括腸梗阻和腸瘺);ICU和總住院時間。
1.4 統計學方法按術后ICU滯留是否超過5 d為界,分為延時ICU住院組(>5 d)和非ICU延時住院組(≤5 d)[16]。
采用SPSS 17.0進行數據分析。正態分布連續變量采用±s表示,偏態分布則行對數轉化。采用兩因素重復測量方差分析、單因素方差分析或Mann-Whitney秩檢驗;分類變量采用例(%)表示,比較采用χ2檢驗或Fisher精確概率法;采用非條件logistic回歸,以病人是否延時ICU住院為因變量,將單因素分析中P<0.05的變量作為自變量,篩查影響術后病人延時ICU住院的危險因素并建立風險預測模型;應用受試者工作特征曲線下面積和Hosmer-Lemeshow擬合優度檢驗判斷模型的辨別力和校準度。P<0.05為差異有統計學意義。
2 結果
2.1 一般資料等各項指標的比較該研究總共納入186例病人,年齡(68.10±13.50)歲,其中男性占55.38%。圍手術期APACHE-Ⅱ評分平均值為(15.30±2.91),胃腸道腫瘤切除術占所有手術類型的60.75%,其中胃癌30例,結腸癌56例,直腸癌18例,肝癌9例。所有納入研究的病人術后均轉入ICU進一步治療,其中延時ICU住院的病人有72例,占所有病人的38.71%。通過單因素分析,延時ICU住院組與非延時ICU住院組相比在術中升壓藥物使用率、術中輸血率、術后APACHE-Ⅱ評分、術后氧合指數、術后血乳酸水平等指標均差異有統計學意義(P<0.05),見表1。在手術類型及麻醉方式中差異無統計學意義,見表2。從術中到術后48 h液體出入量差異有統計學意義,見表3。

表1 接受擇期腹部手術病人一般資料比較
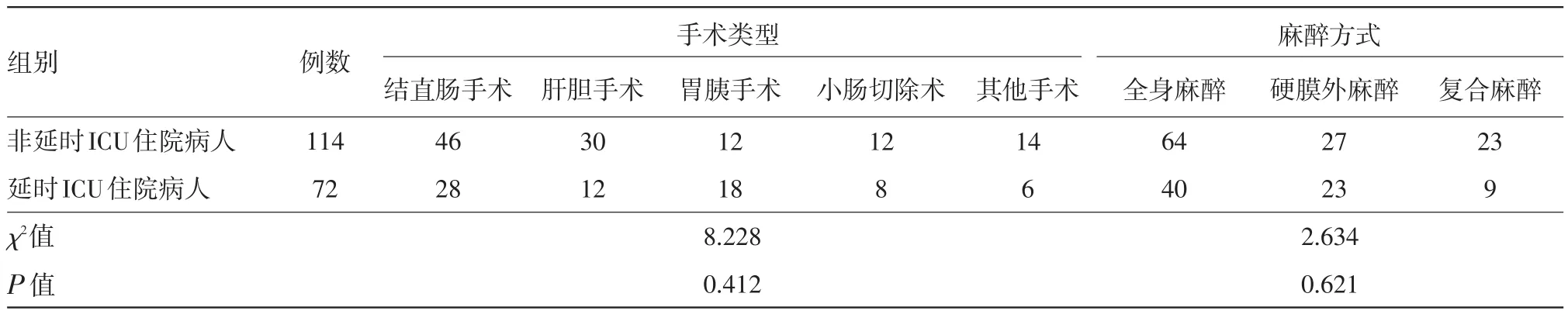
表2 接受擇期腹部手術病人手術類型及麻醉方式分組比較/例
表3接受擇期腹部手術病人圍手術期液體出入量分組比較/(mL,±s)
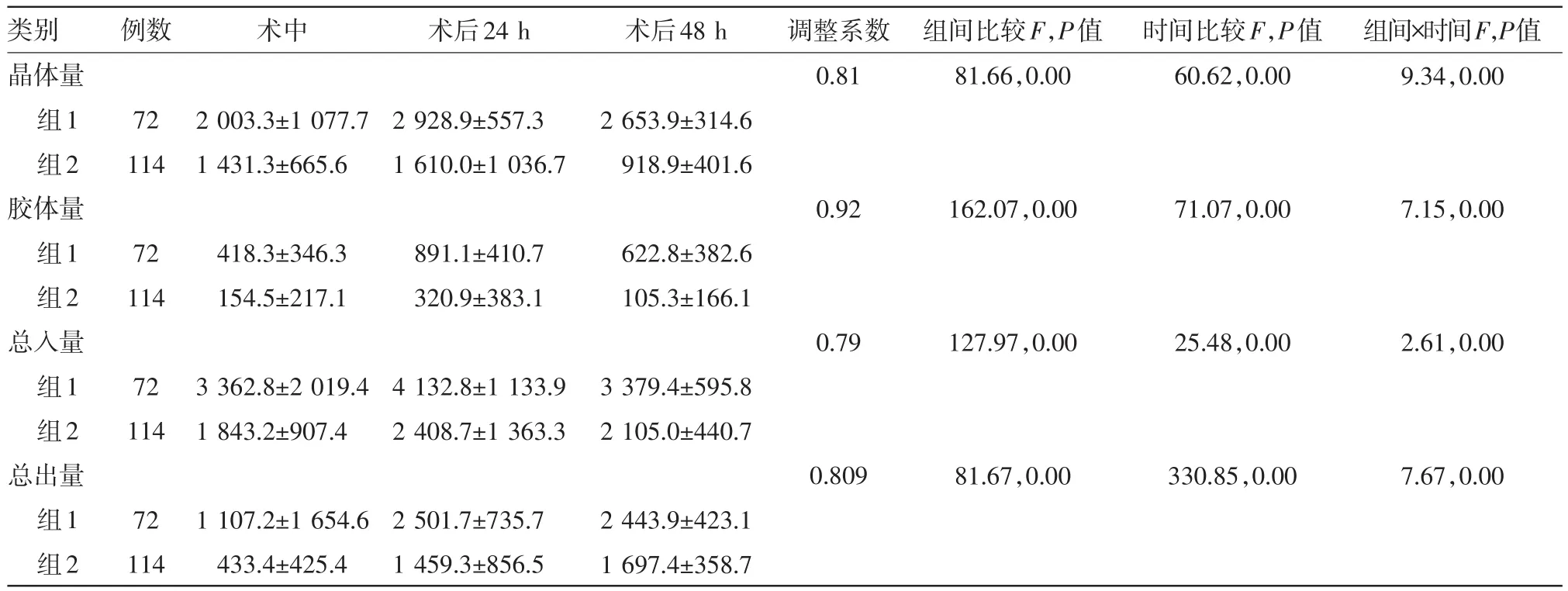
表3接受擇期腹部手術病人圍手術期液體出入量分組比較/(mL,±s)
注:組別1為延時ICU住院組;組別2為非延時ICU住院組
類別晶體量組1組2膠體量組1組2總入量組1組2總出量組1組2例數72 114 72 114 72 114 72 114術中2 003.3±1 077.7 1 431.3±665.6 418.3±346.3 154.5±217.1 3 362.8±2 019.4 1 843.2±907.4 1 107.2±1 654.6 433.4±425.4術后24 h 2 928.9±557.3 1 610.0±1 036.7 891.1±410.7 320.9±383.1 4 132.8±1 133.9 2 408.7±1 363.3 2 501.7±735.7 1 459.3±856.5術后48 h 2 653.9±314.6 918.9±401.6 622.8±382.6 105.3±166.1 3 379.4±595.8 2 105.0±440.7 2 443.9±423.1 1 697.4±358.7調整系數0.81 0.92 0.79 0.809組間比較F,P值81.66,0.00 162.07,0.00 127.97,0.00 81.67,0.00時間比較F,P值60.62,0.00 71.07,0.00 25.48,0.00 330.85,0.00組間×時間F,P值9.34,0.00 7.15,0.00 2.61,0.00 7.67,0.00
2.2 延時ICU住院的影響因素分析將單因素分析中篩選出的術中液體平衡量、術后5 d累計液體平衡量、術后5 d累計膠體-晶體容積比等7項可疑因素作為自變量,以是否延時ICU住院作為應變量(非延時ICU住院=0;延時ICU住院=1),納入logistic二項回歸分析模型中,采用逐步向前剔除法進行篩選(α=0.05),最終納入模型的變量是術中液體平衡量、術后5 d累計液體平衡量、術后APACHE-Ⅱ評分、術后血乳酸水平及氧合指數,見表4。
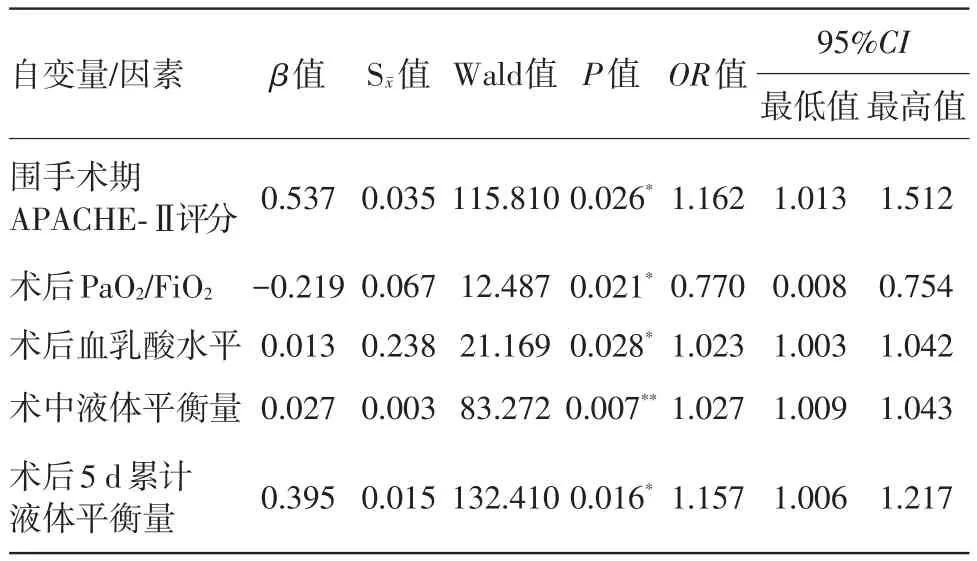
表4 接受擇期腹部手術病人延時ICU住院的獨立危險因素
2.3 各指標/參數的ROC分析對術中液體平衡量進行靈敏度及特異度分析,繪制受試者工作特征曲線(ROC曲線),曲線下面積AUC=0.785(0.720,0.859),P<0.001,說明術中液體正平衡量可以預測術后延時ICU住院,影響病人術后ICU住院時間的術中液體平衡量臨界值是2 000 mL(靈敏度=0.611,特異度=0.816),見圖1A。
對術后累積液體正平衡量進行靈敏度和特異度分析,繪制ROC曲線,曲線下面積AUC=0.716(0.638,0.795),P<0.001,說明術后累積液體正平衡量可以用來預測延時ICU住院,影響病人術后延時ICU住院的術后5d累計液體平衡量臨界值是5 800 mL(靈敏度=0.389,特異度=0.895),見圖1B。
對術后APACHE-Ⅱ評分進行靈敏度和特異度分析,繪制ROC曲線,曲線下面積AUC=0.605(0.523,0.687),P<0.001,說明術后APACHE-Ⅱ評分可以預測術后是否延時ICU住院,影響病人術后延時ICU住院的APACHE-Ⅱ評分臨界值是17.5(靈敏度=0.333,特異度=0.799),見圖1C。
對術后血乳酸濃度進行靈敏度和特異度分析,繪制ROC曲線,曲線下面積AUC=0.713(0.638,0.788),P<0.001,說明術后血乳酸濃度可以預測延時ICU住院,影響病人術后延時ICU住院的血乳酸濃度臨界值是2.4 mmol/L(靈敏度=0.389,特異度=0.868),見圖1D。
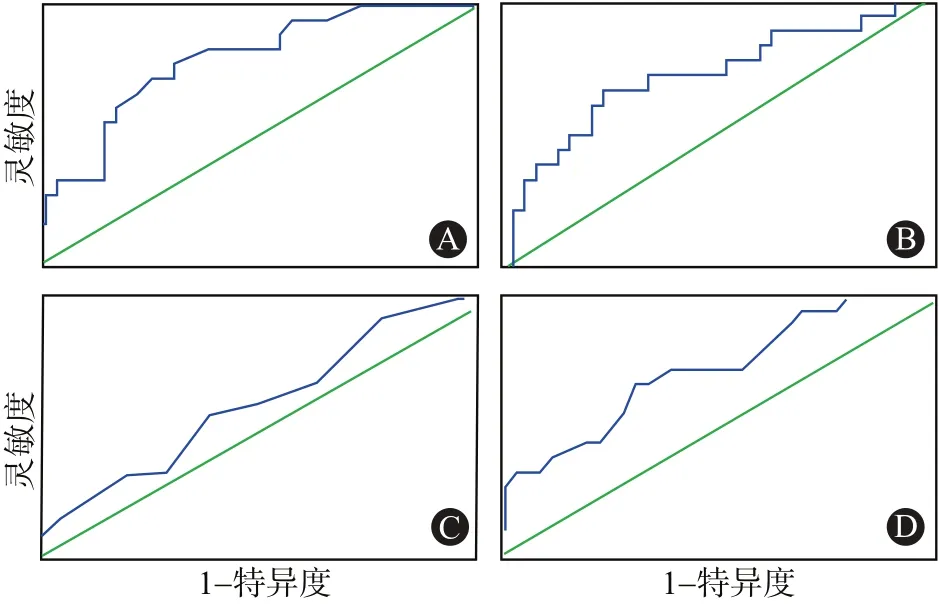
圖1 影響接受擇期腹部手術病人術后ICU住院時間ROC曲線(A為術中液體平衡量預測延時ICU住院的ROC曲線;B為術后液體累積平衡量預測延時ICU住院的ROC曲線;C為術后APACHE-Ⅱ預測延遲ICU住院的ROC曲線;D為術后血乳酸濃度預測延遲ICU住院的ROC曲線)
總之,在所有的獨立影響因素中術中液體正平衡量的ROC曲線下面積最大,曲線最靠近坐標左上角,說明術中液體正平衡量預測術后是否延時ICU住院最可靠。當病人術中液體正平衡量>2 000 mL時術后病死率與其他病人相比明顯升高(18.46%比5.78%,P<0.01)。
2.4 術后結果分析對術后結果分析顯示,當病人術中液體正平衡量>2 000 mL時,術后機械通氣時間[(5.25±3.18)d比(2.62±3.26)d,P<0.001]、術后ICU住院時間[(3.05±2.57)d比(7.05±4.16)d,P<0.001]及術后住院時間[(16.37±4.91)d比(12.85±5.37)d,P<0.001]明顯延長;病人術后心血管并發癥(32.31%比19.83%,P<0.05)、呼吸系統并發癥(31.27%比10.74%,P<0.001)、消化系統并發癥(26.15%比12.40%,P<0.05)及術后局部或全身感染(29.23%比14.05%,P<0.05)發生率也明顯升高;而術后腎功能不全及神經系統并發癥的發生率以及術后24 h尿量在兩組之間均差異無統計學意義,見表5。
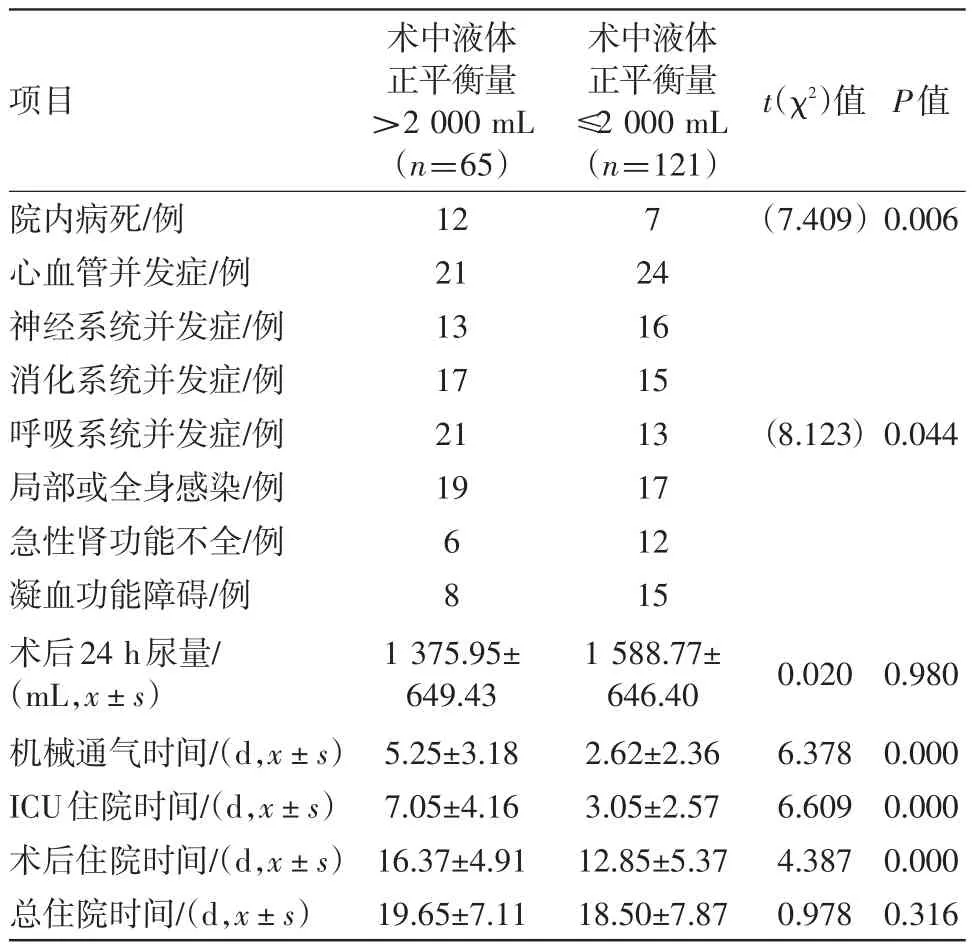
表5 術中液體正平衡過量與非過量對接受擇期腹部手術病人臨床預后的影響
3 討論
本研究表明擇期腹部手術病人術后ICU病死率、住院病死率、術后延時ICU住院、術后并發癥(心血管系統、呼吸系統、消化系統)發生率以及院內局部或全身感染發生率均與圍手術期液體正平衡量明顯相關,而與液體治療的類型無明顯關聯。同時,納入研究的對象均為擇期開放性腹部手術高危病人,術后都需要轉入ICU進一步治療,APACHE-Ⅱ評分為(15.30±2.91),所以該研究的結果對擇期高危手術病人圍手術期液體管理有一定指導意義。
當前,在臨床實踐中對于圍手術期液體治療策略仍存在爭議。在比較了19篇關于圍手術期液體治療的RCT研究后,Kern和Shoemaker[17]指出開放性液體治療策略通過早期優化血流動力學指標能夠明顯改善手術病人臨床預后。
然而,隨著研究的深入,關于圍手術期開放性液體治療帶來的不良后果在臨床實踐中也越來越受到關注[18]。在開放性液體治療中最容易出現的情況就是液體過負荷。而液體過負荷對于呼吸系統影響尤為明顯,可能會引起急性肺水腫,阻礙氣體交換,延長術后機械通氣時間,進而使病人院內肺感染的風險也大大增加。對于消化系統,術中機械性刺激加圍手術期液體過負荷可能會引起腸壁水腫,氧輸送減少,延長胃腸道功能恢復,增加術后腸梗阻、吻合口瘺以及延遲性胃排空的發生[19]。總之,液體過負荷可能會引起組織或間質水腫,阻礙毛細血管血流及淋巴管引流,影響氧氣及代謝產物的運輸,從而加劇器官功能障礙的進程。該效應對于腹腔實質性臟器(肝臟、腎臟)的影響更為顯著,因為這些臟器結構致密,組織水腫會使臟器內壓力驟升而血流量會顯著降低,從而影響臟器功能[20]。有研究指出,如果圍手術期積極液體正平衡使體質量增加5~10%,危重病人發生器官功能障礙以及不良臨床預后的風險也會大大增加。此外,該研究也證實術后24 h液體正平衡量與尿量無正相關,對術后腎功能沒有任何益處[21]。
目前研究表明,圍手術期輸注更多的液體與術后心血管并發癥的發生率也呈正相關。其機制可能在于圍手術期輸液量一旦超過代償范圍,Heart-Starling曲線就無明顯位移,而心臟負荷和耗氧量卻會急劇增加;心肌細胞水腫可能會使心室功能進一步惡化,導致氧供降低和心臟傳導障礙[22],從而使術后心血管并發癥的風險大大增加,這與我們的研究結果相符,對于高危擇期開放腹部手術病人術中液體正平衡量>2 000 mL時,病人術后心血管并發癥發生率(32.31%比19.83%,P<0.05)會明顯升高。
我們的研究結果與Boland等[23]的研究也相似,圍手術期容量過負荷與術后院內病死率、并發癥發生率、延時ICU住院密切相關,但是圍手術期最佳液體治療量、時機及種類仍未明確。為了制定合理的圍手術期液體治療策略,近年來臨床實踐中做了大量關于液體治療的隨機對照試驗。然而,由于缺乏“開放性”和“限制性”的標準定義,每個實驗之間液體治療時采用的標準、結局指標等都不一樣,結果之間也差異較大。這些隨機對照研究為排除臨床混雜因素,納入的大部分研究對象是身體狀況良好、術前ASA評分較低的病人,對于高危手術病人的液體治療研究甚少,因此,我們的研究對于指導高危擇期手術病人圍手術期液體治療有一定的意義。
除了“干”與“濕”在臨床實踐中存在爭論外,液體治療時晶體溶液與膠體溶液的選擇也存在爭議[24]。在我們的研究中沒有對晶體或者膠體的種類進行亞組分析,最終結果顯示延時ICU住院的病人與其他病人相比術中膠體用量[(418.33±346.30)mL比(154.47±217.09)mL,P<0.001]明顯增多,但是進行logistic二項回歸分析顯示術中膠體用量并不是影響病人術后延遲ICU住院的獨立危險因素[OR=0.998,95%CI(0.995~1.008),P=0.411]。由于該研究為回顧性分析,術后病人ICU出院的標準可能存在一定的偏差,所以該結果需要大樣本RCT研究進一步予以驗證;在該研究中所有病人均有圍手術期凝血四項的監測數據,但是液體治療的劑量和種類相互混雜,所以暫不能明確術中膠體對術后凝血指標的影響。
綜上所述,術中液體過負荷會增加病人術后ICU病死率及住院病死率,延長病人術后機械通氣時間、術后ICU住院時間及術后住院時間,增加病人術后并發癥(心血管、呼吸系統、消化系統)發生率,而液體治療的類型對高危手術病人臨床預后無明顯影響,對凝血功能的影響暫不能確定。

