高核苷酸酵母水解物對脂多糖誘導RAW264.7細胞免疫調節的影響
潘聰,李占東,苑鵬,張大力,段盛林,夏凱,周文萱,趙可心,于偉厚
1(吉林農業大學 食品科學與工程學院,吉林 長春,130118) 2(中國食品發酵工業研究院有限公司,北京,100015) 3(大連雙迪科技股份有限公司,大連,116635)4(功能主食創制與慢病營養干預北京市重點實驗室,北京,100015) 5(吉林工程技術師范學院 食品工程學院,吉林 長春,130052)
我國已逐漸步入老齡化社會,伴隨著年齡的增長,人體的基礎代謝和消化能力會逐漸下降,最終導致免疫力下降,睡眠障礙等各種常見的健康問題。營養補充不僅可以為人體提供熱量、蛋白質等多種營養物質,還直接參與機體代謝,是人體免疫功能的物質基礎[1-2]。免疫營養不僅可以防止營養缺乏,還能通過特定方式來刺激免疫細胞,增強機體的免疫應答,通過調控細胞因子的產生和釋放,減輕過度的炎癥反應[3-4]。
炎癥是伴隨很多疾病狀態的一種共有的病理現象,如糖尿病、高血脂等疾病均與炎癥反應有一定的關聯。巨噬細胞是主要的炎癥細胞,當其受到外界抗原(如LPS)刺激時會釋放白介素-6、腫瘤壞死因子-α等一系列炎性細胞因子,從而促進炎癥反應和造成組織損傷[5]。炎癥是機體對感染、組織損傷及傷害性刺激等做出的保護性反應[6]。已發現炎癥反應與核轉錄因子NF-κB、MARK、p38信號傳導及轉錄激活因子STAT-3等信號通路相關,通過炎癥信號通路中的關鍵分子篩選抗炎藥物是研究的重要手段[7]。
酵母水解物(yeast hydrolyzate,YH)也稱復合酵母,是采用純培養食用酵母(Saccharomycescerevisiae)利用內源酶及外源酶水解,充分釋放核酸、小肽等功能成分酶解自溶并經分離提取而獲得的氨基酸、肽、多肽等酵母細胞中的可溶性成分。高核苷酸酵母水解物(high nucleotide yeast hydrolyzate,HNYH)富含核酸、核苷酸(AMP、CMP、GMP、UMP、IMP)、小肽、消化酶、游離氨基酸和豐富的B族維生素及酵母細胞壁[8-9]。核苷酸具有多種生物學活性,在脂類、糖類、能量代謝及蛋白質生物合成中起著重要的作用[10]。據報道,酵母核苷酸具有抗氧化,增強機體免疫力,維持機體胃腸道功能等功能,促進機體損傷修復,降低細胞凋亡,抗炎等功能活性。當經過胃腸道時,小分子肽、氨基酸可直接被吸收。核苷酸作為核酸的組成單位,幾乎參與了體內所有的代謝過程,它是體內許多酶和輔酶的重要組成成分,在細胞物質能量代謝和功能調節中起重要作用[11-14]。
高核苷酸酵母水解物是一種新型、綠色、富含多種功能性成分的食品原料,具有很大的研究價值,因此,本研究通過脂多糖(lipopolysaccharide,LPS)誘導小鼠巨噬細胞系RAW264.7炎癥模型,初步探討了高核苷酸酵母水解物的抗炎作用,提高免疫力的功能活性,為高核苷酸酵母水解物的產品開發利用提供理論基礎。
1 材料與方法
1.1 材料與試劑
高核苷酸酵母水解物,大連珍奧生物技術有限公司提供,蛋白含量61.95%,NaCl 0.2%,總核苷酸含量13.56%,其中AMP 0.049%、CMP 2.17%、GMP 3.39%、UMP 3.54%、IMP 4.42%;小鼠巨噬細胞株(RAW264.7),由中國食品發酵工業研究院保存;DMEM(dulbecco’s modified eagle medium)培養基、磷酸鹽緩沖液(phosphate buffered saline,PBS)、平衡鹽緩沖液(hank’s balanced salt solution,HBSS)、DMEM無糖培養基、胎牛血清(fetal calf serum,FBS),美國Gibco;噻唑蘭(3-[4,5-dimethylthiazol-2-yl]-2,5-diphenylterazolium bromide,MTT),脂多糖(lipopolysaccharides,LPS),美國Sigma化學公司;NO試劑盒、腫瘤壞死因子-α試劑盒、白細胞介素-6試劑盒、白細胞介素-1β試劑盒、細胞核蛋白和漿蛋白抽提試劑盒、山羊抗鼠IgG/HRP二抗、山羊抗兔IgG/HRP二抗、鼠抗β-actin單克隆抗體,碧云天生物技術有限公司;β-actin、iNOS、TNF-α、IL-1β和IL-6引物合成,英濰捷基貿易有限公司;兔抗iNOS單克隆抗體、兔抗NF-κBp65單克隆抗體,Cell Signaling Technology公司;所有有機溶劑均為國產分析純。
1.2 儀器與設備
奧林巴斯CKX41型生物顯微鏡,OLympus公司;CO2培養箱,松下公司;Spectra Max i3酶標儀,MD公司;pH計,上海雷磁儀器廠;GL-20G-Ⅱ型高速冷凍離心機,上海安亭科學儀器廠;凝膠成像儀,北京五洲東方科技發展有限公司;WB顯影儀,上海勤翔科學儀器有限公司;Bio-Rad CFX Maestro RT-PCR儀器,伯樂有限公司。
1.3 實驗方法
稱取高核苷酸酵母水解物溶于超純水中,4 000 r/min,離心10 min取上清,0.22 μm濾膜除菌后待用。
1.3.1 RAW264.7細胞的培養
RAW264.7細胞于含有體積分數10%胎牛血清、100 μL/mL青霉素和100 μL/mL鏈霉素的DMEM培養基中培養(下文簡稱DMEM10),在37 ℃、5% CO2培養條件下常規培養。選取對數生長期細胞進行實驗。對照組,DMEM10正常培養;模型組,DMEM10+LPS(1 μg/mL)共培養;樣品組,DMEM10+LPS(1 μg/mL)+不同質量濃度高核苷酸酵母水解物共培養[15]。
1.3.2 MTT法測定RAW264.7細胞存活率
取對數生長期的RAW264.7細胞接種于96孔板中,每孔接種1×105個細胞。37 ℃培養24 h后棄去培養液,用PBS清洗1次,在培養基中分別加入質量濃度20、40、60、80、100、150、200和250 μg/mL的高核苷酸酵母水解物,以無檢測物的相同培養基孵育細胞為對照,培養24 h后棄去培養液,加入質量濃度0.5 mg/mL MTT-DMEM10于37 ℃避光孵育2 h,小心吸棄培養液,再加入100 μL二甲基亞砜(dimethyl sulfoxide,DMSO),靜置待完全溶解出MTT紫色結晶產物。使用酶標儀在490 nm處測定吸光度值。以對照組細胞的細胞存活率為100 %計算其余組別細胞存活率[16]。
1.3.3 HNYH對RAW264.7細胞吞噬中性紅作用的影響
取對數生長期的RAW264.7細胞接種于96孔板中,每孔接種1×105個細胞,設對照組、模型組、樣品組(高核苷酸酵母水解物質量濃度為20、40、60、80、100、150 μg/mL)培養24 h,每孔加入100 μL 0.075%中性紅生理鹽水溶液,培養1 h,棄去上清,用無血清的RPMI-1640洗滌2次,向各孔加入100 μL細胞溶解液(0.1 mol/L冰醋酸與無水乙醇1∶1等體積混合),室溫靜置過夜,待細胞全部溶解后,570 nm測吸光值[17]。
1.3.4 HNYH對RAW264.7細胞釋放NO能力的影響
RAW264.7細胞按照1.3.3分組和處理方法,處理24 h后,吸取50 μL上清液于96孔板中,依次加入NO試劑盒中試劑A,B 2種反應液各50 μL,于540 nm處測OD值。
1.3.5 HNYH對RAW264.7細胞釋放炎癥因子的影響
將對數生長期的巨噬細胞按每孔濃度為1×105個細胞數接種于96孔板中,設對照組、模型組,樣品組(高核苷酸酵母水解物質量濃度為10、50、100、150 μg/mL),且每組3個復孔,放置于細胞培養箱培養,24 h后采用碧云天試劑盒分別測定細胞IL-6,IL-1β和TNF-α的釋放量[18]。
1.3.6 HNYH對LPS刺激RAW264.7細胞iNOS,TNF-α,IL-1β和IL-6mRNA的影響
RAW264.7細胞懸液接種6孔板,細胞數為1×106個/mL,每孔2 mL,分別設正常組、模型組、樣品組(高核苷酸酵母水解物濃度為10、50、100、150 μg/mL),細胞培養24 h后,收集各組巨噬細胞,按照全式金試劑盒說明書提取細胞總RNA,用紫外分光光度計對RNA進行定量分析,測定RNA純度及濃度。PCR反應條件為45 ℃ 5 min;94 ℃ 30 s,94 ℃ 5 s,60 ℃ 1 min,循環40次;PCR擴增完畢后,瓊脂糖凝膠電泳檢測mRNA表達情況,Bio-Rad公司圖像分析成像儀進行半定量分析。引物序列及產物大小見表1[5]。

表1 實驗用各目標基因特異性引物序列
1.3.7 Western blot檢測NF-κB及iNOS蛋白的表達
RAW264.7細胞按照1.3.6分組和處理方法,常規培養24 h后,收集各組細胞,置于冰上,使用細胞核蛋白抽提試劑盒提取核蛋白,檢測細胞核內NF-κBp65蛋白表達情況,Bradford法測定蛋白濃度。每孔上樣30 μg蛋白,10% SDS-PAGE分離樣品,轉膜,5%脫脂奶粉封閉2 h,將膜置于1∶1 000稀釋的一抗稀釋液中,4 ℃過夜,TBST洗膜3次,將膜浸入以1∶1 000稀釋的二抗稀釋液中,室溫搖床孵育1 h,TBST洗膜3次。ECL顯色液顯色,曝光,利用Image J軟件進行灰度值分析。
1.3.8 統計學處理

2 結果與分析
2.1 HNYH對RAW264.7細胞活力的影響
由表2可知,高核苷酸酵母水解物在質量濃度20~150 μg/mL處理細胞的存活率都在95%左右,觀察到細胞形態良好,沒有顯著差異,未觀察到細胞毒性作用。質量濃度在200 μg/mL以上時高核苷酸酵母水解物對RAW264.7細胞生長有明顯的抑制作用,所以在后續的實驗中選擇150 μg/mL為最大質量濃度。

表2 不同質量濃度高核苷酸酵母水解物對RAW264.7細胞活力的影響

2.2 HNYH對巨噬細胞吞噬能力的影響
吞噬作用是巨噬細胞發揮其免疫功能的重要方式之一,由圖1可以看出,與對照組相比,模型組的細胞吞噬能力顯著升高,與模型組相比,樣品組質量濃度在100~150 μg/mL時,能明顯地增強RAW264.7細胞的吞噬能力(P<0.05)。說明高核苷酸酵母水解物能夠提高巨噬細胞的免疫活性[19]。


圖1 HNYH對RAW264.7細胞吞噬中性紅的影響
2.3 HNYH對LPS誘導的RAW264.7細胞NO生成量的影響
在體內,NO是通過一氧化氮合酶(NOS)催化L-精氨酸(L-Arg)產生的。iNOS主要是在炎癥和免疫刺激下表達,進而催化NO持續生成,過多的NO則會促使炎癥性疾病的發生和發展[5]。將1 μg/mL LPS作用于巨噬細胞RAW264.7后24 h,如圖2所示,產生的NO量顯著高于正常對照組,差異具有統計學意義(P<0.05),在一定濃度范圍內,高核苷酸酵母水解物作用巨噬細胞后,NO的生成量隨高核苷酸酵母水解物濃度的增加而降低,NO標準曲線,線性回歸方程為:y=0.014 9x+0.019 8,R2=0.998 7。

圖2 HNYH對LPS誘導的RAW264.7細胞內NO含量的影響
Fig.2 Effects of HNYH on the content of NO in LPS- induced RAW264.7 cells
2.4 HNYH對LPS誘導RAW264.7細胞炎癥因子IL-1β、IL-6和TNF-α分泌的影響
結果如圖3、圖4和圖5所示。
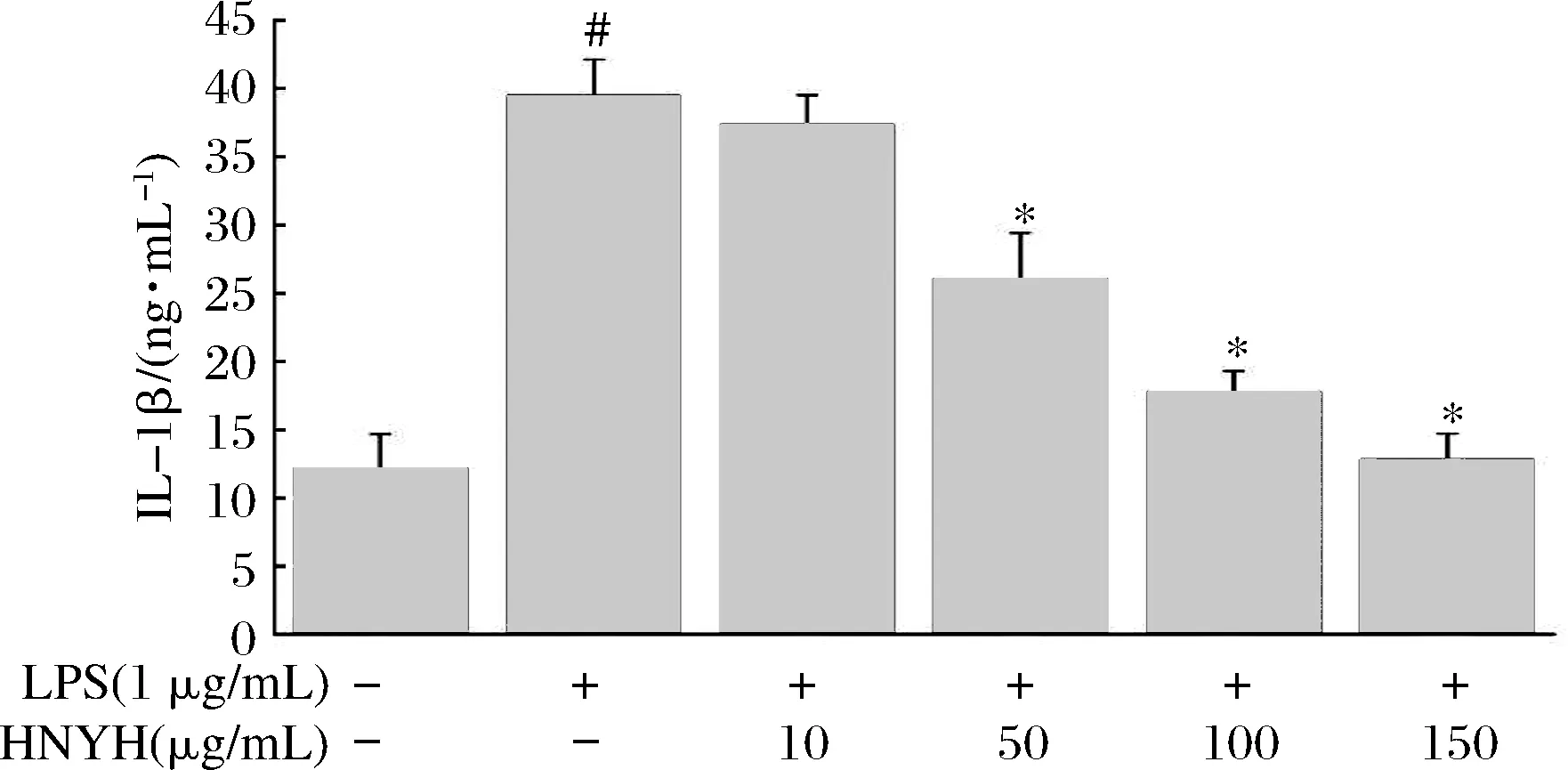
圖3 HNYH對LPS誘導RAW264.7 細胞IL-1β的影響
Fig.3 Effects of HNYH on the content of IL-1β in LPS-induced RAW264.7 cells
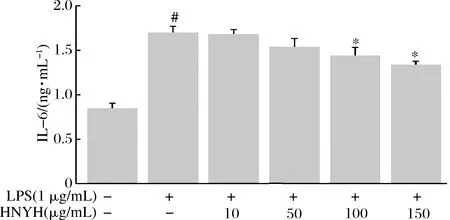
圖4 HNYH對LPS誘導RAW264.7 細胞IL-6的影響
Fig.4 Effects of HNYH on the content of IL-6 in LPS-induced RAW264.7 cells

圖5 HNYH對LPS誘導RAW264.7 細胞TNF-α的影響
Fig.5 Effects of HNYH on the content of TNF-α in LPS-induced RAW264.7 cells
正常組細胞上清液中IL-1β、IL-6、TNF-α分泌較少,給予1 μg/mL LPS刺激24 h后,IL-1β、IL-6和TNF-α分泌均顯著增加(P<0.05),與模型組相比,高核苷酸酵母水解物組中IL-1β、IL-6和TNF-α的分泌則受到明顯抑制(P<0.05),并呈現一定的劑量依賴關系。根據實驗結果推測HNYH通過調節多種炎癥因子的分泌來緩解LPS誘導的RAW264.7細胞炎癥。
2.5 HNYH對LPS誘導的RAW264.7細胞iNOS、IL-6、IL-1β和TNF-α mRNA表達的影響
RT-PCR實驗結果分析如圖6顯示,與對照組相比,模型組的iNOS、IL-6、IL-1β和TNF-α mRNA均顯著升高(P<0.05),與模型組相比,不同質量濃度的高核苷酸酵母水解物組能夠顯著降低iNOS、IL-6、IL-1β、TNF-α mRNA表達。

圖6 HNYH對LPS刺激RAW264.7細胞iNOS,TNF-α,IL-6,IL-1β mRNA的影響
Fig.6 The effect of iNOS,TNF-α,IL-6 and IL-1β mRNA expressionafter the intervention of total saponins of Panax japonicus on RAW264.7 cells stimulated by LPS
2.6 HNYH對LPS誘導的RAW264.7細胞iNOS和細胞核轉錄因子NF-κB p65蛋白表達的影響
蛋白免疫印跡實驗(Western Blot)結果如圖7所示,模型組細胞核內NF-κBp65蛋白的表達明顯高于對照組(P<0.05);HNYH各組劑量依賴性地抑制由LPS所誘導的NF-κBp65蛋白的表達,與模型組比較,存在顯著性差異(P<0.05)。

圖7 HNYH對LPS刺激RAW264.7細胞NF-κBp65的影響
Fig.7 Effect of HNYH on NF-κBp65 stimulated by LPS in RAW264.7 cells
Western Blot檢測結果如圖8所示,對照組中,iNOS蛋白表達較低,而經LPS刺激后,RAW264.7細胞分泌的iNOS蛋白表達顯著上調(P<0.05)。

圖8 HNYH對LPS刺激RAW264.7細胞iNOS蛋白的影響
Fig.8 Effect of HNYH on iNOS stimulated by LPS in RAW264.7 cells
與模型組比較,高核苷酸酵母水解物(150、100、50、10 μg/L)呈濃度依賴性下調iNOS蛋白表達(P<0.05),從而抑制了NO的生成,來減輕炎癥反應。說明了HNYH組通過降低RAW264.7細胞中iNOS蛋白表達,從而減少NO炎癥介質的產生。
3 討論
炎癥是伴隨各種疾病的一種常見病理現象,巨噬細胞是主要的炎性細胞,同時也是免疫反應的效應細胞,在機體免疫系統中起著重要的作用。研究發現,LPS作為一種炎癥誘導劑可以通過與細胞膜表面受體TLR4的結合,來激活絲裂原活化蛋白激酶(MAPK)和NF-κB信號通路,介導單核巨噬細胞的激活,誘導多種細胞因子如NO、IL-1β、IL-6、TNF-α等的合成和釋放[20-22]。
體內NO是由一氧化氮合酶(iNOS)催化L-精氨酸(L-Arg)產生[5]。一氧化氮合酶是NO合成所必須的酶,分為原生型一氧化氮合酶(cNOS)和誘導型一氧化氮合酶(iNOS)[23],iNOS主要是在炎癥和免疫刺激下表達,進而催化NO持續生成,過量的NO則會促進炎癥性疾病的發生和發展[24-25]。因此,抑制NO的釋放或iNOS表達可能是緩解炎癥反應的重要靶點[26-27]。NO合成酶iNOS的表達直接決定NO分泌量,是檢測炎癥重要指標。目前,調節誘導型合成酶iNOS的表達和NO的合成被認為是治療炎癥疾病的重要途徑。NO及iNOS mRNA表達水平的降低與中和炎癥反應密切相關,iNOS是介導炎癥分子機制中一個重要分子機制[7]。LPS誘導的iNOS的表達受NF-κB調控。NF-κB受刺激因子誘導激活從細胞質轉移至核內,誘導多種基因的表達和多種細胞因子的釋放。
在炎癥反應的各階段,NF-κB作為核轉錄因子起著重要的調控作用,其主要的誘導型亞基是p60/p65[28]。靜息狀態時,NF-κB和IκB形成的復合體存在于細胞質中。在通過LPS刺激后,IκB被活化的激酶復合體(IκBkinase,IKK)磷酸化,NF-κB與IκB解離,游離的NF-κBp65迅速轉移到細胞核并與κB結合位點結合,從而啟動炎性介質及促炎癥細胞因子的轉錄與表達[29-31]。
綜上所述,通過LPS誘導的RAW264.7細胞體外細胞炎癥模型中,模型組的炎癥因子iNOS、TNF-α、IL-6和IL-1β表達明顯上升,核NF-κB p65 和iNOS蛋白表達明顯上調,說明NO、TNF-α、IL-6和IL-1β釋放,NF-κB信號通路被激活,證明細胞炎癥模型構建成功,與模型組相比高核苷酸酵母水解物組中NO、IL-1β、IL-6和TNF-α的分泌則受到明顯抑制,并呈現一定的劑量依賴關系。高質量濃度HNYH能顯著抑制NO、IL-1β、IL-6、TNF-α的釋放,然后又采用RT-PCR法檢測細胞中iNOS、TNF-α、IL-6和IL-1β mRNA表達,各劑量組(10、50、100、150、μg/mL)均能抑制iNOS、TNF-α、IL-6和IL-1β mRNA表達。可知HNYH通過調控炎癥因子基因的表達進而抑制炎癥因子的過度釋放,起到抗炎作用。
Western Blot檢測證實了HNYH能夠調控激活RAW264.7細胞核因子NF-κB通路,通過抑制iNOS表達,進一步抑制NO和炎性因子TNF-α、IL-1β和IL-6的產生,降低iNOS、TNF-α、IL-6和IL-1β mRNA表達,具體作用機制仍需進一步深入研究。炎癥反應和慢性病總是有著密不可分的聯系,HNYH作為一種天然的具有抗氧化、增強免疫力等功能性營養食品添加劑,本研究可能為食療干預慢性病提供一定的基礎理論依據。

