乳酸脫氫酶與葡萄糖脫氫酶偶聯催化合成D-苯基乳酸
羅希,楊澤鋒,臧瑜,李寧,王鑫情,付永前
(臺州學院 生物質資源研究所,浙江 臺州,318000)
D-苯基乳酸(D-phenyllactic acid,D-PLA),是一種由乳酸菌等微生物產生的天然抑菌物質,安全無毒,具有抗菌譜廣、水溶性好、穩定性高、有效pH范圍寬等特點,在食品工業中有著廣闊的應用前景[1-4]。D-PLA用于化妝品中,不僅能有效防止微生物污染引起的感染,而且具有去皺、亮膚的功效[5]。D-PLA可作為動物飼料添加劑取代抗生素,減少家畜大腸內大腸桿菌的數量,提高家畜體內免疫相關類血細胞的數量,促進個體生長[6-7]。D-PLA可作為單體生產高分子聚合物聚苯乳酸,具有高水平的紫外吸收特性[8-9]。除此之外,D-PLA是丹參素衍生物,臨床上可治療冠心病[10-11],也可作為化學原料合成非蛋白氨基酸、抗HIV試劑和降血糖劑等[12-13]。D-PLA在食品、化妝品、農業、醫藥、化學工業等領域廣泛應用且具有巨大的市場需求。
乳酸脫氫酶(lactate dehydrogenase, LDH)是D-PLA酶法合成的關鍵酶,可催化苯丙酮酸鈉(sodium phenylpyruvate, PPA)還原生成D-PLA。大腸桿菌(E.coli) BL21是外源蛋白表達通用宿主,易于操作和控制,近年來多株LDH重組大腸桿菌被構建,以PPA為底物不對稱還原合成D-PLA,但LDH基因來源較少,主要集中在乳桿菌屬[14-16]Wickerhamiafluorescens[17],Pediococcusacidilactici[18],Pediococcuspentosaceus[19]等少數微生物菌種。ZHU等對LactobacilluspentosusD-乳酸脫氫酶進行定點突變,以E.colipET28a-ldhY52V為催化劑在水-正辛烷兩相介質中催化合成D-PLA,時空產率達到310.08 g/(L·d),為目前已知的最高生產強度[20]。除對已有LDH進行分子改造提高催化效率外,新酶的發現也是生物催化領域的重要課題。LDH屬于氧化還原酶家族,其催化活性依賴于煙酰胺輔酶[nicotinamide adenine nucleotide (phosphate), NAD(P)H],輔酶將氫和電子傳遞給底物羰基,使底物還原[21]。而煙酰胺類輔酶價格昂貴,穩定性低,難以重復利用,增加了反應成本,極大地制約了乳酸脫氫酶的工業化應用。因此,煙酰胺輔酶的再生效率在工業生物催化中起著至關重要的作用[22-23]。為了克服輔酶的供應問題,葡萄糖脫氫酶(glucose dehydrogenase, GDH)常被用于輔酶的再生[24-26]。本實驗挖掘了1株新型LDH,與GDH偶聯,在實現輔酶再生的同時催化合成D-PLA(圖1)。

圖1 雙酶耦聯不對稱還原PPA合成D-PLA
Fig.1 Asymmetric reduction of PPA to D-PLA bycoupled LDH and GDH
1 材料與方法
1.1 材料與試劑
TaqDNA聚合酶、PfuDNA聚合酶、限制性內切酶、T4 DNA連接酶:Takara;胰蛋白胨和酵母粉:Oxoid;DNA膠回收試劑盒、質粒小量提取試劑盒、PCR產物清潔試劑盒、基因組提取試劑盒、限制性內切酶、苯丙酮酸鈉、D-苯基乳酸、輔酶NADH和pUCm-T質粒:生工生物科技有限公司;菌種Lactobacillusrossiae、E.coliBL21 (DE3)、E.coliBL21 (DE3)/pET-28a-esgdh、質粒pET28a(+):本實驗室保藏;色譜純乙腈、甲醇、甲酸、三氟乙酸:百靈威科技有限公司;其他化學試劑均為市售分析純。
1.2 儀器與設備
CHA-SA氣浴恒溫振蕩器,上海江星;LC-20A高效液相色譜儀,島津;HICO21小型高速離心機,上海生工;Avanti J-E高速冷凍離心機,Beckman;BPMJ-70F恒溫培養箱,上海一恒。
1.3 乳酸脫氫酶基因克隆
根據Lactobacillusrossiae乳酸脫氫酶(LDH,GenBank: AZFF01000004.1)核苷酸序列設計引物(LDH-F: CCATGGGCATGGAGGTGTCTGCATTGA; LDH-R: CTCGAGCTAGTTAAAGGCCACAACA T)。以L.rossiae基因組DNA為模板進行PCR,克隆基因片段。PCR反應體系(總體積100 μL):10×PfuDNA Polymerase Buffer 10 μL(Mg2+),引物LDH-F和LDH-R各1 μL (50 μmol/L),dNTP mixture 1 μL(10 mmol/L),基因組DNA 1 μL,PfuDNA Polymerase 1 μL,去離子水85 μL。PCR程序為:94 ℃預變性5 min,經過35個循環(94 ℃ 0.5 min,56 ℃ 0.5 min,72 ℃ 1.5 min),72 ℃延伸 10 min,4 ℃保溫。瓊脂糖凝膠電泳,檢測是否獲得目的條帶并膠回收目的基因。
1.4 乳酸脫氫酶重組基因工程菌的構建
目的基因與pUCm-T質粒連接,構建的重組T質粒和pET28a(+)質粒用相同的限制性內切酶(NcoI/XhoI)切割,產生的黏性末端用T4 DNA連接酶連接,構建重組表達質粒pET28a-ldh,轉化BL21(DE3)大腸桿菌感受態,構建重組菌E.coliBL21 (DE3)/pET28a-ldh。將乳酸脫氫酶重組菌接種至含30 μg/mL卡那霉素的LB液體培養基中,37 ℃、180 r/min培養至發酵液OD600值為0.8,加入終質量濃度為5 g/L的乳糖,28 ℃,150 r/min誘導12 h,離心收集菌體,磷酸緩沖液(100 mmol/L,pH 7.0)懸浮,超聲破碎并冷凍離心,取上清,SDS-PAGE凝膠電泳分析。
1.5 乳酸脫氫酶重組菌誘導表達條件優化
接種E.coli/pET28a-ldh至含有30 μg/mL卡那霉素的LB液體培養基,37 ℃培養10 h,再以體積分數4%接種到含有30 μg/mL卡那霉素的LB液體培養基中,37 ℃培養至菌液OD600值為0.8,加入乳糖,在28 ℃,150 r/min下誘導,分別對誘導劑乳糖的質量濃度2、4、6、8、10、12 g/L和誘導時間2、4、6、8、10 h進行優化。離心收集菌體、測生物量,計算比酶活。
生物量測定:取1.0 mL發酵液,離心收集菌體,并用生理鹽水洗滌2次后,置于80 ℃烘箱中干燥至恒重并稱量。
重組乳酸脫氫酶活力測定:誘導表達后的菌體細胞用磷酸緩沖液(100 mmol/L,pH 7.0)懸浮,菌體質量濃度以干菌體計為20 g/L,超聲破碎并離心,取上清作為粗酶液。酶活檢測體系由上述粗酶液、0.5 mmol/L NADH和0.5 mmol/L苯丙酮酸鈉構成,總體積為200 μL,置于30 ℃、150 r/min下反應10 min,液相測定苯基乳酸含量,并計算比酶活。
酶活單位(U)定義為:在30 ℃、pH值7.0條件下,1 min還原生成1 μmolD- PLA所需要的酶量定義為1 U。比酶活定義:1 g干菌體所具有的活力單位數。
1.6 乳酸脫氫酶/葡萄糖脫氫酶偶聯催化體系的構建與反應條件的優化
E.coli/pET28a-ldh和E.coli(DE3)/pET28a-esgdh兩菌種分別在優化后的條件下進行誘導培養,收集的菌體按一定干重比混合后,用100 mmol/L磷酸緩沖液懸浮,菌體總質量濃度以干菌體計,為20 g/L,超聲破碎。取破碎液10 mL加入10 g/L PPA和一定濃度葡萄糖,在200 r/min下反應30 min。分別對催化反應pH(6.0、6.5、7.0、7.5、8.0),溫度(27、30、35、40、45 ℃),LDH和葡萄糖脫氫酶重組菌質量比(1、2、3、4、5),葡萄糖與PPA摩爾濃度之比(0.5、1、1.5、2、3、4、5)進行優化。反應生成PLA濃度和對映體過量值(enantiomeric excess,ee)用高效液相色譜檢測。
1.7 雙酶耦聯催化反應時間進程
取上述混合破碎液50 mL,分別加入10、20、30 g/L PPA及2倍摩爾濃度的葡萄糖至100 mL圓底燒瓶中。在30 ℃、磁力攪拌轉速為300 r/min下反應,流加1 mol/L Na2CO3溶液使反應液pH維持在7.0。每20 min取樣,液相檢測PLA濃度和ee。
1.8 液相檢測方法
PLA的濃度采用Hypersil ODS C18分析柱(250 mm×4.6 mm, 5 μm)檢測,流動相為V(乙腈)∶V(0.1%甲酸水溶液)=1∶ 4,流速1.0 mL/min,進樣量20 μL,檢測波長210 nm,柱溫40 ℃。
ee采用Chiralcel OJ-RH分析柱(4.6 mm×150 mm, 5 μm)檢測,流動相為V(乙腈)∶V(甲醇)∶V(三氟乙酸)∶V(水)=50∶50∶1.5∶898.5,流速0.6 mL/min,進樣量20 μL,檢測波長210 nm,柱溫40 ℃。
1.9 ee計算方法

(1)
式中:ρD和ρL分別為D-PLA和L-PLA的質量濃度。
2 結果與分析
2.1 乳酸脫氫酶重組工程菌的構建
PCR擴增產物進行瓊脂糖凝膠電泳,在約1 000 bp處顯示了明亮條帶(圖2-a),與目標基因長度(1 014 bp)一致。將擴增獲得的基因片段插入pET-28a(+),構建重組表達載體pET-28a-ldh轉化大腸桿菌BL21 (DE3)感受態細胞,經測序確認,成功構建了重組大腸桿菌E.coli/pET28a-ldh。對誘導后的LDH重組菌破碎上清進行SDS-PAGE凝膠電泳,以無重組載體的E.coliBL21 (DE3)作空白對照,如圖2-b所示,獲得約40 kDa條帶,與LDH預測大小一致(37.8 kDa),表明LDH重組菌成功表達。

圖2 PCR產物瓊脂糖凝膠電泳(a);SDS-PAGE凝膠電泳(b)
Fig.2 Agarose gel electrophoresis analysis of PCR products(a);SDS-PAGE analysis of the soluble fractions of induced E. coli BL21 (DE3) and E. coli/pET28a-ldh(b)
2.2 乳酸脫氫酶重組菌表達條件優化
分別對誘導劑乳糖的用量和誘導時間做了優化實驗。選擇乳糖質量濃度為2~12 g/L,分別在28 ℃誘導2 h。如圖3所示,隨著乳糖質量濃度的升高,LDH可溶性蛋白表達量隨之升高,菌體比酶活在乳糖質量濃度為8 g/L時最大,達到138.2 U/g干菌體,同時獲得的生物量也較高為2.65 g/L(每1 L發酵液中含有的干菌體質量),繼續升高乳糖濃度,生物量緩慢增長,但LDH可溶性表達量減少,導致重組菌比酶活下降。因此,選取8 g/L乳糖作為最佳誘導劑質量濃度。

M-Marker; 1~6-E. coli/pET28a-ldh于28 ℃分別在2、4、6、8、10、12 g/L 乳糖下誘導2 h圖3 誘導劑乳糖濃度優化
Fig.3 Optimization of lactose concentration
添加8 g/L乳糖,在28 ℃下分別誘導2~10 h。如圖4所示。
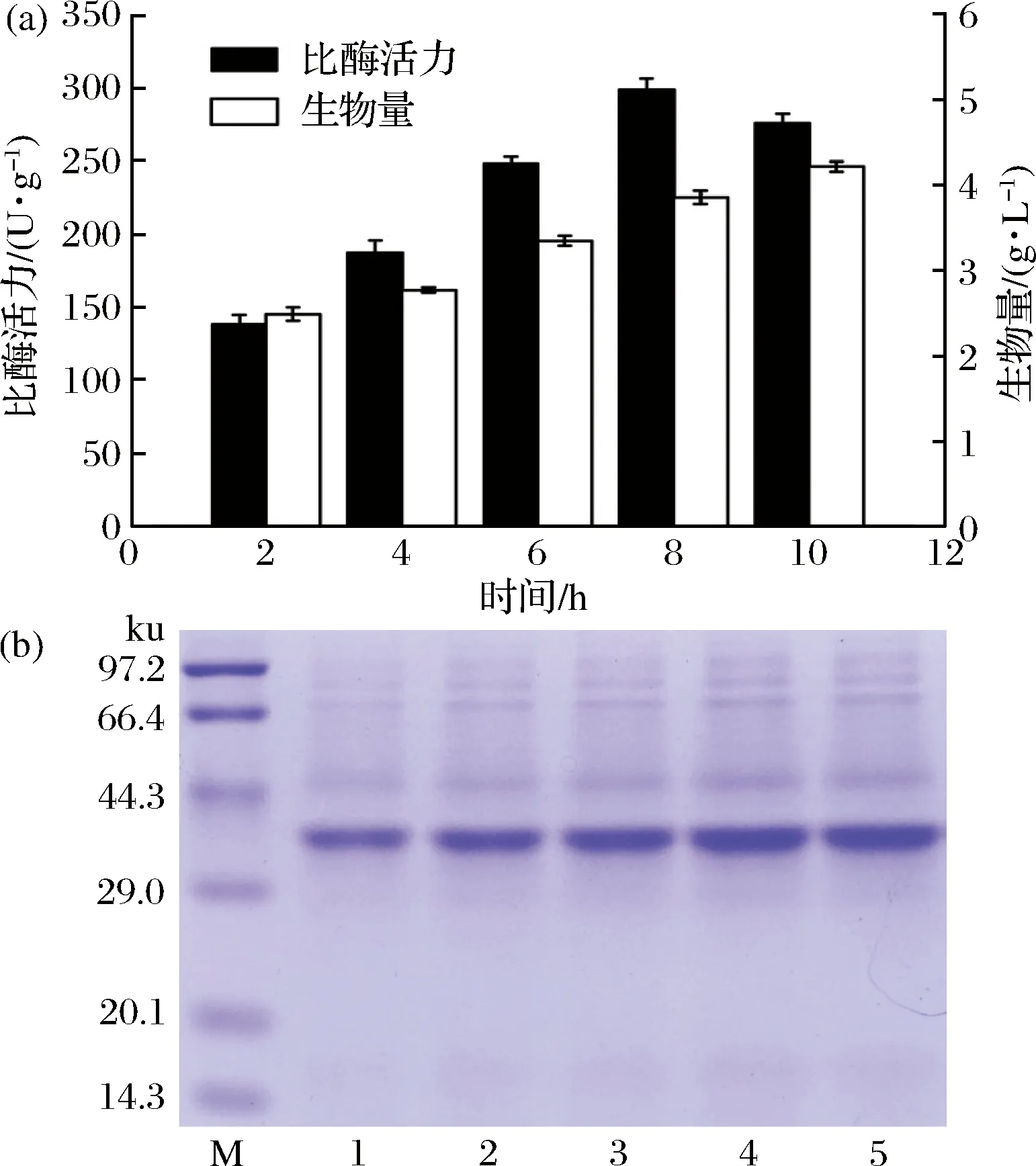
M-Marker;1~5-添加8 g/L乳糖分別誘導E. coli/pET28a-ldh 2、4、6、8、10 h圖4 誘導時間優化
Fig.4 Optimization of induction time
隨著誘導時間的延長,重組菌生物量和LDH可溶性表達量增加,重組菌比酶活提高,到8 h時達到最大值298.8 U/g干菌體,誘導10 h時,雖然生物量繼續增加,但LDH可溶性表達量開始減少,重組菌比酶活隨之降低。綜上所述,在8 g/L乳糖質量濃度下誘導8 h為最佳誘導條件。
2.3 LDH/GDH偶聯催化體系的構建與催化條件優化
乳酸脫氫酶催化的還原反應需要煙酰胺輔酶作為載體傳遞H+和電子,而煙酰胺輔酶價格昂貴,直接大批量添加將極大增加生產成本,因此,采用合適的方法進行輔酶再生是還原反應順利進行的保障。將葡萄糖脫氫酶與主催化反應氧化還原酶偶聯是實現輔酶高效循環的常用方法。適宜的酶組合和合適的催化條件,能夠使主催化反應與輔酶再生副反應平衡,提高酶催化反應的經濟性,確保還原反應的連續性。
本實驗將LDH重組菌和GDH重組菌混合破碎,以葡萄糖作為氫供體構建了雙酶耦聯催化體系,并對催化條件進行了優化。
2.3.1 pH值對還原反應的影響
pH的變化能夠引起酶分子構象的變化及酶和底物的解離狀態,進而影響酶與底物的結合,使酶促反應速率發生變化。本實驗控制LDH與GDH重組菌細胞質量比為1∶1,以100 mmol/L不同pH值的磷酸緩沖液懸浮并破碎,加入10 g/L PPA和葡萄糖,于30 ℃下反應,研究pH值對還原反應的影響,結果如圖5-a所示。在酸性至中性范圍內,產物PLA累積濃度隨pH的升高而迅速增大,至pH值為7.0時最大,達到3.86 g/L。當反應液pH值處于堿性環境時,PLA累積濃度急劇下降。在所研究的pH范圍內,產物ee值未發生明顯變化,維持在99.9%以上。在后續實驗中,維持反應液pH為7.0進行催化反應。
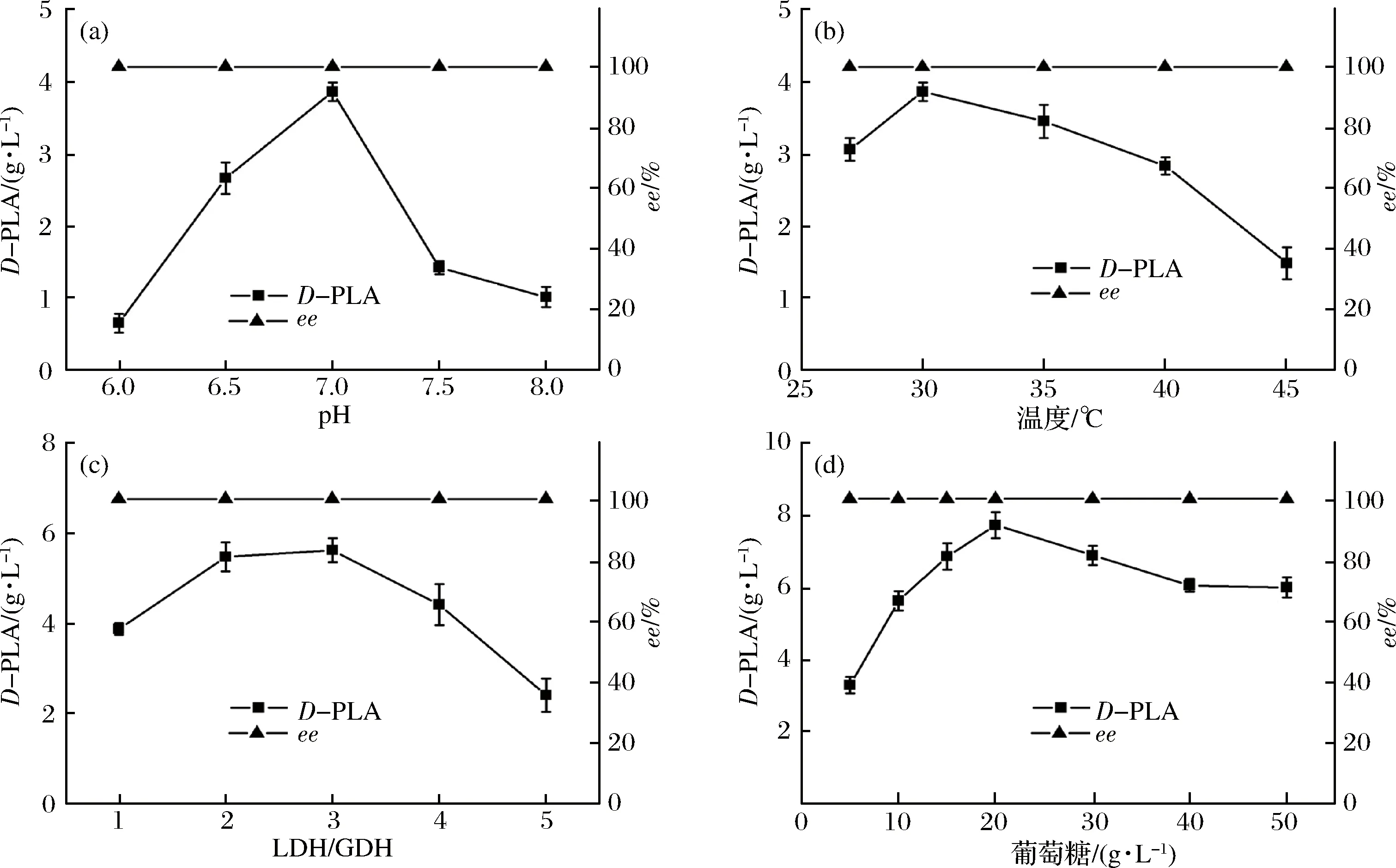
圖5 催化條件優化
Fig.5 Optimization of catalytic conditions
2.3.2 溫度對還原反應的影響
在一定范圍內,溫度的升高有助于酶分子與底物分子的有效碰撞,從而使酶促反應速率加快;而另一方面,隨著溫度的升高,酶分子變性加劇,活性酶分子減少,反應速率降低。酶促反應最適溫度是這兩方面因素平衡的結果。本實驗控制LDH與GDH重組菌細胞質量比為1∶1,以100 mmol/L pH值7.0的磷酸緩沖液懸浮并破碎,加入質量濃度為10 g/L PPA和葡萄糖,在25~45 ℃范圍內測定了D-PLA的產生量,結果如圖5-b所示。在30 ℃時PLA累積濃度最高,達到3.86 g/L,溫度升高使產物濃度降低,至45 ℃時,反應液由澄清透明逐漸變渾濁,有白色黏稠固體產生,酶變性失活加劇,產物累積質量濃度僅為1.48 g/L。在所研究的溫度范圍內,產物ee值未發生明顯變化,維持在99.9%以上。30 ℃為雙酶偶聯反應體系的最適催化溫度。
2.3.3 LDH與GDH重組菌細胞質量比對還原反應的影響
本實驗控制反應溫度為30 ℃,pH為7.0,PPA和葡萄糖濃度均為10 g/L,固定總菌體用量為20 g/L(以干菌體計),研究LDH與GDH重組菌細胞質量比對還原反應的影響,結果如圖5-c所示。LDH/GDH值從1增加到3時,雖然GDH占比下降,但仍能為PPA的還原反應提供充足的還原型輔酶,LDH濃度增加使D-PLA產生速率加快,當LDH/GDH值為3時,D-PLA累積質量濃度達到最大值為5.61 g/L。繼續提高質量比,GDH濃度降低,輔酶再生速率下降,LDH累積濃度降低。手性液相色譜分析可知(圖6),D-PLA和L-PLA的保留時間分別約為25.9 min和28.5 min。在所研究的范圍內,LDH與GDH重組菌細胞質量比對產物ee值基本無影響,始終維持在99.9%以上(圖6-d)。因此,確定LDH與GDH質量比為3∶1進行后續實驗。

a-0.05 g/L D-PLA;b-0.05 g/L L-PLA;c-0.025 g/L D,L-PLA, d-D, L-PLA和催化樣品圖6 手性液相色譜圖
Fig.6 Chromatogram of chiral HPLC
2.3.4 葡萄糖質量濃度對還原反應的影響
葡萄糖被GDH氧化,生成H+被煙酰胺輔酶攜帶,傳遞給PPA并使PPA還原生成D-PLA。本實驗控制反應溫度為30 ℃,pH為7.0,LDH與GDH重組菌細胞質量比為3∶1,PPA質量濃度為10 g/L,對葡萄糖質量濃度做了優化,結果如圖5-d所示。葡萄糖質量濃度從5 g/L增加到20 g/L,D-PLA累積濃度逐步提高,至20 g/L時達到最大值7.87 g/L,在這一范圍內,葡萄糖質量濃度的增加使GDH的活性提高,增加了H+的供應,從而促進了PPA的還原。繼續增加葡萄糖質量濃度,D-PLA累積濃度下降,高質量濃度的葡萄糖可能抑制了GDH的活性,同時增加了反應液的黏度,增大了傳質阻力。在所研究的葡萄糖濃度范圍內,產物ee值未發生明顯變化,維持在99.9%以上。因此,確定最佳葡萄糖質量濃度為20 g/L,在后續實驗中采用2倍PPA質量濃度的葡萄糖進行催化反應。
2.4 LDH/GDH雙酶耦聯催化反應時間進程
在上述最優條件下,考察了不同底物濃度下雙酶偶聯催化反應的時間進程,結果如圖7所示。
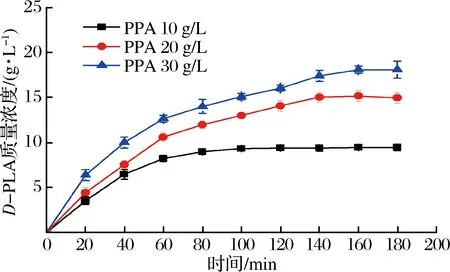
圖7 不同初始底物質量濃度下的催化反應時間進程
Fig.7 Time course of asymmetric reduction
當底物質量濃度為10 g/L時,經過100 min反應基本結束,產物累積質量濃度為9.32 g/L,ee值大于99%,得率為93.2%。增加底物質量濃度,反應初速率加快,但隨著產物的積累,反應速率逐漸降低,當底物質量濃度為20 g/L時,反應在140 min時基本結束,PLA累積質量濃度為15.03 g/L,ee值大于99%,得率為75.15%。當初始底物增加到30 g/L時,D-PLA最終累積質量濃度為18.09 g/L,ee值大于99%,時空產率為162.27 g/(L·d),得率降低為60.30%,表明產物質量濃度的提高抑制了還原反應的繼續進行。
3 結論
本研究從Lactobacillusrossiae基因組DNA中克隆到一條編碼LDH的基因,構建了E.coliBL21 (DE3)/pET28a-ldh重組菌并成功表達,通過一系列實驗對LDH重組菌的表達條件進行了優化。構建了LDH/GDH雙酶耦聯催化體系,在實現輔酶再生的同時,促進了PPA不對稱還原生成光學純D-PLA,對催化反應條件進行了優化,D-PLA最終累積質量濃度達到18.03 g/L,時空產率為162.27 g/(L·d),顯示了較好的工業化應用前景。
本實驗雖取得了一定的進展,但反應過程中產物的積累對PPA還原反應產生了明顯的抑制,阻礙了D-PLA得率和累積質量濃度的進一步提升。篩選合適的有機溶劑,構建雙水相反應介質能有效解除產物抑制并提升底物的溶解度,有效提高反應轉化率。此外,無細胞破碎液作為催化劑參與反應,使后續的產品分離純化過程變得困難,將LDH和GDH基因導入同一宿主細胞,構建共表達基因工程菌可簡化分離純化工藝。本實驗室已開展相關工作,期望進一步提升D-PLA生產強度。

