利用響應面法優化發酵乳桿菌AR497電轉化條件
韋云瑩,趙燕,莊金偉,李江,帕米拉·乃則木丁,陸祎晟,艾連中,熊智強
(上海理工大學 醫療器械與食品學院,上海食品微生物工程研究中心,上海,200093)
發酵乳桿菌(Lactobacillusfermentum)是一種異型發酵乳酸菌,在發酵食品的制作和功效方面具有特殊作用,還具有眾多益生功能[1-3]。目前對發酵乳桿菌益生作用研究主要集中在胃腸道的耐受性、抗菌活性、降膽固醇、增強免疫活性[4-5]、抗氧化、緩解肝臟和腸道損傷等方面[6]。這些益生功能與發酵乳桿菌相關基因的調控密不可分,而基因的調控和功能研究依賴于菌株遺傳操作的建立和發展。因此,確定最佳電轉化條件是建立發酵乳桿菌遺傳體系的前提。發酵乳桿菌AR497是本實驗室前期篩選出的1株能有效改善小鼠腸炎的乳酸菌,為研究其抗炎機理和解析抗炎相關基因,建立高效的電轉化方法至關重要。
由于目前報道的乳酸菌電轉化方法不能成功應用于AR497中,本研究首先建立了發酵乳桿菌AR497的電轉化方法,采用Plackett-Burman試驗篩選出電轉化方法中的關鍵因素,利用響應面試驗對關鍵因素進行優化,確定最優電轉化條件。
1 材料與方法
1.1 材料與培養基
1.1.1 菌株與質粒
實驗所用的菌株與質粒如表1所示。
1.1.2 培養基
MRS培養基:用于AR497的活化、培養和活菌計數。LB培養基:用于E.coli的培養。MRSMC1復蘇培養基:含有0.8 mol/L山梨醇的MRS培養基。MRSMC2復蘇培養基:含有0.8 mol/L山梨醇,2 mmol/L CaCl2,20 mmol/L MgCl2的MRS培養基。MRSMC3復蘇培養基:含有0.8 mol/L蔗糖的MRS培養基。MRSMC4復蘇培養基:含有0.8 mol/L蔗糖,2 mmol/L CaCl2,20 mmol/L MgCl2的MRS培養基。
1.2 發酵乳桿菌AR497感受態制備方法
MRS液體培養過夜,3%接種量接種至含質量濃度20 g/L甘氨酸的MRS液體培養基至OD600為0.3~0.4。 4 ℃,4 000×g離心棄上清,體積分數為10%甘油洗滌2次并重懸分裝[7]。每管分裝100 μL保藏-80 ℃,電轉化備用。
1.3 發酵乳桿菌AR497感受態效率檢測及鑒定方法
取一定量質粒與100 μL感受態細胞混勻,迅速轉入預冷無菌的電轉杯中,設置好電轉參數后電擊。電擊完畢后,立即加入900 μL液體復蘇培養基,37 ℃靜置4 h后涂布抗性平板,37 ℃倒置培養48 h后,觀察并記錄轉化子個數。挑取上述轉化子進行菌落PCR鑒定,采用引物Cm-F(5’-ggaggcatatcaaatgaactttaataaaattgatttagac-3’)/Cm-R(5’-attatctcatattataaaagccagtcattaggcc-3’)進行PCR擴增氯霉素抗性基因。同時做陰性對照(以AR497為模板)和陽性對照(以質粒pNZ44為模板),瓊脂糖凝膠電泳鑒定PCR產物。實驗3次重復。根據加入質粒的量,計算每微克質粒所得轉化子的數目,計算如公式(1)所示:

(1)
1.4 單因素試驗對電轉化效率的影響
其他步驟不變的情況下,選擇不同的洗滌緩沖液來洗滌感受態細胞,比較電轉化效率,確定合適的洗滌緩沖液。
在獲得最佳洗滌緩沖液的基礎上制備感受態,分別將質量濃度10、20、40、60、80、100 ng/μL的pNZ44質粒電轉到發酵乳桿菌AR497感受態中,觀察不同質粒濃度對電轉化效率的影響,確定最佳質粒質量濃度。
將制備好的感受態在相同條件下電擊,選擇不同復蘇培養基(MRSMC)在相同的時間里復蘇細胞。比較電轉化效率,確定合適的復蘇培養基。
1.5 Plackett-Burman 試驗設計
選擇甘氨酸質量濃度、OD600、電場強度、復蘇時間和山梨醇濃度為考察因素,利用Minitab軟件設計15次PB試驗,進行關鍵因素篩選。結合前期試驗結果分別設每個因素高低2個水平。因素水平見表2。
1.6 最陡爬坡試驗設計
根據Plackett-Buman試驗結果,對篩選得出的關鍵因素進行合理設計,正效應的關鍵因素其梯度為遞增,負效應的關鍵因素其梯度為遞減,測定發酵乳桿菌AR497的電轉化效率,尋找最優電轉化效率區域。
1.7 Box-Behnken響應面優化試驗設計
對發酵乳桿菌AR497電轉化條件的關鍵因素作進一步優化,獲得其最佳電轉化效率。Box-Behnken設計見表3。

表3 Box-Behnken 響應面試驗因素水平和編碼
2 結果與分析
2.1 發酵乳桿菌AR497電轉化方法的篩選
前期利用紙片法對發酵乳桿菌AR497進行耐藥性評價[8],發現AR497對氨芐西林、阿莫西林、米諾環素、萘啶酸、氯霉素和紅霉素有較高的敏感性。由于乳酸菌基因工程操作中常用的抗生素一般為紅霉素和氯霉素,因此本研究選擇具有紅霉素或氯霉素抗性的5種質粒。根據文獻中報道的乳酸菌電轉化方法[9-13],嘗試將5種質粒分別電轉化至AR497感受態中,但均未成功。基于王巧惠等[7]制備干酪乳桿菌感受態的方法,本研究改變了接種量、生長培養基中甘氨酸的質量濃度和菌體生長狀況,使AR497能夠成功吸收外源質粒。但僅有質粒pNZ44和pMG36e能夠成功轉化至AR497中,其他質粒未能成功,這可能是由于這些質粒的復制子不能夠在AR497中自主復制。KIM等[14]研究也表明,菌株之間的特異性和質粒的來源會影響轉化效率。
為驗證上述轉化后得到的克隆為陽性,隨機挑選9個含有pNZ44的轉化子,選用pNZ44上的氯霉素抗性基因片段引物進行菌落PCR驗證,電泳圖顯示均有條帶且與目的片段(~700bp)大小一致(圖1),表明pNZ44質粒已轉化至發酵乳桿菌AR497中。由于pNZ44在AR497中的電轉化效率最高,后續試驗選擇此質粒進行電轉化條件優化。
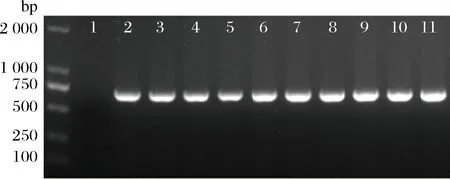
M-DL 2000 marker;1-陰性對照;2-陽性對照;3~11-轉化子氯霉素(Cm)抗性基因PCR結果圖1 轉化子PCR驗證
Fig.1 Transformants verified by PCR
2.2 不同洗滌緩沖液對電轉化效率的影響
制備感受態時,洗滌緩沖液通過洗滌細胞使感受態處于理想的離子環境濃度[15]。洗滌緩沖液中通常含有滲透保護劑,用于維持細胞滲透壓,避免細胞因電穿孔過度溶脹而破裂,從而提高細胞存活率。本研究選擇了4種制備乳酸菌感受態常用的洗滌緩沖液,考察其對AR497電轉化效率的影響。洗滌緩沖液I的電轉化效率遠低于洗滌緩沖液II和III(圖2),這說明加入滲透保護劑確實有利于轉化效率的提高。同時還發現,利用蔗糖作為保護劑能獲得更高的轉化效率,約為3×104CFU/μg DNA,與曹曉梅等[16]研究結果一致。
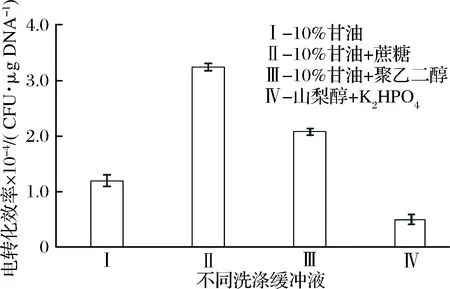
圖2 洗滌緩沖液對發酵乳桿菌AR497電轉化效率的影響
Fig.2 Effect of washing buffer on the electroporationefficiency of L. fermentum AR497
2.3 不同質粒濃度對電轉化效率的影響
外源質粒濃度會影響電轉化效率,細胞濃度一定時,添加不同濃度的外源質粒得到的轉化子數目不同。質粒濃度過大時,電轉化產生的電阻較大,易于擊穿電轉杯[17]。本研究選擇添加不同濃度的pNZ44質粒進行電轉化,考察其對AR497電轉化效率的影響。由圖3可知,加入不同濃度質粒對電轉化效率有一定的影響。質粒質量濃度在20 ng/μL左右時,電轉化效率最高達3.8×104CFU/μg DNA;質粒濃度再升高時,轉化效率反而下降。

圖3 不同質粒質量濃度對發酵乳桿菌AR497電轉化效率的影響
Fig.3 Effect of different plasmid content on the electropor-ation efficiency of L. fermentum AR497
2.4 不同復蘇培養基對電轉化效率的影響
細胞經電擊后很容易大量死亡,在高滲環境中復蘇能夠明顯提高細胞的存活率[18]。采用4種高滲培養基來復蘇電轉化后的AR497細胞,結果表明,在MRSMC2的培養基中電轉化效率最高,達5.6×104CFU/μg DNA(圖4)。相同濃度山梨醇的轉化效率明顯高于蔗糖,說明山梨醇更有利于AR497細胞膜的恢復。
圖4 不同復蘇培養基對發酵乳桿菌AR497電轉化效率的影響
Fig.4 Effect of different medium component on the electro-poration efficiency of L. fermentum AR497
MRSMC2恢復培養基比MRSMC1恢復培養基的轉化效率更高,這可能是CaCl2和MgCl2的存在會促進外源DNA的吸收,獲得更多的轉化子。
2.5 Plackett-Burman 試驗篩選關鍵因素
在上述單因素試驗基礎上,本研究采用5因素3水平的Plackett-Burman試驗設計對電轉化方法中甘氨酸質量濃度、OD600、電場強度、山梨醇濃度和復蘇時間進行關鍵因素篩選。利用Minitab軟件對Plackett-Burman試驗結果(表4)進行擬合和方差分析,擬合方程如下:
Y=25 833+17 433X1-18 792X2+22 792X3+4 225X4-18 817X5
影響電轉化效率的關鍵因素顯著性排序為:電場強度>山梨醇濃度>OD600>甘氨酸質量濃度>復蘇時間(表5)。其中電場強度(X3)、山梨醇濃度(X5)、OD600(X2)和甘氨酸濃度(X1)對電轉化效率影響顯著(P<0.05),基于此結果進行最陡爬坡試驗。

表4 Plackett-Burman 試驗設計及結果

表5 Plackett-Burman 試驗各種因素的影響
2.6 最陡爬坡試驗結果與分析
隨著甘氨酸質量濃度、OD600、電場強度及山梨醇濃度的變化,電轉化效率呈先增大后減小的趨勢(表6)。當甘氨酸質量濃度為25 g/L,OD600為0.2,電場強度12.5 kV/cm,山梨醇濃度0.5 mol/L時,AR497的電轉化效率最高,說明此時接近最佳響應區域。因此,Box-Behnken試驗將此條件作為中心點,對電轉化條件進一步優化。
表6 最陡爬坡試驗設計及結果
Table 6 Experimental design and results of steepest ascent

編號甘氨酸濃度/(g·L-1)OD600電場強度/(kV·cm-1)山梨醇濃度/(mol·L-1)電轉化效率×10-4/(CFU·μg DNA-1)150.307.50.70.05±0.002150.2510.00.610.25±0.233250.2012.50.522.16±0.284350.1515.00.416.22±0.17
2.7 Box-Behnken響應面試驗結果與分析
在最陡爬坡試驗的基礎上,采用Box-Behnken響應面設計對以上4個顯著因素進行優化。利用Design Expert軟件對試驗結果(表7)進行方差分析及二次多項回歸擬合(表8),得到發酵乳桿菌AR497電轉化效率對電場強度(A)、山梨醇濃度(B)、OD600(C)和甘氨酸質量濃度(D)的多元回歸方程為:
Y=227 500.00+58 208.33A+14 479.17B+10 386.25C+12 407.08D-20 943.13A2-31 411.87B2-158 800.00C2-49 020.00D2+26 562.50AB+13 250.00AC+187.50AD+
4 500.00BC-1 375.00BD+5 158.75CD

表7 Box-Behnken 試驗設計及結果

表8 回歸方程模型顯著性分析

圖5直觀反映了各因素間交互作用對電轉化效率的影響,其中,電場強度(A)和山梨醇濃度(B)交互作用的曲面圖斜度更為陡峭,說明其交互作用顯著。而其他交互項之間的曲面圖斜度較為平緩,交互作用不顯著。
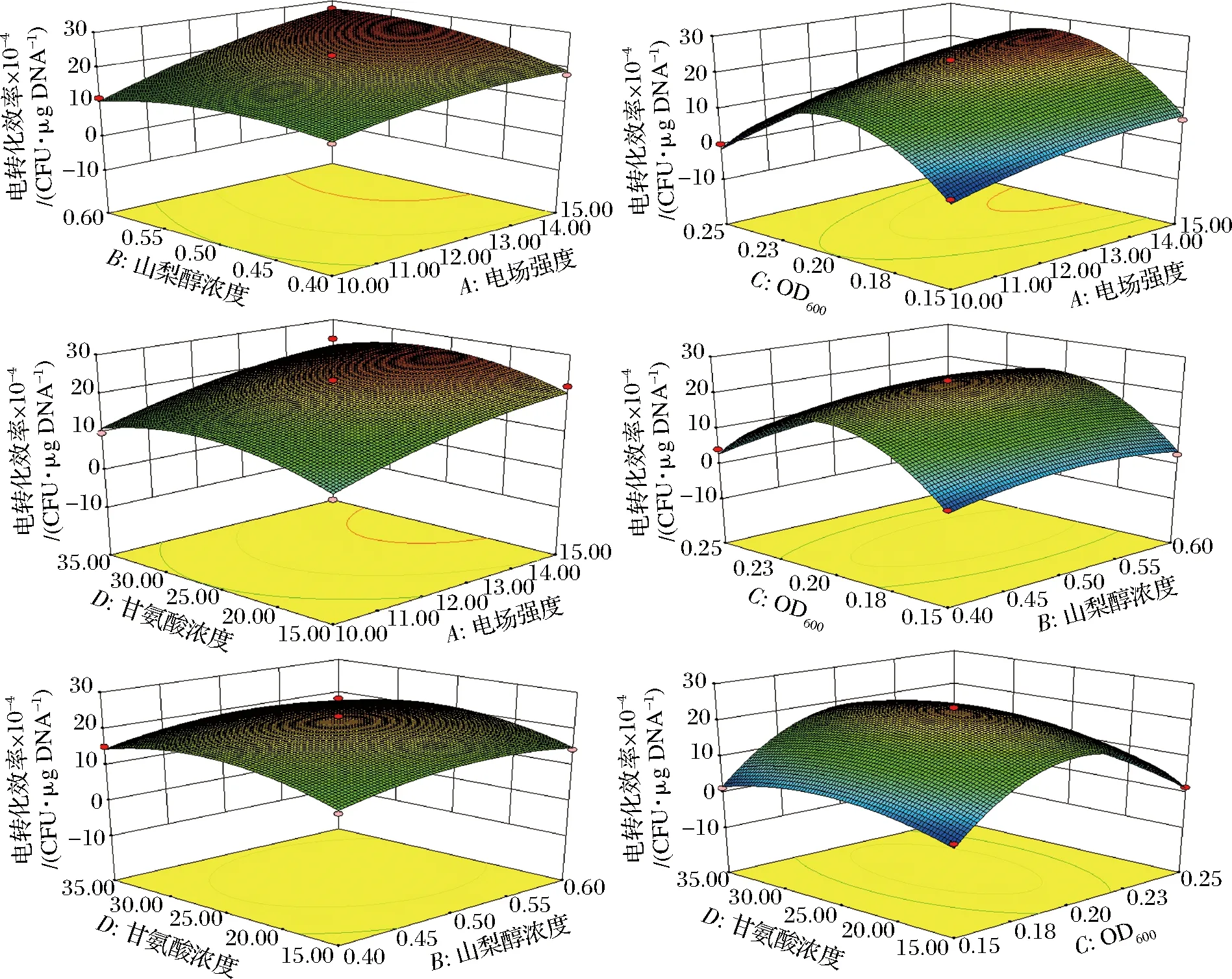
圖5 各因素交互作用對發酵乳桿菌AR497電轉化效率的影響
Fig.5 The effect of the factors on the electroporationefficiency of L. fermentum AR497
運用Design Expert軟件分析得到發酵乳桿菌AR497最優電轉化條件為:電場強度15 kV/cm,山梨醇濃度0.57 mol/L,OD600為0.2,甘氨酸質量濃度26.23 g/L,預測在此條件下發酵乳桿菌AR497的電轉化率達到2.8×105CFU/μg DNA。為了方便操作,將上述預測的參數修改為:電場強度15 kV/cm,山梨醇濃度0.6 mol/L,OD600為0.2,甘氨酸濃度26 g/L。按此電轉化條件實際電轉化效率為(2.78±0.25)×105CFU/μg DNA,與理論值非常接近,說明條件參數可靠,能夠較好的預測發酵乳桿菌AR497電轉化效率。
3 討論
本研究確立了發酵乳桿菌AR497的電轉化方法,使質粒pNZ44和pMG36e可成功轉化至AR497中。采用單因素試驗、Plackett-Burman試驗、最陡爬坡試驗和Box-Behnken響應面法對電轉化條件進一步優化,確定了制備發酵乳桿菌AR497的感受態方法和最佳電轉化條件,即3%接種量接種至含有質量濃度26 g/L甘氨酸的MRS液體培養基,37 ℃培養至OD600約0.2,用體積分數10%甘油和0.5 mol/L蔗糖溶液洗滌重懸細胞2次,電場強度15 kV/cm,電擊后用0.6 mol/L山梨醇,2 mmol/L CaCl2和20 mmol/L MgCl2的MRS培養基復蘇,在此條件下發酵乳桿菌AR497電轉化效率高達2.78×105CFU/μg DNA。
LUCHANSKY等[13]研究表明,使用質粒pGK12電轉至L.fermentum1750中,轉化效率高達9.7×105CFU/μg DNA,但該電轉化方法不適用于發酵乳桿菌AR497,造成轉化能力差異的原因可能是質粒pGK12和pNZ44的復制子不同,復制方式存在的差異,影響了菌株的轉化能力;另一種可能就是宿主菌株存在特異性。SERROR等[19]研究也發現,電轉化效率可能與菌株的特異性有關,他們嘗試用同一種方法制備不同的德氏乳桿菌感受態并轉化,結果有些菌株沒有轉化子,但有些菌株的轉化效率高達104CFU/μg DNA。RUSH等[10]研究使用質粒pNZ17電轉至L.fermentumBR11中,轉化效率僅為2.0×103CFU/μg DNA,而WEI等[20]研究通過改變篩選平板上的抗生素濃度,使L.fermentumBR11電轉化效率最高達4.5×104CFU/μg DNA,說明抗生素篩選的濃度也會對電轉化效率產生影響。除上述因素外,影響電轉化效率的因素還包括質粒來源、大小,抗生素種類,載體與內源質粒的相容性等,后期可針對這些因素進行優化,有望進一步提高AR497的電轉化效率。

