液相色譜串聯(lián)質譜檢測牙鲆魚中的小清蛋白過敏原
葛敏敏,王建華,林洪
1(中國海洋大學 食品科學與工程學院,山東 青島, 266003)2(青島海關檢驗檢疫技術中心,山東 青島,266002)
小清蛋白(parvalbumin,PV)是水產品中的主要過敏原,在真骨魚類中廣泛存在,其對溫度、pH和變性劑都較為穩(wěn)定,因此很多加工過的魚類產品仍具有致敏性。魚類肌肉中小清蛋白的含量范圍為 0~1.5 mmol /L[1],牙鲆的PV有3個亞基,本文只研究其中1個亞基G9I585(uniprot中PV編號),對其進行定性定量分析。
“bottom up”[2]的蛋白質組學分析方法,其一般過程為:首先利用酶將目標蛋白質切成小分子質量的肽段,然后通過液相色譜串聯(lián)質譜(high performance liquid chromatography tandem mass spectrometry,HPLC-MS/MS)對肽段進行檢測。HPLC-MS/MS分析方法的建立最好每個蛋白質選 2~3 個特征肽段,以獲得更好的特異性[3],一般選用胰蛋白酶對蛋白質進行酶解,產生的肽羧基末端通常為精氨酸或賴氨酸,經ESI源離子化后主要產生帶有2個正電荷的離子,二級質譜碎裂時產生的子離子一般為Y型離子帶有1個正電荷[4]。目前“bottom up”方法逐漸應用于牛奶[5]、雞蛋、魚類[6]、甲殼貝類動物[7]、堅果[8]、小麥、花生[9]等主要致敏原的檢測,相比于傳統(tǒng)方法酶聯(lián)免疫吸附測定(ELISA)[10]、聚合酶鏈式反應(PCR)[11],LC-MS / MS方法具有準確、靈敏、快速的特點,因此LC-MS/MS將作為一種重要的過敏原檢測方法。
在真骨魚類PV的檢測方面,蔡秋鳳等[12-13]分別采用ELISA和Western-blotting 方法對不同加工方式的鰱魚的PV的含量變化進行分析,CARRERA等[6]利用LC-MS/MS方法對真骨魚的PV進行定性分析,但沒有進行定量檢測。
本實驗利用高分辨質譜進行特征肽段的篩選,選擇ALTDAETK、LFLQNFAFSASAR和SDFIEEDELK作為牙鲆PV的特征肽段,并對蛋白質提取液體和酶解過程的吲哚-3-乙酸(indole-3-acetic, IAA)濃度、酶用量、酶解時間進行了優(yōu)化,建立了以ALTDAETK作為定量肽段,LFLQNFAFSASAR和SDFIEEDELK作為定性肽段的牙鲆PV檢測的LC-MS / MS方法,可以實現(xiàn)對牙鲆中PV的精確定量。采用LC-MS/MS方法對牙鲆中PV的定量分析及對牙鲆PV的前處理優(yōu)化過程未見文獻報道。
1 材料與方法
1.1 材料與試劑
牙鲆、大菱鲆購自山東青島。
LTDAETK(摩爾質量:847.9 g/mol,簡稱ALT)、SDFIEEDELK(摩爾質量:1 224.3 g/mol,簡稱SDF)、LFLQNFAFSASAR(摩爾質量:1 253.4 g/mol,簡稱LFL)、SDFIEEDELK(摩爾質量:605.8 g/mol,簡稱sdf)、重組PV(摩爾質量:11 645.0 g/mol),委托上海Sangon Biotech公司合成(純度>95%);測序級胰蛋白酶,瑞士Roche公司;二硫蘇糖醇,北京Solarbio公司;吲哚-3-乙酸,北京Solarbio公司;Rapigest SF,美國Waters公司;Tris(分析純),北京Scientan公司;甘氨酸(分析純),北京Solarbio公司;EDTANa4(分析純),天津Kermel公司;乙腈(色譜純),德國Merck公司;甲酸(色譜純),德國Fluka公司。
1.2 儀器與設備
1200/6430液相色譜-三重四級桿串聯(lián)質譜儀,美國Agilent公司;UPLC-Q-Exactive Focus MS超高效液相色譜四級桿靜電場軌道阱質譜聯(lián)用儀,美國Thermo Scientific公司;BEH-C18色譜柱,美國Waters公司;HS501水平振蕩器,德國IKA公司;CR21G高速冷凍離心機,日本HITACHI公司;調速形迷你離心機,上海Sangon Biotech公司;Mill-Q超純水裝置,美國Millipore公司;HH-1水浴鍋,國華電器有限公司。
1.3 方法
1.3.1 重組PV的酶解
前處理:取10 μL重組PV水溶液(8 μg/mL),加入90 μL Rapigest SF(0.1%,體積分數(shù)),加入30 μL IAA(濃度5 mol/L) 溶液,40 ℃避光水浴30 min; 加入20 μL胰蛋白酶溶液(質量濃度0.1 mg/mL),加入水使酶解液體積達到198 μL,酶解14 h,加入2 μL甲酸終止酶解,12 000 r/min離心30 min后,取上清;進UPLC-Q-Exactive Focus MS檢測。
1.3.2 樣品前處理條件優(yōu)化
提取:新鮮牙鲆取肌肉打碎,取1 g(精確至0.01 g)樣品,加入 10 mL蛋白質提取液3 (0.1 mol/L Tris,0.5 mmol/L 甘氨酸),水平振蕩30 min,12 000 r/min離心30 min后,取上清;上清液于100 ℃水浴鍋中加熱5 min,12 000 r/min離心30 min取上清。
酶解:取10 μL上清液,加入90 μL Rapigest SF(質量濃度1 mg/mL),按酶/蛋白質質量比為2∶5加入胰蛋白酶溶液(0.1 mg/mL),加入水使酶解液體積達到198 μL,酶解12 h,加入2 μL甲酸終止酶解,12 000 r/min離心30 min后, 取上清;待LC-MS/MS上樣分析。
1.3.3 UPLC-Q-Exactive Focus MS條件
色譜條件色譜柱:EC-C18色譜柱(100 mm×3 mm, 1.7 μm);柱溫:35 ℃;進樣量:5 μL;流動相A:含1%(體積分數(shù))甲酸的水溶液;流動相B:含1%(體積分數(shù))甲酸的乙腈溶液;梯度洗脫程序:0~15 min,97%~70%A;15~18 min,70%~100%A;18~22 min, 0%A;22~22.1 min,0%~97%A;22.1~25 min,97%A;流速0.3 mL/min。
質譜條件:帶有加熱器的電子噴霧電離源(HESI),輔助氣體加熱器溫度:300 ℃;毛細管電壓:3 500 V; 毛細管溫度為320 ℃;正模式的電噴霧電壓設置為3 500 V;掃描模式:Full MS+ddMS2正離子模式數(shù)據非依賴型掃描,其中Full MS的分辨率為70 000, 掃描范圍為400~1 400m/z,DD-MS2確認模式分辨率17 500,四極桿的碰撞能量介于10~30 eV。
使用MaxQuent軟件[14]進行數(shù)據處理,牙鲆PV的氨基酸序列用作Fasta文件。
1.3.4 LC-MS/MS方法的建立
色譜條件色譜柱:BEH-C18色譜柱(100 mm×2.1 mm, 2.7 μm);柱溫:35 ℃;進樣量:10 μL;流動相A:含1%(體積分數(shù))甲酸的水溶液;流動相B:含1%(體積分數(shù))甲酸的乙腈溶液;梯度洗脫程序:0~13 min,97%~70%A;13~18 min,70%~40% A;18~19 min, 40%~0% A;19~21 min, 0% A;21~22 min, 0%~97% A;22~24 min, 97% A。流速0.2 mL/min。
質譜條件離子源:電子噴霧電離源(ESI);毛細管電壓:3 500 V;霧化氣壓力:275.9 kPa;干燥氣溫度:300 ℃;干燥氣流速:12.0 L/min(氮氣);采集模式:多反應監(jiān)測(MRM)模式。
2 結果與分析
2.1 特征肽段的選擇
重組PV酶解液經高分辨質譜檢測,其數(shù)據經MaxQuent軟件處理,從而得到酶解肽段的響應及得分(表1)。

表1 重組PV的酶解肽段的響應及得分Table 1 Intension and scorre of enzymolysis peptides of recombination PV
根據肽段穩(wěn)定性和質譜檢測的要求,特征肽不應含有易氧化氨基酸半胱氨酸(C)和蛋氨酸(M)且長度在8到18個氨基酸[15], LFLQNFSASAR、ALTDAETK、 SDFIEEDELK滿足要求,因此選擇這3個肽段作為特征肽段。CARRER等[6]將LFLQNFSASAR等19種作為鑒定真骨魚的肽段,沒有將ALTDAETK、 SDFIEEDELK作為鑒定真骨魚的肽段。為了確定肽段的獨特性,3個特征肽段在UniProtKB 數(shù)據庫中進行序列對比,結果顯示SDFIEEDELK為牙鲆特有肽段,而LFLQNFSASAR和ALTDAETK兩個肽段在三文魚、鯉魚、鱈魚、鱸魚等多種真骨魚中含有。用LC-MS/MS方法對三文魚和鯉魚肌肉樣品進行檢測,沒有SDFIEEDELK檢出,LFLQNFSASAR和ALTDAETK均有檢出,與數(shù)據庫檢索結果一致。
2.2 前處理方法優(yōu)化
首先對提取液方法進行優(yōu)化,以提取液所提取的總蛋白質濃度進行比較分析;其次在重組PV的酶解方法(見1.3.1)基礎上對IAA濃度、酶用量、酶解時間4個酶解條件依次進行單因素水平的優(yōu)化,以肽段在儀器上的相對響應進行比較分析。
2.2.1 蛋白質提取液的優(yōu)化
在WU等[16]的牙鲆PV提取液1的基礎上進行提取液的優(yōu)化,優(yōu)化的3種蛋白質提取液分別為:蛋白質提取液1:Tris(0.1 mol/L),甘氨酸(0.5 mmol/L),DTT(1 mmol/L);蛋白質提取液2:Tris(0.1 mol/L),甘氨酸(0.5 mmol/L),DTT(1 mmol/L),EDTA(5 mmol/L);蛋白質提取液3:Tris(0.1 mol/L),甘氨酸(0.5 mmol/L)。
提取液1、2、3所提取的總蛋白質質量濃度分別為1.49 mg/mL、1.18 mg/mL、0.94 mg/mL(蛋白質質量濃度由BCA方法測得)。由圖1可以看出,ALT、LFL兩個肽段的相對響應為提取液3>提取液2>提取液1,對于SDF肽段來說提取液3>提取液1>提取液2。

圖1 提取液優(yōu)化Fig.1 Optimization of extraction liquid
提取液中的DTT作為一種還原劑,可以避免蛋白質中半胱氨酸之間形成分子內或分子間的二硫鍵,阻止蛋白高分子聚合物的形成提高提取效率[3],但是在酶解過程中DTT也會對酶作用,抑制酶的活性導致酶解效率降低,從而質譜響應降低,因此經不含DTT的提取液3提取的樣品響應最高;從提取液1和提取液2比較來看,EDTA對蛋白提取效率沒有提高作用。綜合考慮選擇提取液3。
2.2.2 IAA濃度的優(yōu)化
進行IAA(5 mmol/mL)用量的優(yōu)化,IAA優(yōu)化的3個水平分別為添加0、15、30 μL,其結果如圖2所示,對于ALT、SDF肽段來說0 μL>15 μL>30 μL,對于LFL來說30 μL>0 μL>15 μL。肽段與IAA烷基化過程中發(fā)生的非特異性化學修飾有關[18],這將改變標肽的質量,而肽的質量發(fā)生變化將導致該肽不能被MRM方法檢出,因此測得的肽產率將低于實際產率;再者作為烷基化試劑的IAA可能對酶存在一定的抑制作用從而導致酶解程度下降,綜合考慮,選擇酶解過程不添加IAA。
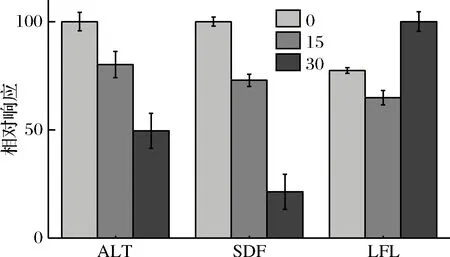
圖2 IAA優(yōu)化提取液優(yōu)化Fig.2 Optimization of IAA
2.2.3 酶用量優(yōu)化
PV是一種鈣結合蛋白,具有由約30 個氨基酸殘基組成的螺旋-環(huán)-螺旋蛋白模體的EF手圖像,每個EF手圖像(模體)結合1個Ca2+,為小清蛋白提供了更加穩(wěn)定的結構[1],PV具有較高的酶解穩(wěn)定性,因此本實驗設計的5個水平的酶/蛋白質(質量比)高于一般的酶/蛋白質(1∶100~1∶10)[17],酶/蛋白質(質量比)分別為1∶10、1∶5、2∶5、3∶5、4∶5(提取液蛋白質濃度通過BCA方法側得)。酶用量優(yōu)化結果如圖3所示,ALT與SDF肽段相對響應隨酶/蛋白質的增加而增強,但ALT肽段相對響應變化較為緩慢,SDF變化較大,而LFL肽段相對響應隨酶/蛋白質(質量比)增加大致呈降低趨勢。

圖3 酶/蛋白質質量比的優(yōu)化Fig.3 Optimization of the ratio of enzyme and protein
不同的肽段由于其所在二級結構、自身性質及酶濃度不同,其酶解效率有所差異,酶/蛋白質(質量比)為1∶10~4∶5,ALT肽段的酶解得量比較穩(wěn)定,改變酶的濃度對酶解效果影響不大,可能已經達到較高程度的酶解;SDF肽段的酶解得量隨酶/蛋白質的增大而增大,說明此肽段還未達到完全或較高程度的酶解;LFL肽段可能由于酶解產物抑制或酶錯切造成其響應隨酶濃度增加而逐漸降低,綜合考慮以酶解得量比較穩(wěn)定的ALT肽段作為定量肽段,以SDF、LFL肽段為定性肽段,酶/蛋白質為2∶5。
2.2.4 酶解時間優(yōu)化
分別選擇4、6、8、10、12、14 h六個酶解時間進行酶解時間的優(yōu)化,如圖4所示,ALT、SDF、LFL三個肽段酶解12 h后達到平臺期,因此酶解時間12 h為最優(yōu),酶解時間優(yōu)化圖如圖4所示。

圖4 酶解時間優(yōu)化Fig.4 Optimization ofenzymolysis time
2.2.5 酶解效率
蛋白質的定量依賴于該蛋白質消化成的用作定量的目標肽段,而對于蛋白質的絕對定量方法的準確性取決于用作定量的目標肽段的酶解程度,若該目標肽段沒有達到完全酶解則會損害方法的準確性[18],以優(yōu)化的牙鲆樣品的最優(yōu)酶解條件(酶/蛋白質為2∶5,酶解時間12 h),對1 000 mg/mL、500 mg/L、200 mg/L 三個質量濃度水平的重組PV進行酶解,以ALT肽段作為定量肽段,以SDF與LFL肽段為定性肽段, ALT肽段酶解效率在104%~106%,滿足檢測要求。
2.3 LC-MS/MS方法質譜參數(shù)優(yōu)化
LFL定性離子對與CARRERA等[6]一致,其他肽段質譜參數(shù)沒有文獻報道,為了獲得最佳的質譜采集參數(shù),對ALT、SDF、LFL、sdf四個合成肽段的前體離子、產物離子、碎裂電壓、碰撞能量等進行優(yōu)化,優(yōu)化結果見表2。
2.4 線性關系與定量限
以ALT肽段為定量肽段,SDF、LFL肽段為定性肽段,建立PV的檢測方法,在0.005~100 000 mg/L 9個點質量濃度,ALT質譜響應與內標sdf響應之比(y)與ALT濃度與內標sdf濃度之比(x) 的線性關系為y= 1.221 1x+0.013 3(R2>0.999)。小清蛋白定量限為2.74 mg/kg。

表2 小清蛋白的酶解3個肽段的保留時間和質譜參數(shù)Table 2 Retention time and mass spectrometric parameters of three peptides
2.3.3 添加回收
大菱鲆與牙鲆是同屬于鲆科的真骨魚類,經已經建立的LC-MS/MS方法檢測,大菱鲆中不含SDFIEEDELK、LFLQNFSASAR和ALTDAETK肽段。為了驗證牙鲆中PV含量檢測方法的準確性,選擇與牙鲆相近的物種大菱鲆為空白基質,以重組PV為標準品進行添加回收實驗,3個添加水平的平均回收率在95%~102%,滿足檢測要求,相對標準偏差3%~6%。
2.4 實際樣品檢測
采用大菱鲆為空白基質配制標準曲線對牙鲆進行檢測,檢測結果為ALT肽段含量為0.85 mg/g,小清蛋白含量為11.72 mg/g。
3 結論
本實驗建立了以Tris(濃度0.1 mol/L)、甘氨酸(濃度0.5 mmol/L) 為提取液,酶解過程中酶/蛋白質(質量比)為2∶5,酶解時間為12 h的牙鲆中PV的前處理方法;以ALTDAETK為定量肽段,SDFIEEDELK、SDFIEEDELK為定性肽段的牙鲆PV的HPLC-MS/MS檢測方法,首次實現(xiàn)了用LC-MS/MS方法對牙鲆中主要過敏原PV的精確定量檢測。

