煤系高嶺土改性制備陶粒吸附劑及其對Cr(VI)的吸附性能
王正,高翔,鄭林會,苗洋,成龍勝,高峰
(1.太原理工大學 材料科學與工程學院,山西 太原 030024;2.山西省玻璃陶瓷科學研究所,山西 太原 030013)
近年來,水環境中的重金屬污染問題尤為突出[1]。Cr(VI)作為常見的重金屬離子,不僅污染環境,而且對人類健康危害極大[2-3]。煤系高嶺土又稱煤矸石,是采礦進程中產生的固體廢棄物,不僅侵占土地,而且破壞環境[4-5]。研究表明,高嶺土在煅燒過程中會經歷一種活化狀態,其脫水形成的產物具有很高的火山灰活性,在此狀態下,其內部價鍵斷裂,結構由有序變為無序,表面活性位點增多,孔隙率大大提高[6-9]。本實驗從煤系高嶺土的偏高嶺化及其活性激發劑[10]入手,制備出一種吸附效果良好,強度較高的陶粒輕集料,為固體廢棄物煤系高嶺土拓寬了應用途徑。
1 實驗部分
1.1 材料和儀器
煤系高嶺土生料、熟料(200目),取自山西忻州地區,其化學成分見表1;消石灰,市售;重鉻酸鉀、二苯碳酰二肼均為分析純。
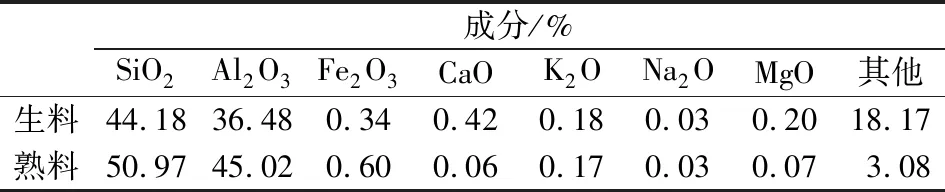
表1 煤系高嶺土生料和熟料的化學成分Table 1 The component of coal series kaolinite
752N紫外可見分光光度計;D2PHASER型X射線衍射儀;R02傾斜式造粒機。
1.2 陶粒吸附劑的制備
煤系高嶺土與消石灰按照質量比2.5∶1混合,添加15%炭粉、20%高嶺土熟料,進行造粒,篩分出粒徑1~3 mm的陶粒,在60 ℃干燥12 h,在800 ℃煅燒2 h。
1.3 吸附實驗
稱取1 g吸附劑放入裝有100 mL Cr(VI)濃度20 mg/L的三角燒瓶中,置于磁力攪拌器上中速攪拌2 h。取上清液,過濾,采用二苯碳酰二肼分光光度法(波長540 nm)測定濾液吸光度值,然后通過比爾定律將吸光度轉化為濃度,計算去除率。
2 結果與討論
2.1 吸附劑性能
高嶺土、偏高嶺土(高嶺土經800 ℃煅燒)及陶粒吸附劑對Cr(VI)的吸附性能見表2。
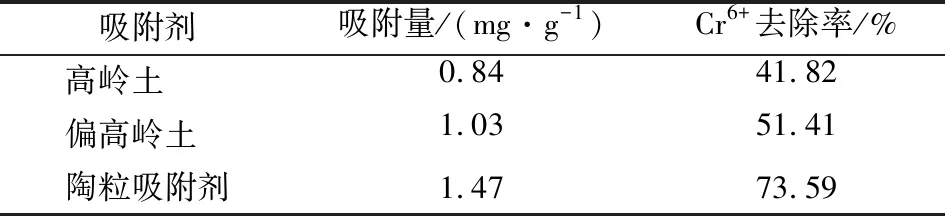
表2 高嶺土、偏高嶺土與陶粒吸附劑的吸附性能Table 2 The adsorption capacity of coal-series kaolin,metakaolin and ceramsite adsorbent
由表2可知,高嶺土改性制備成陶粒吸附劑后,其吸附性能提升顯著。同時,該陶粒堆積密度為852 kg/m3,吸水率為39.10%,筒壓強度為7.76 MPa,根據《GBT 17431.1—2010 輕集料及其試驗方法 第1部分:輕集料》,達到了優級輕集料標準。
2.2 XRD分析
由圖1可知,高嶺土2θ=12.53,25.09°和38.64°為代表高嶺石結構的“山字峰”;偏高嶺土圖譜中代表高嶺石結構的衍射峰消失,出現非晶相特征明顯的“饅頭峰”,表明高嶺石結構發生相變,其內部原本的有序結構遭到破壞;陶粒吸附劑圖譜中“饅頭峰”減弱,在2θ為18.18,34.26,47.28°和50.96°處出現Ca(OH)2衍射峰,說明改性并未生成新相。
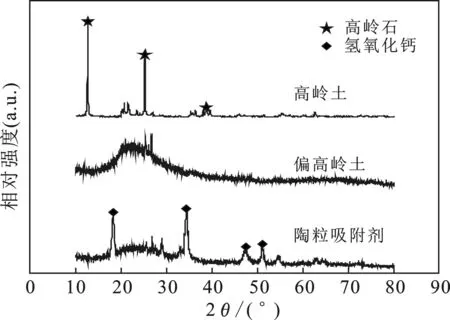
圖1 煤系高嶺土、偏高嶺土及陶粒吸附劑XRD圖Fig.1 XRD diagram of coal-series kaolin,metakaolin and ceramsite adsorbent
2.3 實驗條件對吸附效果的影響
實驗條件對吸附效果的影響,見圖2。
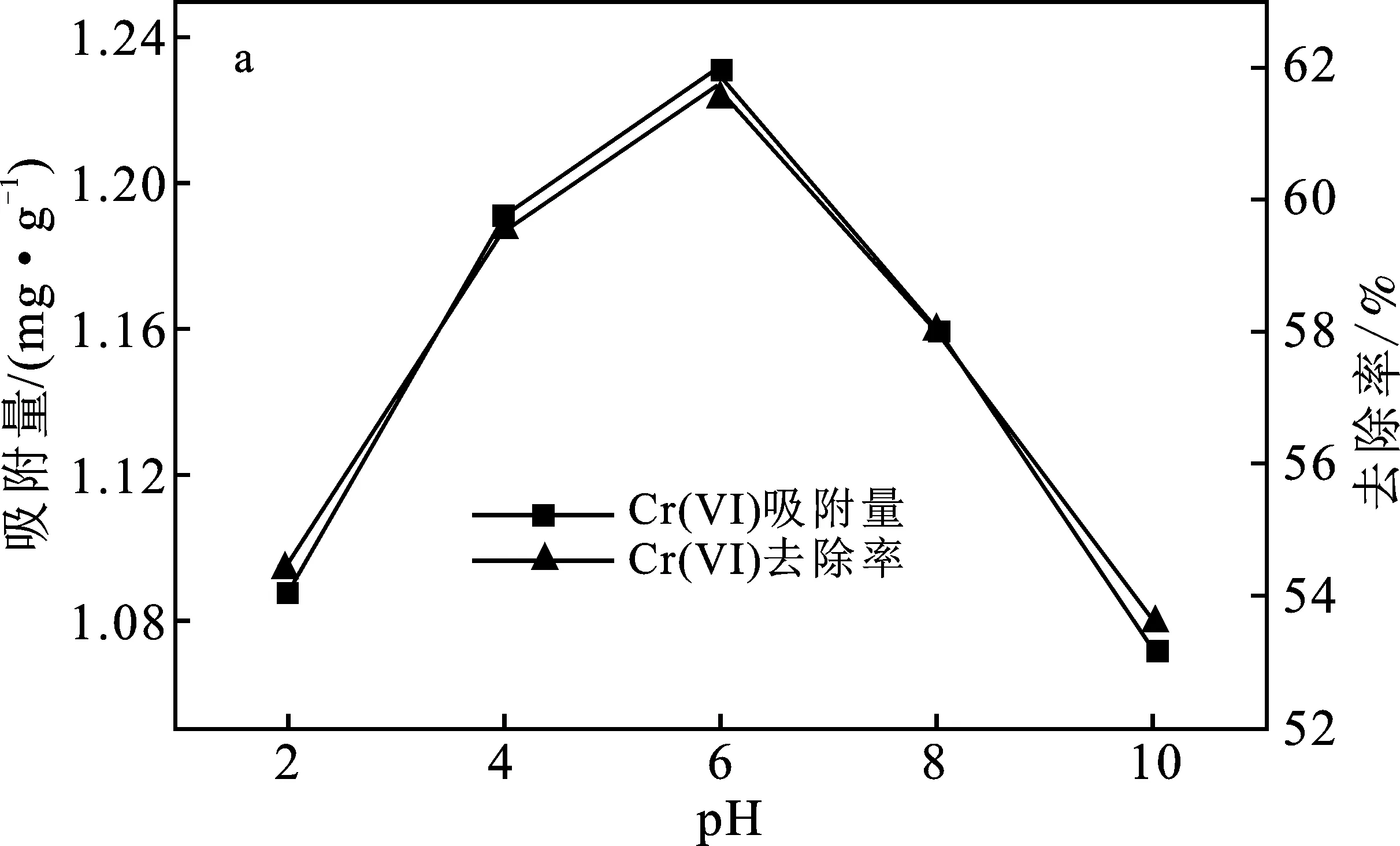
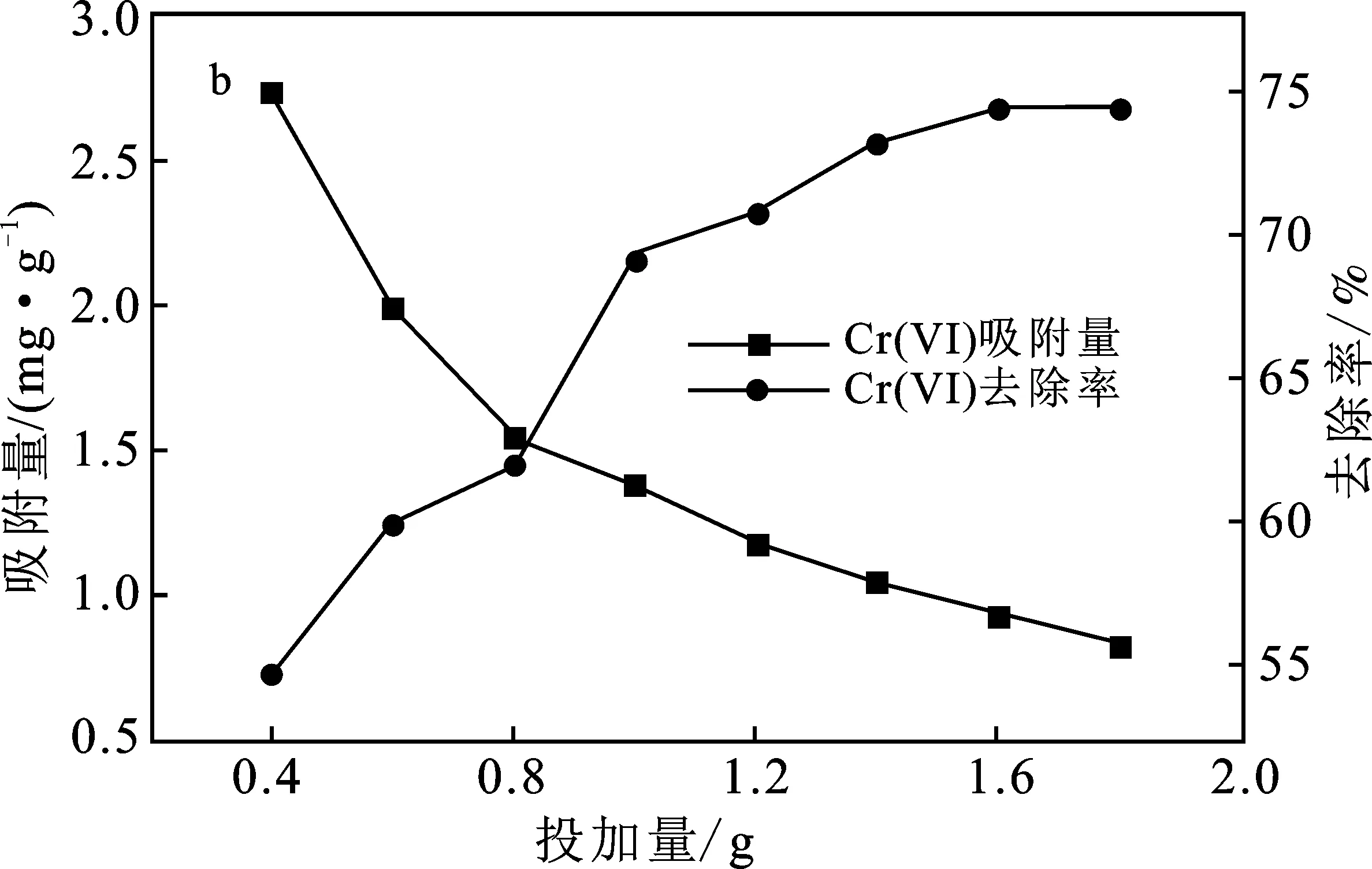
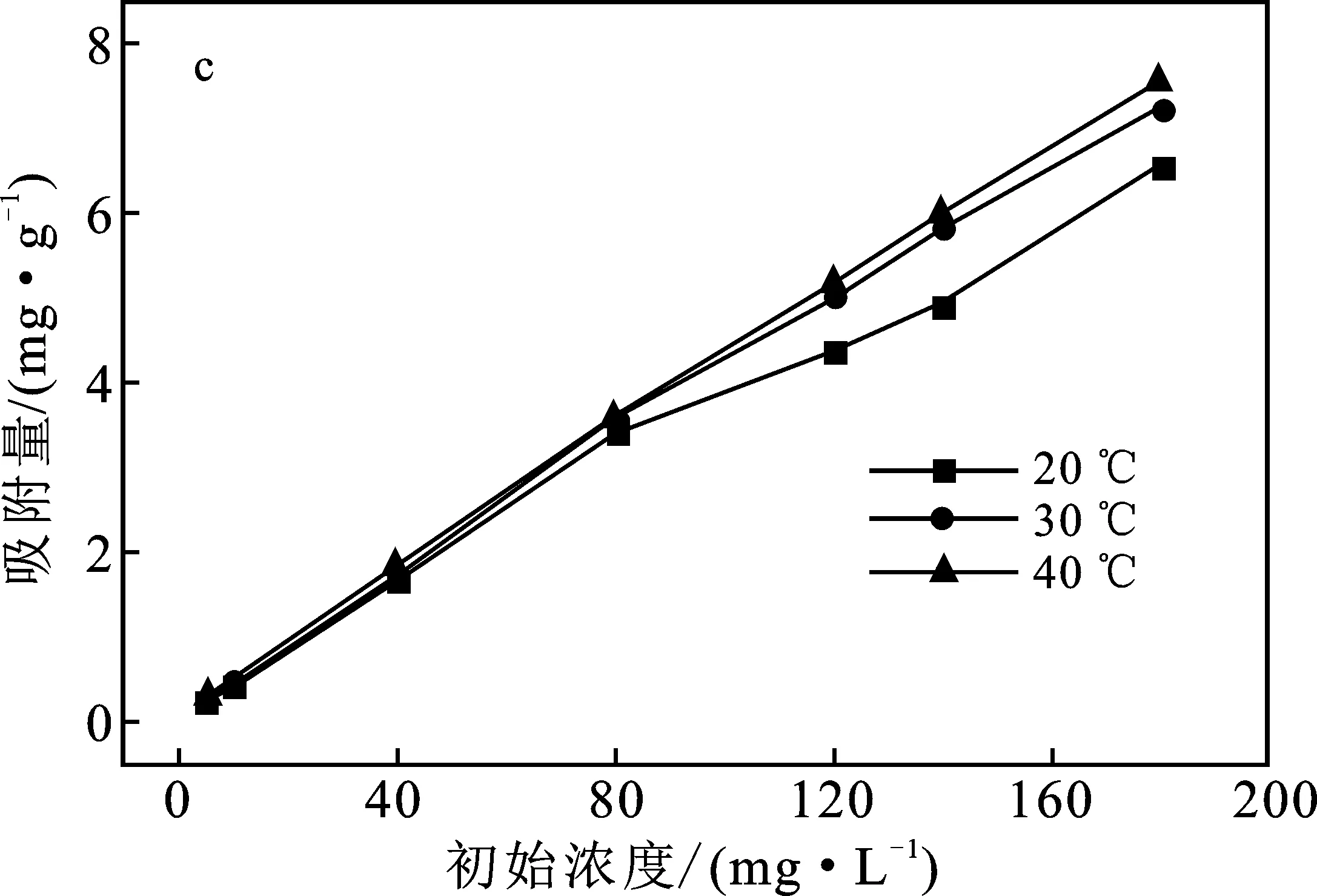
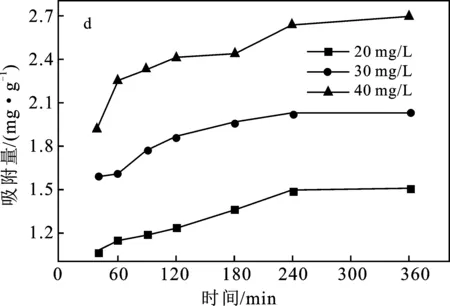
圖2 實驗條件對吸附效果的影響Fig.2 Effect of experimental conditions onadsorption capacity
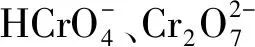
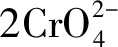
(1)
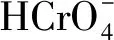
(2)
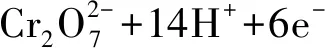
(3)
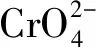
2.3.2 吸附劑投加量的影響 由圖2(b)可知,隨著陶粒投加量的增加,其對Cr(VI)的吸附量逐漸降低,而去除率先迅速升高直到基本不變。隨著陶粒投加量增加,其提供可供吸附的表面積不斷增加,吸附位點逐漸增多,而Cr(VI)濃度保持不變,陶粒單位面積能夠平均的Cr(VI)不斷減少,同時吸附和解吸存在動態平衡,致使單位質量吸附量不斷降低,當添加量在1.6 g以上時,去除率基本保持不變,后續動力學與熱力學擬合實驗均把陶粒投加量定為1.6 g,即16 g/L。
2.3.3 初始濃度的影響 由圖2(c)可知,在相同溫度下,隨著Cr(VI)初始濃度的增加,陶粒對其吸附量逐漸增加;在相同濃度下,隨著溫度升高,對其吸附量逐漸增加。在40 ℃、180 mg/L條件下,陶粒對Cr(VI)的吸附量最大,達到7.58 mg/g。Cr(VI)初始濃度越高,反應時的驅動力越大,對其的吸附量越高;溫度升高,陶粒表面的吸附位點活性提高,促進溶液中Cr(VI)運動,使其擴散更加充分,進入陶粒內部孔隙的幾率提高,吸附進行更充分,導致吸附量更高,同時也表明該吸附反應為吸熱反應。
2.3.4 吸附時間的影響 由圖2(d)可知,240 min時,三組實驗的吸附量已基本不變,因此反應平衡時間為240 min,等溫線實驗按此調整。實驗開始時,Cr(VI)濃度高,擴散到陶粒表面的速度快,與其表面的活性位點接觸充分,時間推后,可以參與反應的表面積逐漸減少,固體表面剩余價力降低,活性位點對 Cr(VI)的吸附逐漸達到飽和,Cr(VI)開始緩慢滲入顆粒內部,與陶粒內孔隙活性位點緩慢接觸,導致吸附速度不斷降低直到反應平衡。
2.4 吸附動力學模型
用準一級、準二級及顆粒內擴散動力學模型進行擬合,結果見表3。
準一級動力學方程:
(4)
準二級動力學方程:
(5)
式中qe——反應在理論上達到平衡時陶粒對Cr(VI)的吸附量,mg/g;
qt——t時刻對Cr(VI)的吸附量,mg/g;
q——反應實際平衡時對Cr(VI)的吸附量,mg/g;
k1——一級動力學吸附速率常數,min-1;
k2——二級動力學常數,mg/(g·min);
t——吸附反應時間,min。
Weber&Morris顆粒內擴散模型方程:
qt=k3t1/2
(6)
式中qt——t時刻陶粒對Cr(VI)的吸附量,mg/g;
k3——擴散模型常數,mg/(g·min1/2);
t——吸附時間,min。
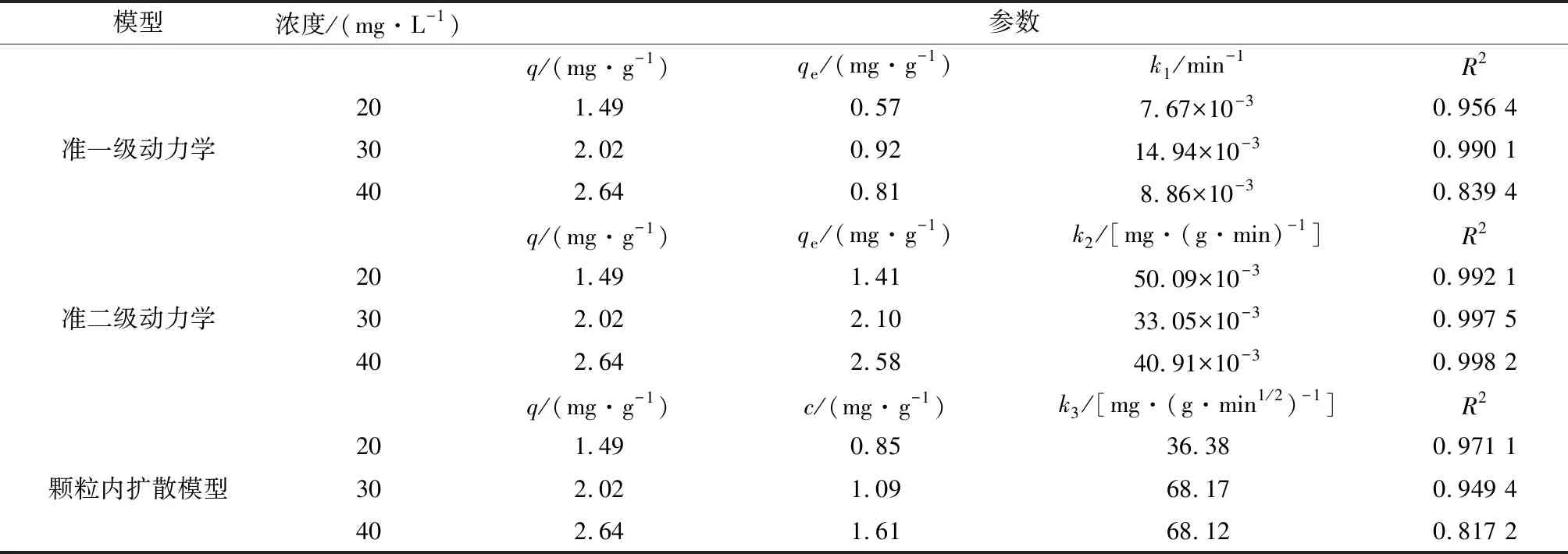
表3 吸附動力學模型擬合參數Table 3 Parameters of adsorption kinetic model fitting
由表3可知,準二級動力學擬合效果最好,R2均在0.99以上,平衡時的理論吸附量與實際吸附量差別均在5%以內,說明該吸附反應過程主要受化學機理控制。
2.5 吸附等溫線模型
用Langmuir和Freundlich等溫線模型進行擬合,結果見表4。
Langmuir模型:
(7)
(8)
Freundlich模型:
qe=Kce1/n
(9)
式中qe——平衡吸附量,mg/g;
qmax——最大吸附量,mg/g;
ce——平衡時溶液中Cr(VI)的濃度,mg/L;
c0——溶液中Cr(VI)的初始濃度,mg/L;
b——與吸附能有關的常數,L/mg;
K,n——經驗常數;
RL——分離因子,用來表示吸附過程的性質。
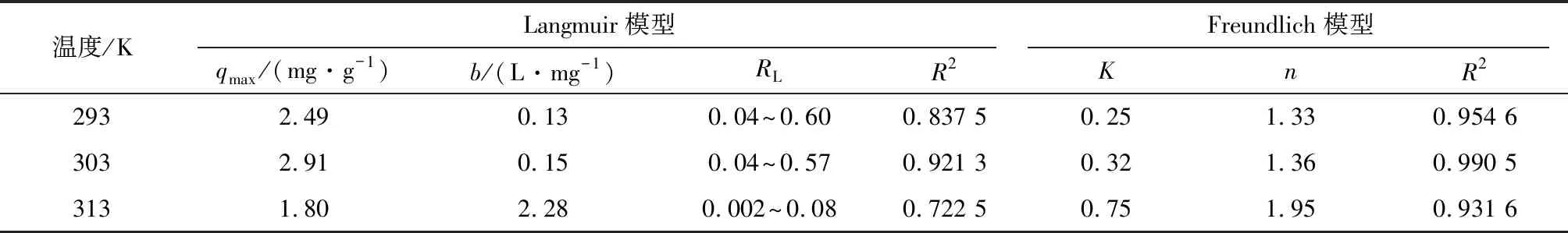
表4 吸附等溫線模型擬合參數Table 4 Parameters of adsorption isotherm model fitting
由表4可知,Freundlich模型擬合效果較好,R2均在0.93以上,表明非均質多層吸附在反應過程中發揮明顯作用。3個溫度梯度下的K值<1,n值>1,說明陶粒與Cr(VI)之間的反應容易發生。K值反映陶粒吸附性能的強弱,溫度升高,K值增大,表明升高溫度會促進陶粒對Cr(VI)的吸附。
3 結論
(1)吸附劑吸附機理:煤系高嶺土在800 ℃條件下煅燒變為偏高嶺土,內部有機質揮發,自由水和部分結合水脫去,內部孔徑和比表面積增加,層間距增大,孔隙增多,加入消石灰作為活性激發劑,在化學增鈣作用下,激發了高嶺土的火山灰活性,硅鋁活性位點進一步增多,因而促進了對Cr(VI)的吸附。
(2)最佳吸附條件:40 ℃,溶液pH為6,初始濃度為180 mg/L,投加量為16 g/L,時間240 min,陶粒對Cr(VI)的吸附量達到7.58 mg/g。
(3)陶粒吸附劑對Cr(VI)的吸附是吸熱反應,可以自發進行,準二級動力學和Freundlich等溫線模型對該反應過程可以實現很好的擬合。

