流產性轉錄本及流產性起始的研究現狀和進展
閆偉偉 秦少偉 趙利峰,2*
(1 塔里木大學生命科學學院,新疆 阿拉爾843300)
(2 新疆生產建設兵團塔里木盆地生物資源保護利用兵團重點實驗室—國家省部共建培育基地,新疆 阿拉爾843300)
流產性轉錄本(abortive transcript, AT)是一類特殊的非編碼RNA,是指在基因轉錄的起始階段由RNA 聚合酶重復合成并釋放的許多短片段初生RNA,該現象被稱為流產性起始[1-3]。自被發現以來,流產性起始的發生機制以及流產性轉錄本的生物學作用一直都是一個未解之謎。為此國內外科研人員也在不停地對它們進行著探索。近年來隨著實驗技術的發展,它們的神秘面紗也在被逐漸揭開。
1 流產性轉錄本和流產性起始的發現
1976 年Johnston 等在冷泉港實驗室發現,RNA聚合酶的延伸反應在缺少兩種NTP 的轉錄體系中被阻止,出乎意料的是,這些新生RNA 被快速釋放出來。然而他們很快又有了新的發現:當四種NTP均存在的情況下RNA 聚合酶開始轉錄后仍然產生長度不等的流產性RNA,長度范圍為2~8 nt[4]。1980 年,Carpousis 等再一次在體外實驗中檢測到了2~6 nt 長度不等的流產性RNA,并將其命名為流產性轉錄本(abortive transcript,AT)。同時發現在所有長度不等的流產性轉錄本中,2 nt 長的占比例最大,約占總量的50%[5]。后來其他研究者在體外轉錄實驗中也得到了類似的研究結果,發現流產性轉錄本的長度一般在2~10 nt 之間,最長可達19 nt[6]。流產性起始的重復過程被稱為流產性循環,通常要經過10~100 個循環以后,RNA 聚合酶才能從啟動子上逃逸出來,開始正常轉錄。體外實驗發現,流產性起始普遍發生在細菌、古菌、真核生物和噬菌體等基因轉錄起始階段[6]。2009 年Goldman 等首次在大腸桿菌(Escherichia coli)體內證明了流產性起始現象的存在[7]。
2 流產性轉錄本和流產性起始的發生機制及影響因素
流產性轉錄本和流產性起始一經發現就立刻引起了世界各地科學家的興趣。自它們被發現以來的40 余年時間里,流產性轉錄本與流產性起始的研究從未間斷,科學家們對流產性轉錄本和流產性起始的發生機制研究也有了許多成果。
研究發現,流產性轉錄本的發生和RNA 聚合酶中σ 亞基的結構有關。σ 亞基中連接其2 個功能域(σ3 和σ4)之間的鏈環靠近RNA 聚合酶的活性位點,且位于全酶釋放RNA 產物的通道內,可能具有阻止RNA產物延伸的作用。該鏈環與初生RNA之間對該通道的占據存在競爭作用,當鏈環贏得競爭時,初生RNA 則以流產性產物—流產性轉錄本的形式釋放出來;當RNA 分子鏈成功延伸超過12 nt 時,新生成的RNA 鏈則可將該鏈環置換出來,這時流產性起始停止[8]。σ 亞基的1.2 區能夠與轉錄起始位點-4 位發生作用,從而促進轉錄起始位點下游DNA 解旋,但該過程中σ 亞基1.2 區需要β 亞基lobe 區的協助,流產性起始發生的原因可能在一定程度上與σ 亞基1. 2區和β 亞基lobe 區不能正常打開下游DNA 雙鏈有關[9]。另外,σ 亞基的3. 2 區在RNA 聚合酶中的位置、His-β1237的突變和β 亞基S531的突變均能改變流產性起始發生的水平[10-13]。
從流產性轉錄起始到全長RNA 合成的轉換過程被稱作啟動子逃逸(promoter escape)[6]。流產性轉錄本產生的原因也與啟動子逃逸的過程密切相關。流產性起始產生的蜷縮模型認為(見圖1),由圖可以看出:在轉錄的起始階段,RNA 聚合酶固定在啟動子上并不移動,而是將聚合酶下游的DNA 募集到聚合酶里來,DNA 在聚合酶里以單鏈泡形式堆積,在此過程中形成具有DNA 解旋應力和DNA 壓縮應力的中間體,其中累積的應力用于破壞RNA 聚合酶與啟動子DNA之間以及RNA聚合酶與起始因子之間的相互作用。當RNA 聚合酶與啟動子DNA 以及起始因子的作用力被破壞后,RNA 聚合酶才從啟動子上逃逸進入轉錄的延伸階段[14],并且在轉錄的起始階段,當新合成的轉錄本達6 nt和7 nt時,RNA 聚合酶有一個短暫的停留,這導致7 nt 和6 nt 長的流產性轉錄本含量相對也較高[14,15]。研究發現,啟動子序列與其保守序列越接近越不容易逃逸,所產生的流產性轉錄本就越多[16]。同時啟動子序列還影響流產性轉錄本的長度,15 nt 流產性轉錄本就是在啟動子突變的T5 噬菌體N25基因轉錄實驗中發現的[6]。
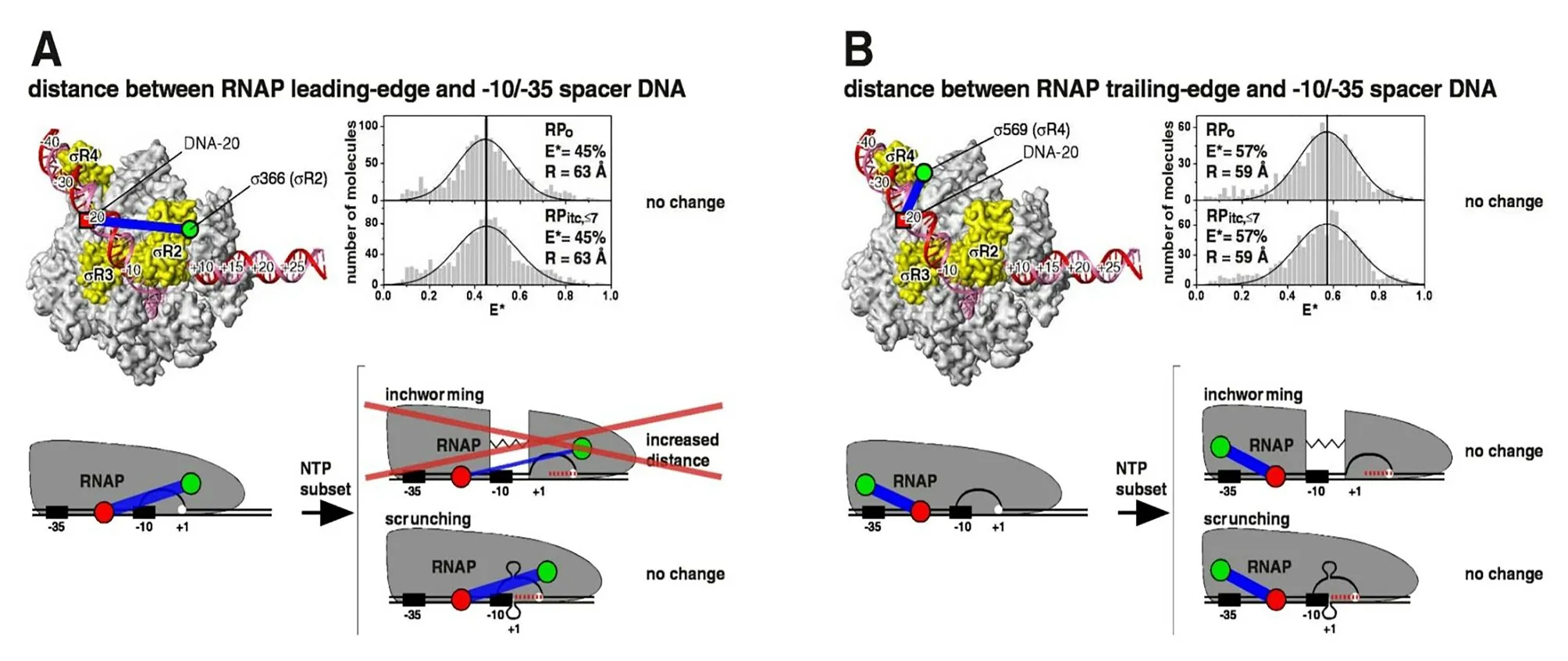
圖1 流產性起始的蜷縮模型
此外,流產性起始還受到起始轉錄序列、轉錄延伸因子GRE 等的影響。改變轉錄起始序列(如將A變成C,將G變成T)不影響轉錄起始階段轉錄復合物的形成和總體起始轉錄的水平,但可以使全長mRNA的合成降低10~25 倍[17,18]。研究發現,轉錄延伸因子GRE 能降低流產性起始的發生。當新生轉錄本3′端的-OH 不與RNA 聚合酶的催化位點接觸時,RNA 聚合酶停止轉錄。此時GRE能與停止轉錄的RNA聚合酶相互作用,誘導聚合酶對新生轉錄本的切割反應,重新激活RNA 聚合酶的轉錄活性[19,20]。通用轉錄因子TFIIB 則能促進流產性起始的發生,在真核生物和古菌基因的轉錄起始階段,TFIIB 能通過促進RNA 聚合酶的招募,從而刺激流產性起始的發生[21]。
3 流產性轉錄本和流產性起始的生物學作用
眾所周知,生物體對自身基因表達以及物質和能量代謝有著嚴格的調控機制。因此,流產性轉錄本和流產性起始絕非是生命體無意義的行為。雖然目前關于流產性轉錄本生物學作用和流產性起始的生物學意義知道的很少,但一些研究工作表明流產性轉錄本是具有生物學作用的。在它們被發現以來的40 多年里,研究人員對流產性轉錄本的生物學作用進行了深入探索,也取得了許多有意義的成果。
流產性轉錄本有可能以引物的形式參與RNA 和DNA 的合成。通常,所有細胞中轉錄起始都是利用單核苷酸作為起始逐一合成一條長鏈RNA。但是體外關于引物依賴的轉錄起始研究表明,無論是真核生物還是原核生物的RNA 聚合酶都能利用2~8 nt長度不等的寡聚核苷酸來引發轉錄的起始[22-30]。2011 年,Goldman 等發現在大腸桿菌體內的RNA 聚合酶利用2~4 nt人工合成的流產性轉錄本引發轉錄起始,同時發現能作為引物的流產性轉錄本在序列和長度上有著極其嚴苛的要求,只有長度在2 nt 到4 nt之間,序列與DNA 模板鏈互補,且5′端在-3到+1之間,3′端在+1 到+3 之間的流產性轉錄本才能夠作為引物促進轉錄[31,32]。還有研究發現,原核生物T7 RNA 聚合酶通過合成引物啟動DNA 的復制。φ1·1B 啟動子的最短引物長度是8 nt,因此8 nt 的流產性轉錄本可作為DNA 復制的引物。早期DNA 復制系統似乎利用了DNA 依賴性RNA 聚合酶的流產性循環,這種循環在“DNA World”出現前就已存在,原始RNA 聚合酶的進化可以引發DNA 的復制。因此,流產性循環可能在“DNA World”的進化中發揮著重要作用[33]。
流產性轉錄本有轉錄抑制的作用。體外轉錄實驗表明,流產性轉錄本的長度主要在2~10 nt,最長到19 nt,且主要集中在2 nt、4 nt、6 nt 和7 nt[7,14]。研究發現如果通過抑制短鏈核酸酶的作用來增加細胞內長度小于或等于4 nt短寡核苷酸的濃度,一些基因的表達水平增加,但另一些基因的表達水平則降低[31]。根據Goldman 等總結的規律,2 nt 和3 nt 的流產性轉錄本可以促進自身基因的轉錄,那么其余不能作為引物的短寡核苷酸則可能具有轉錄抑制作用,而大于或等于4 nt的流產性轉錄本并不符合上述作為引物的要求,所以也可能具有轉錄抑制作用。2016 年,Qin SW 等利用體外轉錄實驗結合實時熒光定量PCR(quantitative real-time PCR, qRT-PCR)技術,檢測了3 個大腸桿菌基因meta(homoserine Osuccinyltransferase)、ompa(outer membrane porin A)和reca(recombinase A)的4 nt 和6 nt 流產性轉錄本對自身基因和其它基因轉錄的影響,發現流產性轉錄本對自身和其它基因的轉錄均具有抑制作用,且最大抑制率可達7.5 倍(圖2),認為流產性轉錄本可能通過影響轉錄延伸復合物的穩定性從而影響轉錄的進行[34]。
流產性轉錄本可能還有其他的生物學作用。研究還發現,噬菌體T710φ 基因產生的流產性轉錄本富含G,恰好能與其終止子上兩個5 nt和6 nt長、富含C 的延伸序列相互作用,阻止發夾結構的形成,從而抑制轉錄終止[35]。含有短RNA的轉錄復合物的X射線晶體結構揭示了三種結構狀態:一種是具有2 nt和3 nt 的RNA,其中只有RNA 的3'末端是可檢測的;第二種狀態是具有4 nt 和5 nt 的RNA,此時RNA-DNA雜合體具有嚴重扭曲的構象;還有一種具有6 nt或更長RNA 的第三種狀態,這種狀態基本上與穩定的延伸復合物相同。從第一狀態到第二狀態的轉變與顯著降低的流產起始頻率有關。從第二狀態到第三狀態的轉變與部分“氣泡坍塌”(bubble collapse)和促進啟動子逃逸有關。學者推測在這個過程中流產性起始可能起著啟動子控制的檢驗點(checkpoint)和校正點(calibration point)作用[36]。
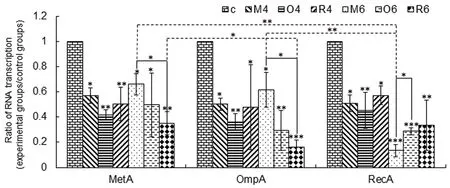
圖2 被不同流產性轉錄本干擾后基因表達水平的變化
4 展望和小結
盡管流產性轉錄本和流產性起始的發現至今已有40 余年,但依然存在許多未知的謎團。目前對于流產性起始發生機制的研究相對較多,但對于流產性轉錄本的生物學功能研究仍然處于起步階段。制約流產性轉錄本研究的瓶頸主要是自然產生的流產性轉錄本長度一般不超過10 nt,用qRT-PCR 或常規探針方法無法對其進行定量檢測。目前檢測較短流產性轉錄本的方法有兩種。其中一種是基于特定轉錄模板和P32標記NTP 的體外轉錄實驗,這種方法只能在體外通過放射自顯影技術檢測流產性轉錄本的長度和含量,并不能對流產性轉錄本的序列進行鑒別,也無法對機體內自然產生的流產性轉錄本進行定性和定量分析。另一種則是利用鎖核酸探針對流產性轉錄本進行檢測。鎖核酸(locked nucleic acid,LNA)是一種類寡核苷酸衍生物,其結構中的β-D-呋喃核糖的2'-O、4'-C 位通過縮水作用形成剛性的結構,該結構能降低單體中核糖結構的柔韌性,增強局部磷酸骨架穩定性。研究表明在探針的核酸序列中每增加一個鎖核酸單體能夠使寡核苷酸鏈的解鏈溫度提高2~8℃,從而提高其與目標序列的結合能力,且比常規的寡核苷酸具有更高的專一性[37]。Goldman 等正是用鎖核酸探針實現了對啟動子突變的T5噬菌體N25 基因產生的11 nt長流產性轉錄本的直接檢測[7],該方法較第一種研究方法的優勢是可以對特定序列的流產性轉錄本進行體外檢測,但仍然無法對生物體內自然產生且10 nt以下的流產性轉錄本進行定量檢測。目前,檢測技術的發展進步很快,單分子檢測、熒光原位雜交等新技術正越來越多地得到應用。如果能對機體內的流產性轉錄本實現定性和定量檢測,則可以在機體內利用轉基因技術人為干擾某一基因流產性轉錄本的含量,從而確定流產性轉錄本的生物學功能。同時,生物體內流產性轉錄本比全長轉錄本高幾十倍甚至上百倍的含量還使其具有成為腫瘤或其他疾病標志物的潛在可能,在未來臨床分子診斷和檢測中有著潛在的應用價值,一旦在檢測技術上取得突破,流產性轉錄本將可能成為一種新型生物標志物為人類健康做出巨大貢獻。
總之,流產性起始的發生由RNA 聚合酶的結構和RNA 轉錄起始的模式所決定,是RNA 轉錄中必不可少的一種生物學現象,普遍發生在一切以RNA 聚合酶為特征的生物的每一次轉錄中。目前,對流產性轉錄發生的機制已基本了解,對其生物學作用知道的仍然不多,但其存在的廣泛性暗示其可能有重要的生物學作用,最新的研究也表明流產性轉錄本在基因的轉錄過程中具有重要的調控作用。相信隨著對體內10 nt 以下的寡核苷酸定量檢測技術的發展,一定能有效解決目前流產性轉錄本的體內定量檢測的問題,也終將對流產性轉錄本的生物學功能作出闡釋。

