激光打孔脫細胞基質復合骨髓間充質干細胞構建組織工程氣管軟骨
徐勇 劉春燕 劉延群 李亞強 段亮 姜格寧
組織工程氣管的研究已有近30年的歷史[1],雖然長段氣管缺損的修復依然是目前無法解決的難題,但仍然取得了巨大的進展。研究表明,組織工程氣管因生物相容性好、免疫排斥反應少、生物活性好,以及相關組織細胞再生培養等多方面的優點,而被認為是最理想、最符合生理要求的氣管缺損修復的方向。
骨髓間充質干細胞(BMSCs)具有來源充足、取材方便、創傷小、增殖能力強、無排斥反應、不存在倫理問題等優點,是目前較為理想的種子細胞。但是BMSCs易分化成骨,因此單純應用BMSCs構建完整氣管軟骨組織難度較高。尋找一種能誘導BMSCs穩定向軟骨分化的材料顯得尤為重要。
同種異體氣管脫細胞基質具有原始的管狀結構、天然的細胞生存環境和適宜的力學性能,被認為是最理想的支架材料。有文獻報道,脫細胞軟骨基質能誘導BMSCs向軟骨分化[2-4],BMSCs與氣管脫細胞軟骨基質復合構建組織工程氣管軟骨具有較大的可行性。但氣管脫細胞基質的組織結構致密,細胞無法在基質內部深入生長,使得構建的氣管管壁軟骨再生不全,并會隨著基質的降解,而導致移植段氣管軟化塌陷,而使其無法真正用于臨床[5-7]。
本研究采用激光打孔技術對氣管軟骨基質進行激光打孔處理,以增加其孔隙率,再進行脫細胞處理,形成激光打孔脫細胞基質(LDTM)支架材料。隨后復合BMSCs并植入兔皮下,擬在兔體內培養12周,以期能成功構建具有較成熟軟骨組織形態和一定力學強度的完整的組織工程氣管軟骨。
1 材料與方法
1.1 實驗試劑及儀器
胰蛋白酶(Hyclone公司,美國);低糖DMEM培養基(Hyclone公司,美國);高糖DMEM培養基(Hyclone 公司,美國);胎牛血清(Hyclone 公司,美國);青霉素-鏈霉素-兩性霉素B(Hyclone公司,美國);磷酸鹽緩沖液(Hyclone公司,美國);生物力學分析儀(Instron公司,美國),DNA含量檢測試劑盒(天根生化科技有限公司),GAG阿爾新藍法檢測試劑盒(生工生物工程股份有限公司);總膠原蛋白檢測試劑盒(北京博蕾德生物科技有限公司)。
1.2 實驗動物
6周齡新西蘭白兔10只(上海甲干生物科技有限公司),體質量約2.5 Kg,雌雄不限。本實驗遵守實驗動物倫理原則。
1.3 氣管基質的獲取
清潔條件下切取新西蘭兔氣管約2.5 cm(約8~10個氣管環),仔細剔除多余組織,置入PBS保存液,4℃備用。共5個樣本。
1.4 氣管基質激光打孔
將上述氣管樣本表面水分擦干,往管腔插入相應外徑的內支撐棒并放置在打孔處。CO2激光打孔機以10 W功率和17 ms的脈沖時間,重復打孔4次。然后將打孔后的樣本浸在PBS溶液中,超聲波清洗機持續清洗30 min,直到將氣管內碳化的組織去除干凈。
1.5 激光打孔氣管基質進行脫細胞處理
①將樣本浸于蒸餾水中,4℃恒溫振蕩48 h,每12 h更換一次蒸餾水;②4%脫氧膽酸鈉(1∶10)4 ℃恒溫振蕩4 h;③PBS 4℃振蕩漂洗1 h,每15 min更換一次 PBS;④酶消化液(1∶10)25 ℃振蕩 3 h;⑤PBS 4℃振蕩漂洗1 h,每15 min更換一次PBS;⑥循環重復②~⑤步驟,共計循環12次。
1.6 BMSCs的分離培養及擴增
10 mL注射器吸入含肝素的生理鹽水2 mL,于實驗兔股骨髁處穿刺入股骨髓腔,反復緩慢輕揉沖洗髓腔,獲取含BMSCs的混懸液。按BMSCs常規分離培養方法,獲得第2代BMSCs備用。
1.7 BMSCs-LDTM復合物體內培養
將第2代BMSCs制備成1.0×108cells/mL的混懸液,均勻接種于支架上,37℃、5%CO2、飽和濕度下放置4 h。5只新西蘭大白兔麻醉后,背部剃毛消毒后作3 cm皮膚切口,并且分離皮下組織,于肌肉上層形成一個小腔隙。再將BMSCs-LDTM復合物植入該腔隙中,縫合傷口。術后連續3 d肌注青霉素200萬單位預防感染,每天2次。分籠飼養,自由活動。于術后12周取材檢測。
1.8 組織學檢測
取脫細胞前后標本以及體內培養12周后的標本,大體觀察后將標本以4%多聚甲醛固定24 h,脫水、石蠟包埋,切片 (厚度為5 μm),HE染色及Safranin-O染色,觀察組織結構及細胞外基質分泌情況。用免疫組織化學的方法檢測Ⅱ型膠原(軟骨組織特異性細胞外基質)的表達情況,進一步證明構建組織的軟骨表型[8]。
1.9 生物力學與生物化學檢測
1.9.1 生物力學檢測
取脫細胞前后標本及體內培養12周后的標本,剪成0.5 cm×1 cm的小塊,置于生物力學分析儀上,沿垂直氣管壁方向以1 mm/min的速度壓縮,直到樣本組織變形。記錄力與位移曲線和最大拉斷力,并計算楊氏模量。
1.9.2 生物化學檢測
將樣品置于木瓜蛋白酶溶液(Sigma-Aldrich)中于65℃消化12 h。按試劑盒方法,用阿爾新藍法檢測硫酸化糖胺聚糖(GAG)含量[9]。在乙醇提取和吸附柱吸附后,在洗脫緩沖液中回收基因組DNA。用核酸蛋白質定量檢測器(Nanodrop2000)檢測DNA含量。用羥脯氨酸測定法檢測總膠原含量。通過堿水解制備樣品,根據先前描述的方法測定游離羥脯氨酸水解產物[10]。以上所有樣品的分析重復3次。
1.1 0 統計學分析
采用 GraphPad Prism 軟件(Version 5.00,Graph-Pad Software,美國),數據以(x±s)表示,組間比較采用非配對t檢驗,P<0.05表示差異有統計學意義。
2 結果
2.1 氣管軟骨激光打孔
兔體內的天然氣管是表面光滑的瓷白色管狀軟骨樣組織(圖1A),而激光打孔后表面形成規則的點陣狀排列的微孔結構,且保留原始管狀結構(圖1B)。
2.2 激光打孔氣管基質脫細胞處理
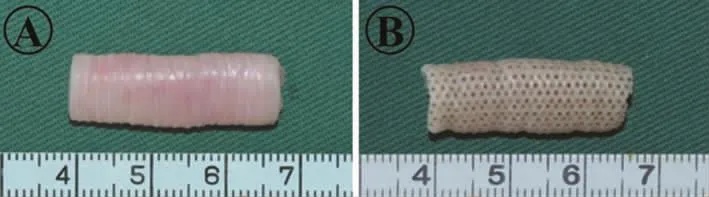
圖1 天然氣管和激光打孔后的大體觀察Fig.1 Gross observation of native trachea and after laser drillin
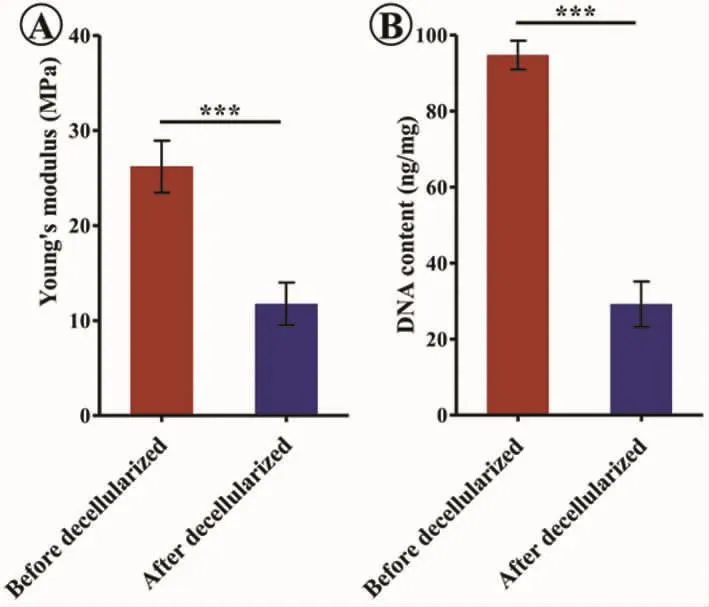
圖3 脫細胞前后楊氏模量和DNA殘余量對比(P<0.001)Fig.3 Comparison of Young's modulus and DNA content before and after decellularization(P<0.001)
經過脫細胞處理后,氣管軟骨基質大體基本不g變,且仍能維持其原始的管狀結構(圖2A、D)。組織學觀察顯示,軟骨陷窩里的細胞成分基本去除 (圖2B、C、E、F);DNA 定量檢測同樣證實脫細胞后比脫細胞前DNA含量明顯減少(圖3B)。同時,組織學觀察顯示,脫細胞后氣管基質結構出現一定程度松散和破壞(圖2E、F);力學測試結果顯示脫細胞后氣管基質的楊氏模量下降(圖3A)。
2.3 BMSCs-LDTM支架復合物體內培養12周
兔體內培養12周后,大體觀察顯示BMSCs在LDTM支架表面及微孔內均勻分泌基質,并形成新的管狀軟骨,微孔結構基本上被新生軟骨組織填充。該構建的軟骨具有明顯的瓷白色特征,且具有較好的彈性和韌性(圖4A、B)。HE和Safranin-O染色顯示,大量軟骨細胞外基質和均勻的特異性軟骨陷窩形成,Ⅱ型膠原免疫組化進一步證明了所構建的組織為均勻的軟骨組織(圖4C-F)。組織學顯示,新生軟骨通過激光微孔完全長入支架內部,并形成完整的整體,且新生的管狀軟骨保有了原始的氣管管狀結構。
生物力學(楊氏模量)檢測顯示,該新生氣管軟骨具有天然氣管類似的力學強度。生物化學(DNA含量、GAG含量和總膠原含量)分析顯示新生的軟骨均接近天然軟骨(P<0.05)(圖 5)。
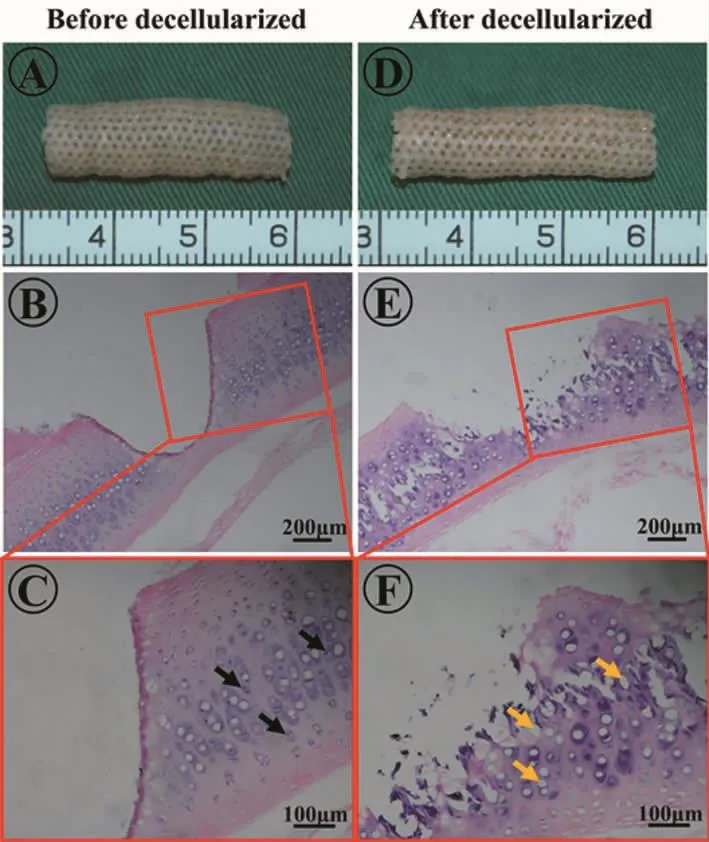
圖2 激光打孔氣管基質脫細胞前后對比Fig.2 Comparison of laser drilling trachea matrix before and after decellularization
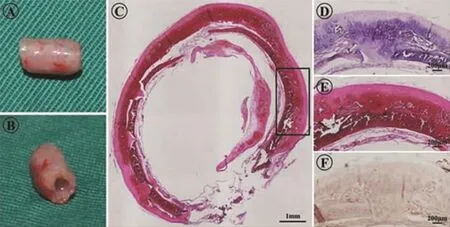
圖4 兔體內培養12周的新生氣管軟骨Fig.4 Engineered trachea cartilage after cultured for 12 weeks in vivo
3 討論
氣管具有重要的生理功能,包括呼吸、咳嗽、清除分泌物等,氣管缺損的修復極為困難。組織工程氣管被認為是最理想、最符合生理要求的氣管替代物。但迄今為止,構建的組織工程氣管仍無法真正地應用于臨床。
氣管脫細胞基質一直被認為是理想的組織工程氣管支架材料。本研究將CO2激光打孔技術應用到兔氣管基質,以改進其結構致密的缺陷。通過CO2激光打孔技術可以在兔氣管基質表面精確地打出點陣狀排列的激光微孔,在擴大其孔隙率的同時又能保持其原始的3D管狀結構和一定的力學強度。此外,我們設想因為這些微孔的存在,可以增加氣管基質與脫細胞液體的接觸面積,從而使脫細胞過程更加快速徹底,甚至在接種BMSCs后,這些微孔可以促進營養的滲入,更有利于軟骨的再生。
激光打孔的原理是利用激光脈沖束聚焦于材料上,使焦點處的材料因高溫而熔化和氣化,當脈沖結束后,即可形成圓錐狀的微孔。激光束功率越大、作用時間越長,重復次數越多,所得到的激光微孔孔徑就越大[11]。如果激光功率過大,作用時間太長,重復次數過多,對氣管基質的損傷也越大,甚至破壞氣管原有的管狀結構和力學強度。如果激光功率太小,作用時間太短,重復次數過少,使得氣管基質的孔隙率又太低。為了在保證氣管基質完整的3D管狀結構和足夠力學強度的條件下盡可能增加氣管基質的孔隙率,我們對兔氣管基質激光打孔參數進行了大量探索。我們認為在10 W的功率、17 ms的脈沖時間和重復打孔4次的情況下,所得到的激光微孔最為理想。
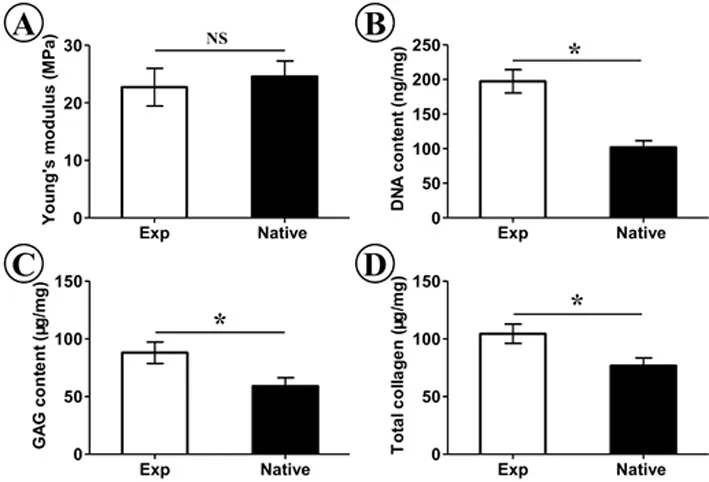
圖5 新生氣管軟骨生物力學和生物化學檢測(*:P<0.05)Fig.5 Biomechanical and biochemistry analyses of engineered trachea cartilage(*:P<0.05)
本實驗沿用DOA聯合核酸酶的方法制備氣管脫細胞基質[5,12-13],但這種脫細胞方法應用于氣管微孔脫細胞基質制備卻是首次,因此需要重新摸索最佳的脫細胞循環次數和最佳的酶消化溫度,以制備去除免疫原性且保留一定力學強度的激光微孔脫細胞基質。本實驗前期對比了4℃、25℃和37℃的酶消化溫度的作用效果,發現在4℃的低溫條件下,雖然可以最大程度保護氣管基質不受破壞,但是由于該溫度下酶消化效率不高,很難將細胞去除干凈;而37℃雖然酶消化效率高,但是卻對氣管基質破壞嚴重;只有在25℃條件下,才能在保證較高的酶消化效率的同時,又保證氣管基質不至于破壞嚴重。
本研究將BMSCs-LDTM復合物植入兔皮下12周,驗證了LDTM體內誘導BMSCs構建軟骨的可行性。組織學觀察顯示,可再生出均質、典型的軟骨組織。同時,組織學、軟骨特異性基質定量及生物力學結果均顯示,兔體內再生軟骨組織接近于天然氣管。這可能得益于①激光產生的微孔結構,有利于營養交換,又促進了軟骨細胞在整個LDTM表面及內部結構的分布,促進了相對均質的軟骨再生;②皮下環境豐富的毛細血管系統可為植入組織提供物質交換的動力;③激光微孔脫細胞基質保留軟骨的天然成分,如Ⅱ型膠原、糖胺多糖等,為軟骨再生提供了理想的微環境,促進了BMSCs向軟骨分化[14];④LDTM基于天然材料制備,避免了免疫炎癥反應,有利于軟骨組織穩定再生;⑤激光微孔脫細胞基質產生了一些生長因子,如轉化生長因子β家族、胰島素生長因子,為軟骨分化和成熟提供了促進因子[15-17]。
綜上所述,LDTM是一種理想的氣管組織工程支架,不僅可解決軟骨脫細胞基質結構致密的問題,也可在體內環境誘導BMSCs穩定再生氣管軟骨。下一步我們將基于該模型探索對長段氣管缺損進行修復,以期實現真正意義上的氣管功能性修復,并未今后的臨床應用奠定基礎。

