JNK抑制劑對軟骨細胞外基質合成的作用研究
劉延群 賈立濤 劉春燕 陳潔 周廣東
骨關節炎(Osteoarthritis,OA)是臨床常見疾病[1],病因復雜,目前尚缺乏有效的治療方法。OA與多種危險因素有關,包括遺傳因素、組成因素以及促成OA發展的若干化學和生物力學風險因素,導致關節軟骨基質的合成和降解之間的不平衡。大量證據表明,OA是一種退行性關節疾病,其特征是軟骨細胞死亡,軟骨細胞外基質(ECM)損失[2],這亦是OA發生發展的主要原因[1-3]。
研究表明,JNK抑制劑可以有效減少危險因素對OA細胞外基質的破壞。JNK與ERK途徑激活c-Jun,通過調節促炎癥細胞因子(如TNFα和IL)的表達,導致蛋白多糖合成減少和軟骨降解酶MMP-13的產生增加[4-6]。抑制JNK途徑可能是預防和治療OA的方式之一[7]。本課題擬通過研究JNK抑制劑(SP600125)對軟骨細胞外基質合成的影響,為JNK抑制劑在OA治療中的應用提供前期研究基礎。
1 材料與方法
1.1 實驗試劑及儀器
DMEM 培養液(Gibco公司,美國)、0.05%胰蛋白酶(Gibco公司,美國)、0.25%Ⅱ型膠原酶、鏈霉素、青霉素(Gibco公司,美國),胎牛血清(HYCLONE公司,美國),CCK-8試劑盒(同仁化學,日本),無紡聚乙醇酸(PGA)纖維(組織工程國家工程研究中心提供),SP600125(ADOOQ 公司,美國),SEM(Philips XL-30, 荷蘭), 連續熒光檢測器(Stratagene MX3000P,美國)。
1.2 實驗動物
6周齡新西蘭白兔1只 (上海甲干生物科技有限公司)。本實驗遵守實驗動物倫理原則。
1.3 獲取兔耳軟骨細胞
取兔耳軟骨,將軟骨片切碎成1.0 mm3大小,置于DMEM中,0.25%Ⅱ型膠原酶37℃消化8 h。然后將收獲的軟骨細胞接種到含有10%胎牛血清(FBS)和1%青霉素、鏈霉素的DMEM培養皿(10cm)中,37℃、5%CO2下培養。取第2代軟骨細胞進行后續實驗。
1.4 實驗分組
實驗組培養液:含有10%FBS、1%青霉素、鏈霉素和 JNK 抑制劑(SP600125,濃度 100 nmol/mL)的DMEM培養液;對照組培養液:含有10%FBS和1%青霉素、鏈霉素的DMEM培養液。
1.5 支架材料的制備
取適量的PLA粉末,用二氯甲烷配制成濃度為0.5%的溶液。稱取15 mg PGA纖維放進針筒內,分次滴加少許0.5%PLA溶液,將PGA/PLA聚合物壓成直徑9 mm、厚2 mm的柱狀細胞支架,掃描電鏡下拍照,75%乙醇消毒后備用。
1.6 細胞-支架復合物的制備
調整第2代軟骨細胞密度為8×107cells/mL,將細胞懸液均勻地滴加在已消毒的PGA/PLA材料上,37℃、5%濃度CO2、100%飽和濕度條件下培養,4 h后樣本隨機分組,對照組加普通血清培養液,實驗組添加SP600125工作液;兩組細胞-支架復合物均在37℃、95%濕度和5%CO2下培養8周。
1.7 CCK-8法測定細胞增殖情況
將第2代軟骨細胞(P2)以2 000個/孔的密度接種于96孔板,加入100 μL PBS以防止水分丟失。實驗組各孔加入100 μL SP600125工作液,對照組各孔加入100 μL普通培養液。兩組均常規培養,隔天全量更換相應培養液。體外培養11 d,從第1天開始,隔天每組取5個孔加入10 μL的CCK-8試劑,培養箱內孵育120 min,酶標儀450 nm波長處測定吸光度值,每組均設一個空白對照孔(單純培養基,沒有細胞),實驗重復3次,繪制生長曲線。
1.8 RT-PCR
體外培養8周后,每組分別提取組織樣品的總RNA,通過反向聚合酶轉錄(RT)獲得cDNA。用連續熒光檢測器進行RT-PCR反應,檢測軟骨特異性基因 IGF、COLⅡ、COLⅨ、TGF-β1 的表達情況。 將 βactin mRNA設為內參(表1)。
1.9 組織學觀察
將體外培養8周后的細胞-支架復合物在多聚甲醛中固定48 h,石蠟包埋,5μm切片,行HE染色與Safranin-O染色。
1.1 0 統計學分析
采用 GraphPad Prism軟件(Version 5.0,美國)行統計分析,數據以(x±s)表示,組間比較采用非配對t檢驗,P<0.05表示差異有統計學意義。
2 結果
2.1 SP600125對體外軟骨細胞增殖的影響
CCK-8檢測結果顯示,實驗組軟骨細胞的增殖明顯快于對照組(圖1)。
2.2 細胞-支架復合物的構建
PGA/PLA支架形狀規整,表面粗糙;掃描電鏡顯示,PGA/PLA支架的孔徑多大于100 μm;細胞-支架復合物中細胞在支架表面分布均勻,呈淡黃色(圖 2)。
2.3 RT-PCR檢測軟骨相關特異性基因的表達
細胞-支架復合物體外培養8周后,RT-PCR結果顯示,實驗組 IGF、COLⅡ、COLⅨ、TGFβ1 的表達均顯著下降,與對照組差異明顯(P<0.01)(圖 3)。
2.4 組織學觀察
HE染色顯示,與對照組比較,實驗組經體外培養8周后,再生軟骨質量顯著下降,軟骨厚度降低,軟骨陷窩的成熟度較差;Safranin-O染色結果顯示,相較與對照組,實驗組軟骨細胞外基質的合成量顯著降低(圖 4)。

表1 引物序列Table 1 Primer sequence
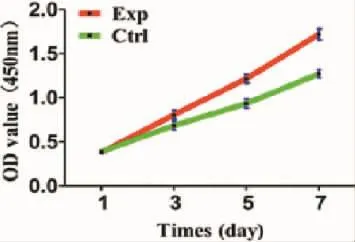
圖1 各組細胞增殖曲線Fig.1 Cell proliferation curve of each group

圖2 細胞-支架復合物的構建Fig.2 The construction of cell-scaffold complex
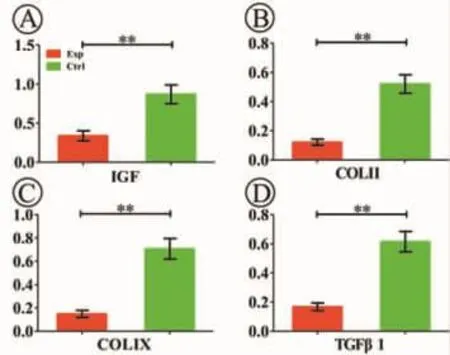
圖3 RT-PCR檢測各組軟骨特異性基因的表達(**:P<0.01)Fig.3 Cartilage specific gene expression of each group detected by RT-PCR(**:P<0.01)
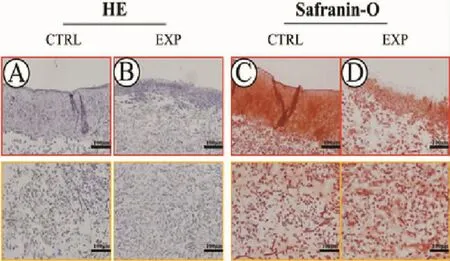
圖4 各組組織學觀察Fig.4 Histological observation of each group
3 討論
骨關節炎(OA)是一種以關節軟骨退行性變和關節周圍骨質增生為病理性特征的慢性進行性骨關節病。關節軟骨是由軟骨細胞分泌軟骨細胞外基質形成的,軟骨細胞是維持軟骨細胞外基質合成和更新的關鍵,軟骨細胞的逐漸喪失和細胞外基質的降解被認為是骨關節炎發生發展的主要原因[8-9]。其中,TNF-α、白細胞介素等炎癥因子,在OA的發生和發展過程中發揮了重要作用。抑制IL-1β和TNF-α的表達可能是治療OA的有效途徑。
研究表明,JNK途徑通過激活下游因子c-Jun而促進促炎癥細胞因子的表達,如TNFα、IL-6、IL-1等,導致細胞外基質蛋白多糖合成減少和軟骨降解酶MMP-13的產生增加。因此,JNK途徑抑制劑被認為可能是一種治療骨關節炎的有效途徑[7,10]。JNK信號通路是一種重要的蛋白激酶,在細胞的增殖、分化、存活以及凋亡中扮演重要的角色。然而,JNK通路抑制在不同組織、不同細胞、不同病理環境下,其作用不盡相同。研究顯示,JNK通路抑制劑SP600125對胃癌細胞的增殖有抑制作用。Che等[11]的研究表明,在食管鱗癌細胞中可通過激活JNK通路而發揮其抗腫瘤作用。另有研究表明,抑制JNK通路的表達可用來促進肝星狀細胞凋亡的發生,最終緩解肝纖維化的程度[12]。目前,JNK通路抑制劑對軟骨細胞的增殖作用仍未明確。本研究通過CCK-8檢測證實,JNK通路抑制劑對軟骨細胞具有顯著的促增殖作用。
抑制骨關節炎中軟骨細胞的減少是延緩甚至阻斷骨關節炎發生發展的關鍵,促進軟骨外細胞基質的合成則是修復關節損傷的重要環節。本研究進一步對JNK通路抑制劑對軟骨細胞外基質合成的影響進行了初步探討。RT-PCR證實了SP600125長期使用可以顯著抑制包括 IGF、COLⅡ、COLⅨ、TGFβ1等在內的軟骨特異性基因的表達。本實驗結果顯示,相較對照組,實驗組軟骨細胞外基質顯著降低,并沒有形成成熟的軟骨陷窩結構。上述結果表明,長期獨立使用JNK抑制劑對軟骨細胞外基質的合成有抑制作用。
綜上所述,本研究結果提示JNK通路抑制劑短期應用對軟骨細胞的增殖有促進作用;JNK通路抑制劑長期單獨應用對軟骨細胞合成軟骨細胞外基質具有抑制作用。雖然JNK通路抑制劑短期應用對軟骨細胞的增殖具有促進作用,但長期應用可抑制軟骨細胞外基質的合成。因此,如何長期安全地應用JNK抑制劑治療OA是今后研究的重要方向。

