基于新型香豆素苯甲酰腙的Zn2+熒光探針研究
夏勝濤,徐珍香,李洪啟*
(1.東華大學 化學化工與生物工程學院,上海 201620;2.蓬萊新光顏料化工有限公司,山東蓬萊 265601)
鋅是生物體內第二豐富的過渡金屬[1],在酶的調控、神經信號傳遞、基因表達等[2-4]各種生理過程中都發揮著重要的作用,是人體必不可缺少的一種微量元素[5]。盡管大多數生物體中的鋅離子與蛋白質緊密地結合,但在某些細胞中“游離鋅”仍然有存在的可能,生活中部分嚴重生理疾病與鋅離子的失衡密密相關,如阿爾茨海默病、肌萎縮性側索硬化癥(ALS)、帕金森病、腦缺血和癲癇等[6-10]。因此,對Zn2+離子特定檢測方法引發也來越多的人關注,到目前為止,鋅離子的研究已經取得了顯著的進展。
傳統的Zn2+檢測方法只適用于生物體外的Zn2+檢測,對生物體內的Zn2+很難有效果。新型檢測方法熒光分析法在這方面尤為突出,它不僅能突破傳統方法的局限,而且還具有高選擇性、高靈敏性和良好生物適用性等優點,因此,設計和合成出新的Zn2+探針具有重要的意義[11]。此外,香豆素類衍生物本身不僅具有較長共軛結構,熒光效果好而且具有Stokes位移大、高熒光量子產率、光穩定性好等優良的光學特性[12-14],能很好作為一種熒光基團,香豆素類衍生物在熒光探針方向的研究成為探針方向的主題,這方面的報道也越來越多。基于以上這兩點,本文設計了一種香豆素類席夫堿Zn2+的熒光探針,該探針對Zn2+具有較好的選擇性和靈敏性,且體系的熒光強度隨著Zn2+濃度增大而增強,在一定的濃度范圍內呈線性關系。
本文以間苯二酚和苯甲酰乙酸乙酯為原料合成4-苯基-7-羥基香豆素(1),再在烏洛托品與醋酸條件下合成4-苯基7-羥基-8-甲酰基香豆素(2),最后與苯甲酰肼反應合成4-苯基-7-羥基-8-(苯甲酰腙基)香豆素(L),化合物的合成路線如圖1所示。

圖1 化合物L的合成路線
1 實驗部分
1.1 儀器與試劑
PY-1型熔點儀(天津市國銘醫藥設備有限公司)、Bruker AM400型核磁共振儀(德國Bruker公司)、Fluoromax-4熒光測試儀(HORIBA Scientific公司)、UV-1700紫外可見分光光度計(日本島津)。
間苯二酚、硫酸、冰醋酸、烏洛托品,均為分析純,購自國藥集團化學試劑有限公司;苯甲酰乙酸乙酯、苯甲酰肼,均為分析純,購自上海泰坦化學有限公司;甲醇,分析純,購自上海實驗試劑有限公司;對甲苯磺酸一水合物,分析純,購自阿拉丁公司。
1.2 化合物L的合成
1.2.1 4-苯基-7-羥基香豆素的合成
將70 mL甲醇逐滴加入到30 mL濃硫酸中,得到無色透明溶液。將間苯二酚(5.5 g,50 mmol)溶于上述100 mL溶劑中,升溫至60℃,在磁力攪拌下使其完全溶解,然后用恒壓滴液漏斗緩慢滴加苯甲酰乙酸乙酯(9.7 g,50 mmol),滴加完畢后繼續加熱攪拌4 h。反應結束,冷卻至室溫,加入冰水,有大量黃色固體析出,靜置后抽濾,將濾餅放入真空干燥箱中干燥,用乙醇重結晶后得到淡黃色固體9.76 g,產率為 82%,m. p. 249~ 251 ℃(文獻值[15]:250.2~250.5℃)。
1.2.2 4-苯基-7-羥基-8-甲酰基香豆素的合成
將4-苯基-7-羥基香豆素(1.19 g,5 mmol)和烏洛托品(7.0 g,50 mmol)溶于20 mL冰乙酸,水浴加熱升溫至90℃,攪拌反應6~8 h后,加入24 mL的17% HCl水溶液繼續反應10 min,待反應結束,冷卻至室溫,將反應液倒入到40 mL蒸餾水中,有大量黃棕色固體析出。靜置后抽濾,干燥,用乙醇重結晶后得到黃綠色固體0.8 g,產率為60%。m. p.120~122℃(文獻值[16]:120℃)。
1.2.3 4-苯基-7-羥基-8-苯腙基香豆素(L)的合成
將4-苯基-7-羥基-8-甲酰基香豆素(1.33 g,5 mmol)、苯甲酰肼(0.68 g, 5 mmol)和對甲苯磺酸(5 mg, 0.025 mmol)溶于30 mL乙醇中,80℃下磁力攪拌回流4 h,TLC跟蹤反應進程。反應結束后,冷卻至室溫,底部有淺黃色固體析出,抽濾,干燥,得到化合物L粗品。采用硅膠柱層析對產物進行提純,洗脫劑PE∶EA=10∶1,得到1.35 g淺黃色固體,產率為70%,m. p. 262~264℃。1H NMR (DMSO, 400 MHz),δ:12.91 (s, 1H); 12.50 (s, 1H);9.21 (s, 1H); 8.00 (d, J=7.3 Hz, 2H); 7.64~7.67 (m,1H); 7.58~7.60 (m, 5H); 7.53~7.54 (m, 2H); 7.37(d, J=8.9 Hz, 1H); 6.95 (d, J=9.0 Hz, 1H); 6.28 (s, 1H)。13C NMR (DMSO, 100 MHz), δ:162.51, 161.24, 159.06,155.48, 153.17, 143.47, 134.84, 132.31, 132.01, 129.70,129.30, 128.85, 128.63, 128.43, 127.63, 113.76, 110.90,110.52, 106.02; HRMS, C23H17N2O4, 實測值(計算值),m/z:385.1180(385.1183)[M+H]+。
2 結果與分析
2.1 探針L的離子選擇性實驗
在CH3CN∶H2O=9∶1(v∶v)溶液中,探針分子L和金屬離子的濃度為40 μmol/L,識別對象為13種常見的金屬離子(Cu2+、Cr3+、Hg2+、Zn2+、Ni2+、Co2+、K+、Li+、Al3+、Fe2+、Sr2+、Ag+、Fe3+)。如圖2所示,當激發波長λex=380 nm,發射波長為λem=495 nm時,Zn2+可使探針L的熒光強度增強8倍左右,Hg2+可使探針L的熒光強度增強4倍,而其他金屬離子對探針L的熒光強度沒有產生顯著的影響。

圖2 探針L對金屬離子的選擇性
2.2 探針L的滴定實驗
在CH3CN∶H2O=9∶1(v∶v)溶液中,探針分子L的濃度不變為20 μmol/L,然后逐漸加大Zn2+濃 度(0、2.0、4.0、6.0、8.0、10.0、12.0、14.0、16.0、18.0、20.0μmol/L和 40.0 μmol/L),如圖3所示,探針L隨著Zn2+濃度增加,熒光強度逐漸增強,達到40 μmol/L時,熒光強度達到最大值,增強約10倍,如圖4所示探針L在加入0~40 μmol/L Zn2+后具有良好的線性相關,相關系數為R2=0.9779。

圖3 探針L隨Zn2+濃度增加的熒光強度變化
2.3 探針L的離子抗干擾性實驗
在CH3CN∶H2O=9∶1(v∶v)溶液中,探針分子L和Zn2+的濃度為40 μmol/L,再加入其他金屬離子40 μmol/L,如圖5所示,標注為I的表示每種金屬離子分別對探針L熒光強度的影響,標注為II的表示加入等濃度的Zn2+后各金屬離子對探針L熒光強度的影響。研究發現,當溶液中Zn2+與其他金屬離子共存時,溶液的熒光強度均會增強,尤其是Cu2+、Ni2+、Co2+、Fe2+、Fe3+這幾種金屬離子與 Zn2+共存時,對體系熒光強度影響較大,導致不能很好地檢測Zn2+,所以該探針的抗離子干擾性較差,離子共存后靈敏性受到了一定的影響。

圖4 探針L熒光強度與Zn2+濃度線性圖

圖5 不同金屬離子對探針L檢測Zn2+的干擾性
2.4 pH對探針L穩定性實驗
在CH3CN∶H2O=1∶9(v∶v)溶液中,探針分子L和Zn2+的濃度為10 μmol/L時,測定了pH對探針L識別Zn2+的影響。圖6為酸性條件下,不同pH值對溶液熒光強度的影響,發現探針L最大發射波長從495 nm紅移到515 nm,隨著pH值的升高,溶液熒光強度逐漸增強,當pH=7時,達到最大值;pH=1或2時,探針L熒光強度極低,探針L穩定性差。圖7為堿性條件下,不同pH值對溶液熒光強度的影響,發現探針L最大發射波長從495 nm紅移到515 nm;pH = 12、13或14時,探針L熒光強度極低,探針L穩定性差。據此可知探針L耐酸和耐堿性能較差,在強酸或強堿條件下穩定性差。

圖6 酸性條件下L識別Zn2+熒光強度變化
2.5 探針L的Job曲線實驗
利用Job配合曲線法進一步測定了探針L與Zn2+的配合情況。探針L和Zn2+濃度都為20 μmol/L且保持探針L與Zn2+的總濃度為2×10-5mol/L,然后逐漸改變探針L與Zn2+的物質的量比(0.1~0.9),分別測定其熒光強度,以熒光強度F對物質的量比作圖得到Job曲線,如圖8所示,探針L與Zn2+形成1∶2的配合物。

圖7 堿性條件下L識別Zn2+熒光強度變化
3 結論
本文設計合成了新型香豆素類席夫堿型Zn2+熒光探針L,該探針對Zn2+的檢測表現出良好的選擇性和較高的靈敏度,且探針L具有一定的抗酸堿能力,在弱酸與弱堿條件下能有效檢測Zn2+,Job曲線測試結果表明探針L與Zn2+形成化學計量比為1∶2的絡合物。
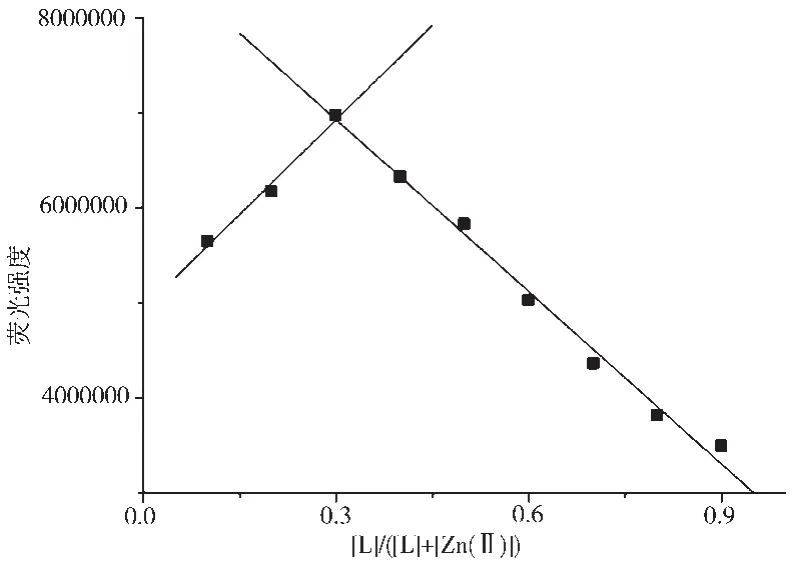
圖8 探針L與Zn2+的Job曲線

