醋蛋液水解物的類蛋白反應(yīng)修飾及其對膽酸結(jié)合能力的影響
鄭玥 曾慶梅

摘要[目的]探討類蛋白反應(yīng)在醋蛋液水解過程中對其膽酸結(jié)合能力的影響。[方法]采用胃蛋白酶水解醋蛋液,制備水解度為43.61%,膽酸結(jié)合能力為64.01%的醋蛋液水解物,并以游離氨基減少量為試驗(yàn)指標(biāo),利用響應(yīng)面法優(yōu)化胃蛋白酶催化的類蛋白反應(yīng)修飾條件,得到不同修飾程度的產(chǎn)物,測定其結(jié)合膽酸的能力。[結(jié)果]修飾產(chǎn)物的膽酸結(jié)合能力均提高,并且結(jié)合能力最高的修飾產(chǎn)物的結(jié)合能力達(dá)到102.1%,該修飾產(chǎn)物通過乙醇∶水(7∶3)或乙醇∶水(3∶7)比例的溶劑進(jìn)行離心分級后,上清液(沉淀)部分的膽酸結(jié)合能力高于(低于)修飾產(chǎn)物,并通過對該修飾產(chǎn)物和上清液部分、沉淀部分的進(jìn)一步酶水解處理的結(jié)果顯示,酶水解會(huì)導(dǎo)致它們的結(jié)合能力降低,但是仍然高于最初的醋蛋液水解物。[結(jié)論]類蛋白反應(yīng)可以提高醋蛋液水解物的膽酸結(jié)合能力和對蛋白酶抵抗的能力。
關(guān)鍵詞類蛋白反應(yīng);醋蛋液水解物;胃蛋白酶;溶劑萃取;蛋白酶抵抗
中圖分類號(hào)TS201.2文獻(xiàn)標(biāo)識(shí)碼A
文章編號(hào)0517-6611(2019)01-0154-04
doi:10.3969/j.issn.0517-6611.2019.01.047
開放科學(xué)(資源服務(wù))標(biāo)識(shí)碼(OSID):
大量科學(xué)理論證明食物蛋白水解物與膽酸結(jié)合可以阻止膽酸重吸收,從而降低內(nèi)源性膽固醇濃度[1-3]。膽酸結(jié)合能力可能與水解物和肽暴露出的疏水性氨基酸殘基有關(guān)系[4]。同時(shí),許多研究發(fā)現(xiàn)蛋白水解物比蛋白質(zhì)本身有著更大的結(jié)合潛力[5-6]。醋蛋液是一種民間廣為流傳的飲品,它有很多藥理作用,比如免疫系統(tǒng)調(diào)節(jié)、消化功能提升、減輕人體內(nèi)膽固醇水平、降血壓和抗氧化等作用。許多人從醋蛋液中分離出ACE抑制肽和抗氧化肽[7-8]。但是目前還沒有從醋蛋液中分離出可以結(jié)合膽酸的肽。
類蛋白反應(yīng)在食品科學(xué)領(lǐng)域是一種很重要的反應(yīng),其反應(yīng)機(jī)制具有多樣性和爭議性。在同一個(gè)反應(yīng)系統(tǒng)中可能含有多個(gè)反應(yīng)機(jī)制,主要包括水解、聚集、轉(zhuǎn)肽作用和物理聚集。主導(dǎo)類蛋白反應(yīng)機(jī)制是由反應(yīng)系統(tǒng)的特定條件(反應(yīng)底物、酶和其他條件)決定的。類蛋白反應(yīng)可以有效地去除蛋白水解物的苦味[9],通過引進(jìn)許多重要的氨基酸進(jìn)入蛋白水解物的肽分子解決氨基酸組成失衡問題[10-11]。
類蛋白反應(yīng)利用某些分子的氨基酸序列改變,即新的肽分子的產(chǎn)生和氨基酸序列的重組,改善生物活性肽提高其生理活性。Qian等[12]通過測定膽酸結(jié)合能力來研究類蛋白
反應(yīng)的作用,發(fā)現(xiàn)類蛋白反應(yīng)可以提高膽酸結(jié)合能力。Howard等[13]報(bào)道蛋白水解物通過結(jié)合膽酸由膽固醇轉(zhuǎn)化為膽酸。雞肉水解物的類蛋白反應(yīng)修飾物由于肽聚集比原水解物捆綁更多的膽酸[14]。因此,利用胃蛋白酶制備醋蛋液水解物,再利用胃蛋白酶催化的類蛋白反應(yīng)對水解物進(jìn)行修飾,評價(jià)其膽酸結(jié)合能力和探究進(jìn)一步酶水解對其結(jié)合能力的影響。
1材料與方法
1.1材料與試劑
胃蛋白酶,堿性蛋白酶,胰蛋白酶,上海源葉生物科技公司;其他試劑均為分析純。
1.2儀器與設(shè)備AG135電子水平(梅特勒-托利多儀器上海有限公司);BSG-26電熱恒溫水浴鍋(上海一恒科學(xué)儀器有限公司)。
1.3試驗(yàn)方法
1.3.1醋蛋液水解物的制備。
雞蛋用水洗凈后,95%酒精消毒,晾干后按照1∶3(W/V)的比例放于米醋中,浸泡48h后,雞蛋被戳破攪拌獲得混合液。最后,混合液被凍成粉,便于后續(xù)分析。醋蛋粉(5g)溶解于50mL去離子水中,用1.0mol/LHCl調(diào)節(jié)pH至2.0,加入胃蛋白酶于37℃下水解1~7h,在100℃水浴中保持10min后終止反應(yīng)。待冷卻到室溫后,5000r/min離心15min,取上清液測定其水解度和膽酸結(jié)合能力。具有最大結(jié)合能力的水解物被大量制備,凍干,用于類蛋白反應(yīng)的底物。
1.3.2醋蛋液水解物的類蛋白反應(yīng)修飾。
用胃蛋白酶對醋蛋液水解產(chǎn)物進(jìn)行類蛋白反應(yīng)修飾。采用中心組合試驗(yàn),通過測定反應(yīng)體系的游離氨基量變化,利用響應(yīng)面法對底物質(zhì)量濃度、酶添加量、反應(yīng)溫度等3個(gè)反應(yīng)條件進(jìn)行優(yōu)化(表1),以選擇適宜的修飾反應(yīng)條件。反應(yīng)結(jié)束后,修飾產(chǎn)物在沸水浴滅酶15min,冷卻后凍干,20℃儲(chǔ)存?zhèn)溆谩T趦?yōu)選的條件下,改變反應(yīng)時(shí)間(1,3,5,7和9h)制備5個(gè)修飾產(chǎn)物,測定游離氨基含量及其膽酸結(jié)合能力。具有最大結(jié)合能力的修飾產(chǎn)物被大量制備,凍干,以備后續(xù)的溶劑萃取和進(jìn)一步酶解。
1.3.3修飾產(chǎn)物的溶劑萃取和分離。
利用不同的介質(zhì)對最大結(jié)合能力的修飾產(chǎn)物進(jìn)行分離,10000r/min離心30min,分離出上清液和沉淀,測定其游離氨基含量和膽酸結(jié)合能力,分別凍干,用于進(jìn)一步研究。
1.3.4修飾產(chǎn)物和上清液、沉淀部分的進(jìn)一步酶解。對最大結(jié)合能力的修飾產(chǎn)物和離心分級產(chǎn)物(上清液部分和沉淀部分)分別采用胃蛋白酶、堿性蛋白酶和胰蛋白酶進(jìn)行酶水解處理,并對其產(chǎn)物的游離氨基含量和膽酸結(jié)合能力進(jìn)行分析測定。
1.3.5游離氨基含量、醋蛋液水解度(DH)和膽酸結(jié)合能力測定。
樣品游離氨基含量通過鄰苯二甲醛(OPA)法測定[15-16],醋蛋液水解度通過Adler-Nissen提出的公式計(jì)算[17],膽酸結(jié)合能力根據(jù)Kahlon和Chow提出的方法來測定[18],使用消膽胺作為膽酸結(jié)合能力的陽性對照藥物。
2結(jié)果與分析
2.1醋蛋液水解物的制備
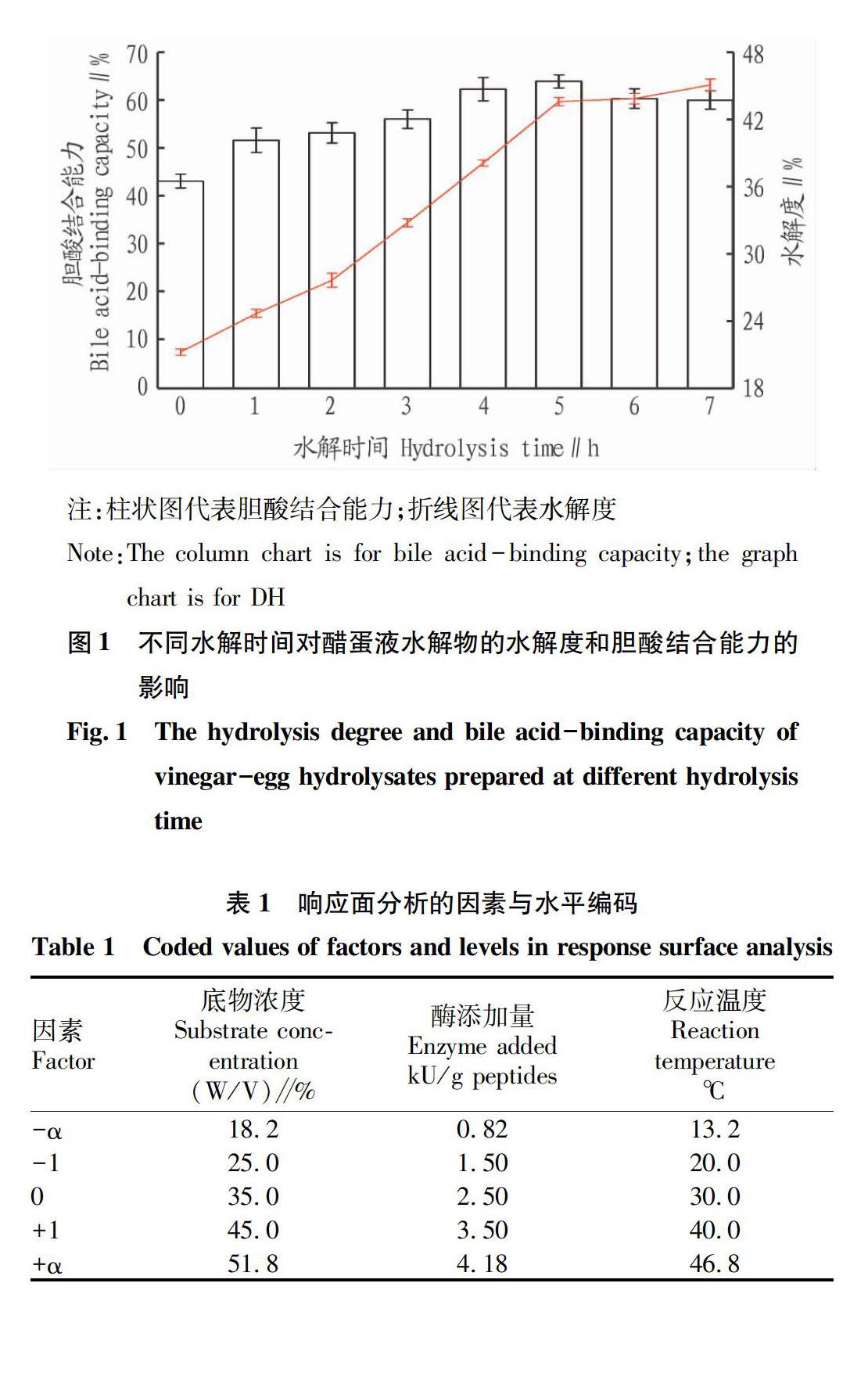
胃蛋白酶在人體胃環(huán)境中保持穩(wěn)定,我們希望醋蛋液類蛋白修飾產(chǎn)物穩(wěn)定存在于胃中,所以胃蛋白酶被選擇作為該研究中水解和聚集作用的催化劑[12]。醋蛋液相對于消膽胺(結(jié)合能力100%)來說具有43.21%的膽酸結(jié)合能力。由圖1可以看出,當(dāng)水解時(shí)間在0~5h,制備的醋蛋液水解物的水解度從21.24%上升到43.61%,膽酸結(jié)合能力從43.21%提高到64.01%。但是,更長的水解時(shí)間不能顯著影響其結(jié)合能力。水解度為43.61%時(shí),水解物的膽酸結(jié)合能力最大,為64.01%,因此選擇此醋蛋液水解物作為進(jìn)一步修飾反應(yīng)的底物。
Sun等[19]用堿性蛋白酶水解酪蛋白6h后得到水解度為10.9%,IC50為52.6μg/mL的水解物,Zhang等[20]用堿性蛋白酶水解大豆蛋白,獲得的大豆蛋白水解物水解度為14.0%,螯合鈣離子能力為41.0mg/g肽。Wei等[21]報(bào)道稱酪蛋白被水解4h時(shí),水解物表現(xiàn)出最大的ACE抑制活性(42.9%)。Lin等[22]發(fā)現(xiàn)海瓜子的可食用肌肉部分在消化酶水解后有更強(qiáng)的膽酸結(jié)合能力。該研究結(jié)果與以上結(jié)論較為相近,說明在一定范圍內(nèi),某些蛋白質(zhì)的膽酸結(jié)合能力和其水解度呈正相關(guān)。
2.2醋蛋液水解物的類蛋白反應(yīng)修飾與產(chǎn)物的膽酸結(jié)合能力通過中心組合試驗(yàn),利用響應(yīng)面法對底物濃度、酶添加量、反應(yīng)溫度等3個(gè)反應(yīng)條件進(jìn)行優(yōu)化(表1),共計(jì)20次試驗(yàn),以選擇適宜的修飾反應(yīng)條件。采用Design-Expert8.0.6軟件設(shè)計(jì)試驗(yàn)條件,對其結(jié)果進(jìn)行多元線性回歸擬合,得到底物濃度(X1)、酶添加量(X2)和反應(yīng)溫度(X3)的回歸方程模型:
Y=+101.76+6.58X1+2.60X2+5.25X3-1.75X1X2-3.50X1X3-7.50X2X3-4.06X12-10.42X22-5.83X32
P<0.0001,失擬項(xiàng)P=0.0771>0.05,說明該模型失擬不顯著,方程能夠反應(yīng)游離氨基變化量與各因素之間的關(guān)系;R2=0.9536,R2Adj=0.9118,即該模型能解釋91.18%,有4.78%的變異不能用該模型解釋,說明該模型與實(shí)際擬合較好,影響因素與響應(yīng)值之間的關(guān)系顯著,因此能用此模型對游離氨基變化量進(jìn)行分析和預(yù)測(圖2)。A、C、BC、A2、B2、C2對應(yīng)的P值小于0.01,影響極顯著,說明這幾個(gè)因素對游離氨基變化量的影響大,由F值的大小可知,3個(gè)因素對游離氨基變化量的影響順序?yàn)榈孜餄舛?反應(yīng)溫度>酶添加量。
根據(jù)所得的模型,進(jìn)一步確定各因素最佳條件,得優(yōu)化的提取條件:底物濃度為42.07%,酶添加量為2.47kU/gpeptides,反應(yīng)溫度為32.54℃,預(yù)測的結(jié)果為104.721μmol/gpeptides。為了便于操作,將以上參數(shù)修正為:底物濃度為42.1%,酶添加量為2.5kU/gpeptides,反應(yīng)溫度為32.5℃,2組平行試驗(yàn)的結(jié)果分別為103.5和102.8μmol/gpeptides,平均值為103.15μmol/gpeptides,低于計(jì)算值104.721μmol/gpeptides(P>0.05),表明采用該模型得到的預(yù)測值與試驗(yàn)真實(shí)值相符度高,得到的條件參數(shù)可靠。
利用這些反應(yīng)條件,對醋蛋液水解物進(jìn)行修飾,根據(jù)反應(yīng)時(shí)間不同(1、3、5、7和9h)制備5個(gè)不同修飾程度的修飾產(chǎn)物(產(chǎn)物1~5),它們的膽酸結(jié)合能力、游離氨基變化量列于表2,結(jié)果表明,在類蛋白反應(yīng)初始階段,游離氨基減少量增加,反應(yīng)時(shí)間5h,游離氨基減少量最大,為103.7μmol/gpeptides,游離氨基含量下降最多,這可能是因?yàn)槊附鈱?dǎo)致的游離氨基酸的共價(jià)修飾,導(dǎo)致酰胺結(jié)合和肽的聚集[12]。反應(yīng)時(shí)間超過5h后,游離氨基減少量不再增加,隨著反應(yīng)時(shí)間的延長,水解程度不斷增強(qiáng)[23]。這些修飾產(chǎn)物的膽酸結(jié)合能力從61.3%增加到102.1%(相對于消膽胺),均比原始的醋蛋液水解物(52.7%)要高,表明類蛋白反應(yīng)可以增強(qiáng)醋蛋液水解物的單算結(jié)合能力。因此,將反應(yīng)時(shí)間為5h的修飾產(chǎn)物,即修飾產(chǎn)物5用于進(jìn)一步的溶劑萃取和酶解。
2.3修飾產(chǎn)物的溶劑萃取
Qian等[12]報(bào)道許多水解物中的肽在類蛋白反應(yīng)期間聚集形成沉淀,疏水性肽鍵可能在反應(yīng)中發(fā)揮很大的作用。修飾產(chǎn)物5在加入不同溶劑后進(jìn)行離心分級分離,分離后分別得到上清液和沉淀2個(gè)部分。由表3可知,乙醇-水溶劑(7∶3,V/V)可以有效地分離修飾產(chǎn)物5的活性部分,獲得的上清液相比醋蛋液水解物有著較高的膽酸結(jié)合能力,而沉淀的膽酸結(jié)合能力弱于醋蛋液水解物,結(jié)果表明低極性溶劑可以豐富疏水性肽組分。相反,乙醇-水(3∶7,V/V)有較高的極性,所以低極性肽組分在沉淀部分被發(fā)現(xiàn)而展現(xiàn)出較高的結(jié)合能力。說明疏水性肽組分存在于低極性溶劑中,可能是增加膽酸結(jié)合能力的主要原因。疏水性氨基酸因?yàn)槠鋬捎H性結(jié)構(gòu)通過疏水作用結(jié)合膽酸[24]。Brownsell等[25]報(bào)道蛋白水解物在通過類蛋白修飾后,其疏水性氨基酸組成增加,從而影響其膽酸結(jié)合能力。
2.4修飾產(chǎn)物和分級產(chǎn)物進(jìn)一步酶解與膽酸結(jié)合能力的變化
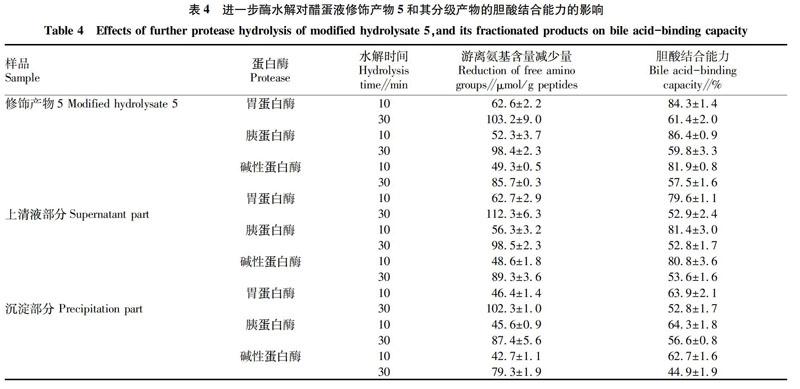
由表4可知,修飾產(chǎn)物5和它的分級產(chǎn)物相對于其對應(yīng)的底物都有更高的游離氨基含量,表明它們均被3種酶進(jìn)一步的水解。但是,進(jìn)一步酶解的最終產(chǎn)物的膽酸結(jié)合能力低于修飾產(chǎn)物5(76.4%)或者分級產(chǎn)物(上清液106.4%,沉淀70.3%)。可見,每一個(gè)樣品的膽酸結(jié)合能力都被降低,且對胃蛋白酶、堿性蛋白酶和胰蛋白酶的水解敏感。整體來說,目前的研究表明類蛋白修飾不僅能夠提高醋蛋液水解物的膽酸結(jié)合能力,而且能夠提高其對蛋白酶的抵抗能力。在3種酶的水解之后,相比于溶劑萃取后的產(chǎn)物,修飾產(chǎn)物5具有更強(qiáng)的膽酸結(jié)合能力,表明醋蛋液修飾產(chǎn)物不能通過溶劑萃取提高其對蛋白酶抵抗的能力。
3結(jié)論
通過對胃蛋白酶水解制備的醋蛋液水解物進(jìn)行類蛋白反應(yīng)修飾,膽酸結(jié)合能力從52.7%提高到102.1%,以游離氨基含量減少量為指標(biāo),響應(yīng)面法得到的類蛋白修飾反應(yīng)條件為:底物濃度42.1%、酶添加量2.5kU/gpeptides、反應(yīng)溫度25℃和反應(yīng)時(shí)間5h。利用體積比為7∶3的乙醇-水溶劑對修飾產(chǎn)物進(jìn)行離心分級處理,表明上清液的膽酸結(jié)合能力明顯高于修飾產(chǎn)物,但是沉淀部分則低于修飾產(chǎn)物。修飾產(chǎn)物及離心分級產(chǎn)物的進(jìn)一步酶水解處理,表明類蛋白修飾不僅能夠提高醋蛋液水解物的膽酸結(jié)合能力,而且能夠提高其對蛋白酶的抵抗能力。
參考文獻(xiàn)
[1]ALHAJOA,IRSHADI,KANEKANIANAD.HypocholesterolemicandangiotensinIconvertingenzymeinhibitingactivityoftrypsinhydrolysedbovinecasein[J].Journalofnutritionalhealth&foodengineering,2016,5(3):177.
[2]NAGAOKAS,F(xiàn)UTAMURAY,MIWAK,etal.Identificationofnovelhypocholesterolemicpeptidesderivedfrombovinemilkbeta-lactoglobulin[J].Biochemicalandbiophysicalresearchcommunications,2001,281(1):11-17.
[3]SHIRATAS,ODAK,ONODERAMASUOKAN,etal.HypocholesterolemiceffectofindigestiblefractionofChlorellaregularisincholesterolfedrats[J].Journalofnutritionalscienceandvitaminology,2001,47(6):373-377.
[4]KONGODIAMOUKALAJU,ZHANGH,IRAKOZEPC.Invitrobindingcapacityofbileacidsbydefattedcornproteinhydrolysate[J].Internationaljournalofmolecularsciences,2011,12(2):1066-1080.
[6]MULLALLYMM,MEISELH,F(xiàn)ITZGERALDRJ.Angiotensin-I-convertingenzymeinhibitoryactivitiesofgastricandpancreaticproteinasedigestsofwheyproteins[J].Internationaldairyjournal,1997,7(5):299-303.
[6]PIHLANTOLEPPLA,ROKKAT,KORHONENH.AngiotensinIconvertingenzymeinhibitorypeptidesderivedfrombovinemilkproteins[J].Internationaldairyjournal,1998,8(4):325-331.
[7]楊鋒,陳錦屏,吳莉莉.醋蛋多肽血管緊張素轉(zhuǎn)化酶抑制活性的穩(wěn)定性研究[J].食品工業(yè)科技,2012,33(11):151-153,156.
[8]楊鋒,陳錦屏,林心怡.美拉德反應(yīng)對醋蛋多肽抗氧化活性的影響[J].食品科學(xué),2013,34(3):137-140.
[9]STEVENSONDE,OFMANDJ,MORGANKR,etal.Proteasecatalyzedcondensationofpeptidesasapotentialmeanstoreducethebittertasteofhydrophobicpeptidesfoundinproteinhydrolysates[J].Enzymeµbialtechnology,1998,22(2):100-110.
[10]ASHLEYDV,TEMLERR,BARCLAYD,etal.Aminoacidenrichedplasteins:Asourceoflimitingaminoacidsfortheweanlingrat[J].Journalofnutrition,1983,113(1):21-27.
[11]YAMASHITAM,ARAIS,AMANOY,etal.Anovelonestepprocessforenzymaticincorporationofaminoacidsintoproteins:Applicationtosoyproteinandflourforenhancingtheirmethioninelevels[J].Agriculturalandbiologicalchemistry,1979,43(5):1065-1068.
[12]QIANF,WANGY,WENZJ,etal.Plasteinreactionenhancedbile-acidbindingcapacityofsoybeanproteinhydrolysatesandwheyproteinhydrolysates[J].Journaloffoodscience&technology,2018,55(3):1021-1027.
[13]HOWARDA,UDENIGWECC.Mechanismsandprospectsoffoodproteinhydrolysatesandpeptideinducedhypolipidaemia[J].Food&function,2013,4(1):41-50.
[14]UDENIGWECC,MOHANA,WUSH.Peptideaggregationduringplasteinreactionenhancedbileacidbindingcapacityofenzymaticchickenmeathydrolysates[J].Journaloffoodbiochemistry,2015,39(3):344-348.
[15]CHURCHFC,SWAISGOODHE,PORTERDH,etal.Spectrophotometricassayusingophthaldialdehydefordeterminationofproteolysisinmilkandisolatedmilkproteins[J].Journalofdairyscience,1983,66(6):1219-1227.
[16]SPELLMAND,MCEVOYE,OCUINNG,etal.Proteinaseandexopeptidasehydrolysisofwheyprotein:ComparisonoftheTNBS,OPAandpHstatmethodsforquantificationofdegreeofhydrolysis[J].Internationaldairyjournal,2003,13(6):447-453.
[17]ADLERNISSENJ.Determinationofthedegreeofhydrolysisoffoodproteinhydrolysatesbytrinitrobenzenesulfonicacid[J].Journalofagriculturalandfoodchemistry,1979,27(6):1256-1262.
[18]SAIGAA,TANABES,NISHIMURAT.Antioxidantactivityofpeptidesobtainedfromporcinemyofibrillarproteinsbyproteasetreatment[J].Journalofagriculturalandfoodchemistry,2003,51(12):3661-3667.
[19]SUNH,LITJ,ZHAOXH.AceInhibitionandenzymaticresistanceinvitroofacaseinhydrolysatesubjectedtoplasteinreactioninthepresenceofextrinsicprolineandethanolormethanolwaterfractionation[J].Internationaljournaloffoodproperties,2014,17(2):386-398.
[20]ZHANGY,ZHAOXH.InvitroangiotensinI-convertingenzymeinhibitionofcaseinhydrolysateresponsibleforplasteinreactioninethanol-watermedium,solventfractionation,andproteasedigestion[J].Internationaljournaloffoodproperties,2014,17(7):1577-1590.
[21]WEIX,LITJ,ZHAOXH.CoupledneutrasecatalyzedplasteinreactionmediatedtheACE-Inhibitoryactivityinvitroofcaseinhydrolysatespreparedbyalcalase[J].Internationaljournaloffoodproperties,2013,16(2):429-443.
[22]LINYH,TSAIJS,CHENGW.Purificationandidentificationofhypocholesterolemicpeptidesfromfreshwaterclamhydrolysatewithinvitrogastrointestinaldigestion[J].Journaloffoodbiochemistry,2017,41(4):12385.
[23]UDENIGWECC,WUSH,DRUMMONDK,etal.Revisitingtheprospectsofplastein:Thermalandsimulatedgastricstabilityinrelationtotheantioxidativecapacityofcaseinplastein[J].Journalofagriculturalandfoodchemistry,2014,62(1):130-135.
[24]HIGAKIN,SATOK,SUDAH,etal.Evidencefortheexistenceofasoybeanresistantproteinthatcapturesbileacidandstimulatesitsfecalexcretion[J].JournaloftheagriculturalchemicalsocietyofJapan,2006,70(12):2844-2852.
[25]BROWNSELLVL,WILLIAMSRJH,ANDREWSAT.Applicationoftheplasteinreactiontomycoprotein:II.Plasteinproperties[J].Foodchemistry,2001,72(3):337-346.

