豫北地區豬源大腸桿菌耐藥性及基因多態性分析
張明亮,周玲玲,連凱琪*,周孝蕊,宋玉偉,王雙山
(1.安陽工學院生物與食品工程學院,河南安陽 455000;2.河南省動物疫病防控與營養免疫院士工作站,河南安陽 455000; 3.河南省獸用生物制品研發與應用國際聯合實驗室,河南安陽 455000)
豬大腸桿菌病是豬群常見傳染病,其病原為致病性大腸桿菌,主要引發豬敗血癥、仔豬黃痢、仔豬白痢等癥狀[1-2]。大腸桿菌血清型種類復雜,給疫苗的研制和制備帶來了很多的困難,目前治療大腸桿菌病仍然以抗菌藥物為主。但近年來隨著各種抗生素的濫用,細菌的耐藥率持續上升,多重耐藥問題更加嚴重,給大腸桿菌的治療帶來困難,在增加治療成本的同時也給人類食品安全留下隱患。對豬源大腸桿菌基本耐藥情況的研究,有助于預防和治療此菌引起的疾病,同時對維護公共衛生安全也有著重要的意義[3]。本研究得到了21株豬源大腸桿菌,分析菌株的耐藥情況,檢測其耐藥基因分布,同時對病原菌進行了RAPD分析,以期為該地區豬源大腸桿菌病的防治提供科學的理論依據。
1 材 料
1.1 實驗菌株 從河南安陽、新鄉、焦作等地區的規模化豬場采集21株(菌株1、3、6、7、8、10、11、21分離自安陽滑縣、內黃、安陽縣規模化養殖場;菌株9、14、15、16、20分離自新鄉輝縣市、衛輝市、長垣縣規模化養殖場;菌株2、4、5、12、13、17、18、19分離自焦作市馬村區、修武縣、孟州市規模化養殖場)疑似大腸桿菌病死豬的肝臟、分泌物等。采用細菌學、PCR試驗等方法鑒定為豬源致病性大腸桿菌。大腸桿菌標準菌株ATCC25922購自中國獸醫藥品監察所。
1.2 試劑 LB瓊脂、麥康凱瓊脂、LB液體培養基購自青島海博生物技術有限公司;藥敏紙片購自杭州濱河微生物試劑有限公司。Premix Taq,DL2000 DNA Marker 購自寶日醫生物技術(北京)有限公司。
1.3 引物設計與合成 參照相關文獻[4-5]及GeneBank設計出9種擴增常見抗生素基因和RAPD多態性分析所用的引物(表1)。
2 方 法
2.1 藥敏試驗 本實驗采用紙片擴散法(K-B法)[6]。測定大腸桿菌對四環素、紅霉素、頭孢拉定、麥迪霉素、阿莫西林、磺胺異惡唑、環丙沙星、新生霉素、復方新諾明、恩諾沙星、甲氧芐啶、慶大霉素、洛美沙星、阿米卡星、頭孢氨芐、頭孢曲松鈉等16種常用抗生素的敏感性。采用標準質控大腸桿菌ATCC25922菌株作為對照組。結果參考美國臨床和實驗室標準協會(CLSI2017版)腸桿菌科細菌抑菌圈直徑標準,來判定分離株對各種抗生素的敏感情況[7-8]。
挑取分離培養的單個典型菌落在MH肉湯培養基中37 ℃培養,取適量菌液均勻地涂布在MH瓊脂培養基表面,用無菌鑷子夾取常用抗生素的藥敏紙片,分別貼到瓊脂平板表面,先將平板中央放一張藥敏片,周圍分布均勻放四張,37 ℃培養。用毫米刻度尺測量抑菌圈的大小,結果與標準結果進行對比。參考標準見表2。
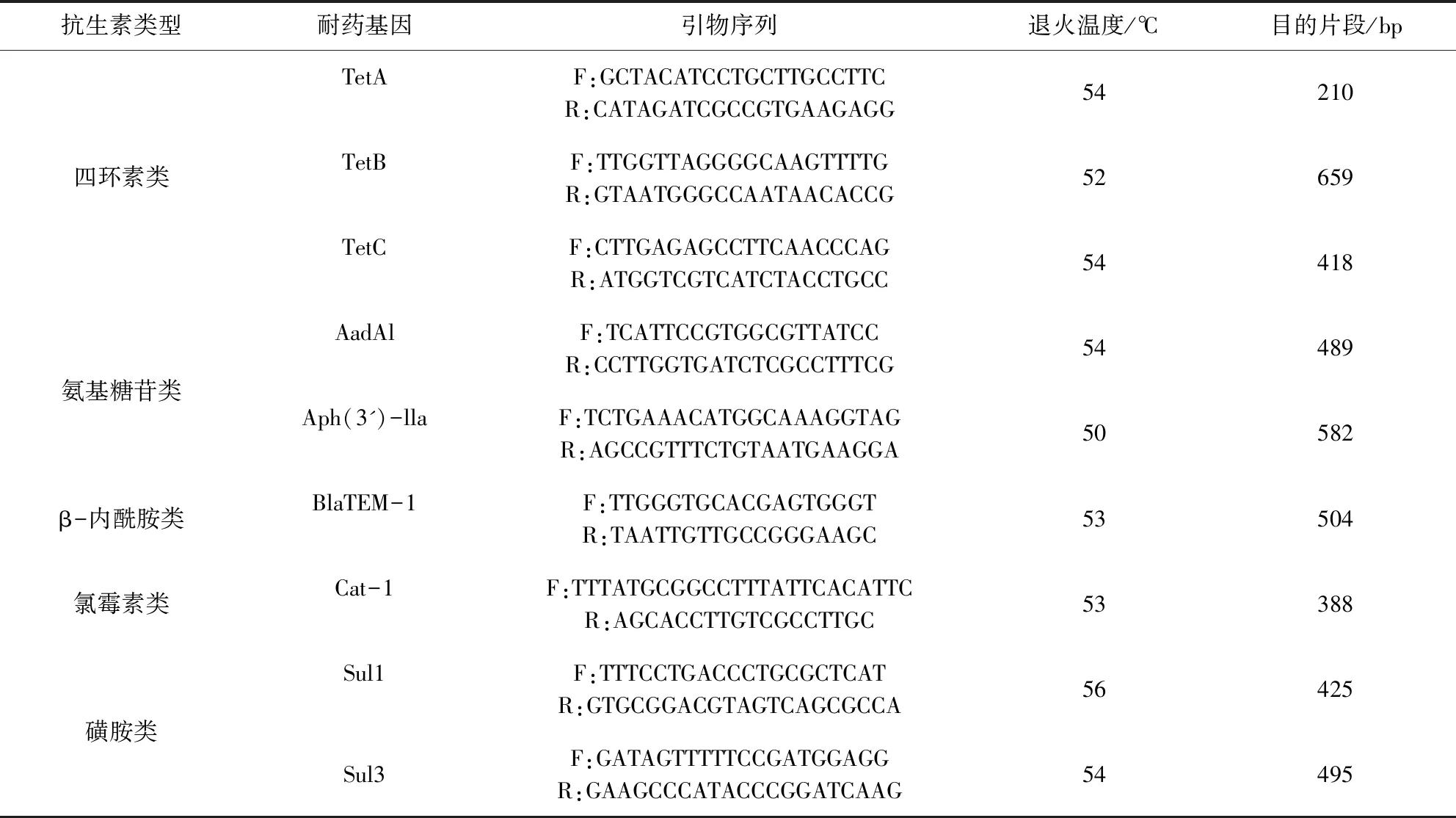
表1 PCR擴增耐藥基因引物的序列Tab 1 primer sequence for PCR amplification of drug-resistant gene
RAPD多態性分析所用的引物序列為:AGCGGGCCAA;以上引物均由北京六合華大基因科技有限公司合成。
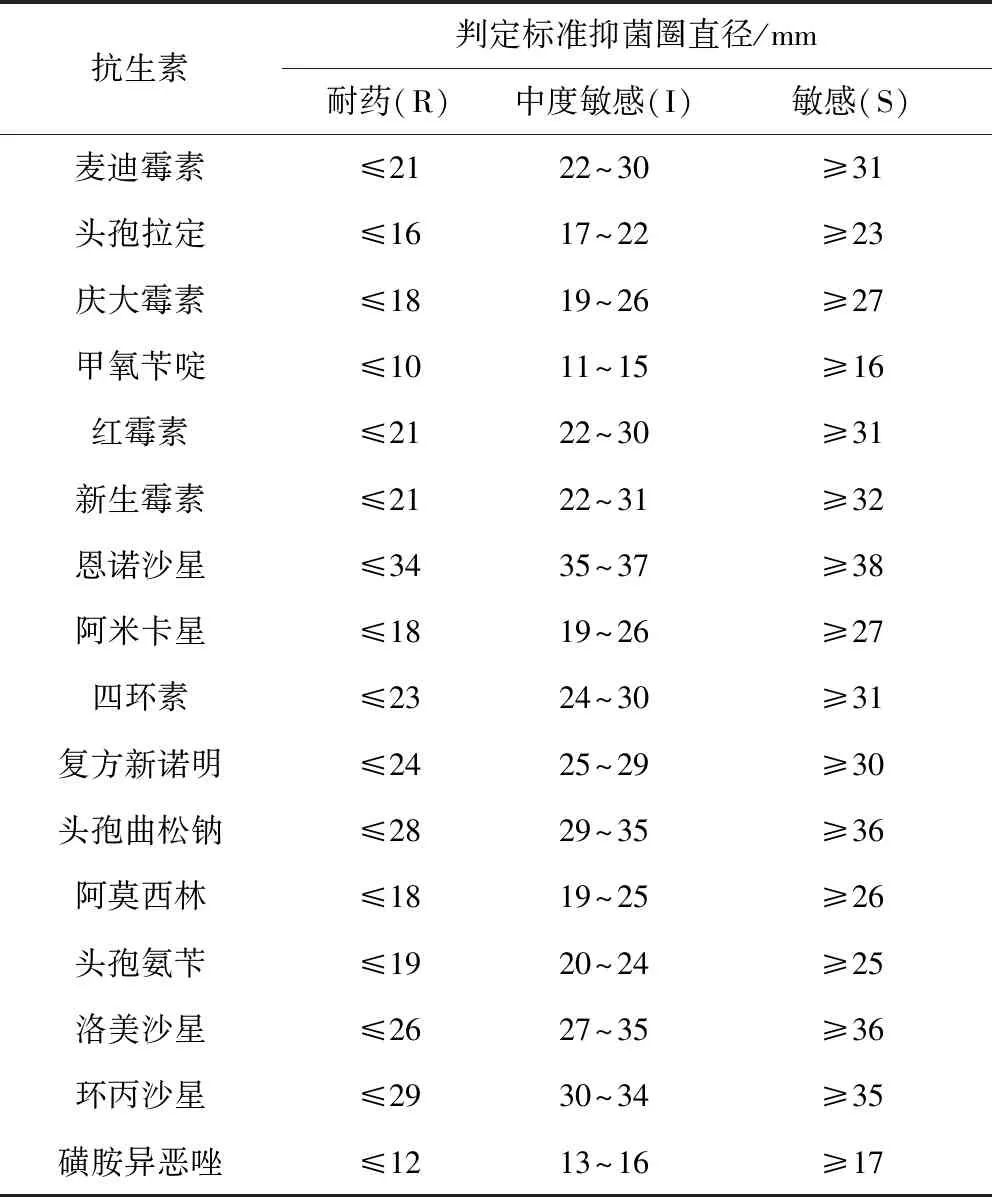
表2 抗生素的抑菌圈直徑與敏感度參考標準Tab 2 Antibiotic Bacteriostasis Circle Diameter and Sensitivity reference standard
2.2 模板DNA的制備 利用煮沸法提取細菌的基因組DNA。取過夜培養的大腸桿菌菌液600 μL,10000 r/min離心2min,棄上清,加300 μL ddH2O,以相同的轉速離心后棄上清,再加150 μL ddH2O,沸水煮10 min,離心取上清,置于-20 ℃備用。
2.3 大腸桿菌基因PCR的擴增 耐藥基因擴增體系20 μL:Premix Taq 10 μL,上下游引物各0.5 μL,模板DNA 1 μL,用ddH2O補平至20 μL。PCR反應程序:預變性95 ℃ 5 min,95 ℃ 40 s,不同退火溫度(溫度見表1),72 ℃ 45 s,34個循環;終末延伸72 ℃ 10 min。對PCR產物進行1%瓊脂糖凝膠電泳。
2.4 基因多態性分析的PCR擴增 隨機引物擴增體系25 μL:Premix Taq 12.5 μL,引物1 μL,模板DNA 1 μL,用ddH2O補平至25 μL。PCR反應程序:預變性95 ℃ 5 min,95 ℃ 1 min,36 ℃ 5 min,72 ℃ 5 min,4個循環;95 ℃ 1 min,36 ℃ 1 min,72 ℃ 2 min,30個循環,終末延伸72 ℃ 10 min。對PCR產物進行1%瓊脂糖凝膠電泳。
3 結果與分析
3.1 分離株藥敏試驗 對分離的陰性致病性大腸桿菌菌株進行藥敏試驗,結果表明21株大腸桿菌對四環素、紅霉素、麥迪霉素、阿莫西林、磺胺異惡唑、復方新諾明、環丙沙星、恩諾沙星、新生霉素、甲氧芐啶耐藥率為100%;對慶大霉素、洛美沙星耐藥率為80%以上;阿米卡星、頭孢氨芐、頭孢曲松鈉、頭孢拉定在40%~70%。其中,對氨基糖苷類敏感的菌株為菌株1、6、8、9、11、16、20;對β-內酰胺類敏感的菌株為菌株1、2、5、12、13、15、18、19;對喹諾酮類敏感的菌株為菌株10、19(表3)。

表3 大腸桿菌菌株對抗生素的敏感性試驗Tab 3 Antimicrobial susceptibility test of Escherichia coli against antimicrobial drugs
3.2 分離株耐藥基因的PCR擴增 對分離鑒定的21株豬源致病性大腸桿菌進行了四環素類、氨基糖苷類、β-內酰胺類、氯霉素類、磺胺類9種耐藥基因的擴增。其中TetA、TetB、BlaTEM-1耐藥基因的菌株數檢出率為100%;Sul3耐藥基因的菌株檢出率為85.71%;Aph(3’)-Ⅱa耐藥基因的菌株檢出率為76.19%;AadA1耐藥基因的菌株檢出率為57.14%;Sul1耐藥基因的菌株檢出率為38.09%;Cat1耐藥基因的菌株檢出率為19.04%;而TetC耐藥基因未被檢測到(表4)。
3.3 多態性分析的PCR擴增 對分離鑒定的21株大腸桿菌(圖1)進行限制性片段多態性分析。根據指紋圖譜的條帶數目和位置,可以將21株分離株分為7個基因型。2、7、9命名為Ⅰ型,占14.3%;3、21命名為Ⅱ型,占9.5%;4、5命名為Ⅲ型占9.5%;6、11、12命名為Ⅳ型,占14.3%,占9.5%;8、22命名為V型,占9.5%;10、13、18、19、20命名為VI型,占23.8%;14、15、16、17命名為VII型,占19%。

表4 分離株耐藥基因檢測結果Tab 4 Detection results of drug resistance genes in isolates

M:DL2000 Marker;1:水對照;2-22:分離株分析結果M: DNA Marker Ladder (DL 2000); 1: Water Control; 2-22: Analysis results of isolates圖1 分離菌株RAPD多態性分析電泳圖譜Fig 1 RAPD polymorphism analysis of isolated strains
4 討論與結論
大腸桿菌是腸桿菌科的重要成員,能引起動物的大腸桿菌病。近些年,抗生素的濫用或不合理運用,使大腸桿菌耐藥基因不斷出現。從最初的單一耐藥,耐藥率低,傳播速度緩慢,到如今變為耐藥譜寬,耐藥率高,耐藥性傳播速度快的局面[2]。本研究對豫北地區分離的大腸桿菌菌株進行了藥敏實驗,結果表明分離株對四環素、紅霉素、麥迪霉素、阿莫西林、磺胺異惡唑、環丙沙星、新生霉素、復方新諾明、恩諾沙星、甲氧芐啶的耐藥程度較高,耐藥率均為100%,這一結果與艾偉昌等[3]報道的河南省豬源大腸桿菌對四環素、磺胺異惡唑、復方新諾明的耐藥率分別為97.7%、97.7%、90.6%結果相近,提示該地區臨床應禁用這些藥物,加強這些藥物在該地區的使用監管。同時,對于恩諾沙星的耐藥率,本研究顯著高于艾偉昌等[3]的報道,這表明大腸桿菌的耐藥機制可能與同一地區的飼養管理條件及抗生素使用種類存在廣泛的聯系。同時發現分離自安陽各縣的菌株對氨基糖苷類抗生素較為敏感,分離自焦作各區縣的菌株對β-內酰胺類抗生素較為敏感,這為相應地區防治豬源大腸桿菌臨床用藥提供了參考。菌株的多重耐藥也是近年來抗生素難以奏效的重要因素。有報道指出,河南省規模化豬場大腸桿菌耐藥現象非常嚴重,耐藥譜較廣,并且呈現不同程度的多重耐藥,每種菌株至少對3種抗生素耐藥[9]。本研究結果與該報道一致。本研究表明多重耐藥在分離株中普遍存在。這可能是由于細菌處于相同的藥物選擇壓力下,導致相似耐藥譜型的出現[10]。建議臨床中合理用藥,同時采取多種用藥方式以減輕對大腸桿菌的選擇性壓力,降低細菌產生耐藥性的概率[11]。
四環素類、氨基糖苷類、大環內酯類、β-內酰胺類等抗生素是臨床防治大腸桿菌的首選藥物。多年的濫用或不合理運用使大腸桿菌耐藥基因不斷出現。本研究對分離出的21株大腸桿菌進行了9種耐藥基因的檢測,結果表明四環素類TetA、TetB均為100%;氨基糖苷類AadA1、Aph(3’)-Ⅱa分別為57.14%、76.19%;β-內酰胺類BlaTEM-1為100%;氯霉素類Cat1為19.04%;磺胺類Sul1、Sul3分別為38.09%、85.71%。其中四環素類耐藥基因TetB檢測率高于張炳亮等[12]的報道;與王學君等[13]報道的四環素類耐藥基因TetA檢出率相當,這表明四環素耐藥基因TetA可能成全國性分布,這與該類抗生素的不合理運用有關。同時,顏友榮[14]等的報道表明四環素類TetC耐藥基因檢出率為43.20%,而本研究并未檢出該基因的存在,表明不同地區介導同一耐藥性的耐藥基因可能存在差異。氨基糖苷類耐藥基因Aph(3’)-Ⅱa是常見的耐藥基因之一,本研究檢出率高于張炳亮等[12]的報道,低于晏云濤等[2]的報道,這可能與不同地區豬的年齡、性別和品種相關。
磺胺類藥物具有與對氨苯甲酸相類似的分子結構,二者競爭性抑制二氫葉酸合成酶的活性,從而抑制細菌的生長與繁殖。Sul1基因在不同臨床和環境分離菌株中存在,具有攜帶和傳播磺胺抗性的作用[15-16]。Sul1和Sul3是已知的質粒編碼的磺胺耐藥基因,可產生二氫葉酸合成酶并誘導磺胺類藥物的抗性[17], 二氫葉酸還原酶利用NADPH 還原二氫葉酸產生四氫葉酸,從而影響細菌核蛋白合成。細菌的耐藥機制是十分復雜的。發現分離菌株對磺胺類完全不敏感,而磺胺類耐藥基因Sul1和Sul3檢出率分別為38.09%和85.71%,這可能是因為分離菌株含有其他耐藥基因或存在其他耐藥機制。本研究發現Sul3檢出率較高,提示該基因可能是介導本地區豬源大腸埃希菌對磺胺類藥物產生耐藥性的主要基因型。氯霉素類藥物是一種廣譜抗生素,吸收快、體內分布廣泛,在獸醫臨床上發揮著重要的作用,特別對大腸桿菌和沙門菌等革蘭陰性菌有較強的抑菌作用[18]。氟苯尼考因其安全性和有效性在我國獸醫臨床上被廣泛使用,是目前獸醫臨床主要應用的氯霉素類抗生素。本研究在分離株中檢測到了氯霉素類耐藥基因,表明該地區已出現耐藥菌株,應做好該類抗生素的合理應用,避免耐藥性跨種傳播。耐藥基因的檢測有助于了解該地區流行株耐藥基因存在的種類、數量及流行規律,從而豐富和完善豬源致病性大腸桿菌耐藥性的分子流行病學資料,而目前國內外尚未見商品化的相關耐藥基因檢測試劑盒,這為研制PCR試劑盒奠定了基礎。
隨機擴增DNA多態性擴增(RAPD)技術曾被用于確定微生物感染的暴發流行、傳染源及其遺傳相差型等研究[19-20]。RAPD圖譜具有較大相似性的菌株之間應該屬于同一類群,反之則為不同的類群,因此,可以通過RAPD分型的方法來檢測菌株之間同源性的高低。本研究的分型中,共得到7種不同的基因型,顯示出該地區致病性大腸桿菌基因型的復雜性。同時,發現同一基因型的不同菌株對抗生素的敏感性存在較大差異,表明該地區大腸桿菌在抗生素選擇壓力下,其耐藥性更加的復雜化。
本研究對豫北地區豬源致病性大腸桿菌的耐藥性、耐藥基因及分子分型做了研究,為全面了解豫北地區豬源致病性大腸桿菌的流行病學提供了參考數據,同時為該地區豬源大腸桿菌病臨床針對性合理用藥提供了實驗依據。

