芍藥苷對人上皮性卵巢癌HO8910細胞增殖、凋亡及遷移的影響及其機制研究
高天勤,李欣,董圣軍,程春雷,史榮軍,賈龍,王健,劉寶輝
(1.濱州醫學院附屬醫院,山東 濱州 256603;2.濱州市人民醫院,山東 濱州 255610;3.山東省食品藥品檢驗研究院,山東 濟南 250101;4.陽信縣人民醫院,山東 陽信 251800)
卵巢癌是女性生殖系統常見的惡性腫瘤之一,病死率高居婦科惡性腫瘤的首位[1]。卵巢癌對化療藥物的耐藥及癌細胞自身較強的遷徙能力是導致化療失敗的主要原因,迄今為止,尚無理想的藥物應用于臨床克服腫瘤耐藥性。近年來,傳統中藥因來源廣泛、副作用少、病人安全應用歷史長及缺乏耐藥性等優點越來越受到關注。其中大量研究發現,芍藥苷(paeoniflorin,PF)對多種腫瘤細胞存在抑制作用[2-3],但PF對卵巢癌細胞的影響卻鮮有報道。為了觀察PF是否具有抗卵巢癌的作用,本實驗組通過觀察PF對人上皮性卵巢癌HO8910增殖、凋亡及遷移能力的作用,并對可能的作用機制進行初步探討。
1 材料與方法
1.1 實驗材料及儀器 人上皮性卵巢癌HO8910細胞由濱州醫學院中心實驗室提供。芍藥苷購于中國食品藥品檢定研究院;4′,6-二脒基-2-苯基吲哚(DAPI)、噻唑藍(MTT)購于美國Sigma-Aldrich公司;鼠源抗人凋亡蛋白caspase-3、β-actin、B 淋巴細胞/白血病-2(Bcl-2)抗體及核因子-κB(NF-κB) p56抗體均購自美國Cell Signaling公司;原位末端轉移酶標記(TUNEL)檢測試劑盒購買于美國Santa Cruz公司;辣根過氧化物酶標記羊抗鼠IgG 購買于中杉金橋生物技術有限公司;二喹啉甲酸 (BCA)×100蛋白質定量測定試劑盒、組織裂解蛋白提取液、蛋白酶抑制劑均購買于上海碧云天生物技術公司;酶標儀為美國Biotech公司產品;CO2細胞培養箱為美國Thermo公司產品;熒光顯微鏡是日本Olympus公司產品;電泳、濕轉移槽及Western blot發光照相系統為自美國Rio-Red公司產品。
1.2 細胞培養及分組 人上皮性卵巢癌HO8910細胞用10%胎牛血清的DMEM細胞培養液于37 ℃,5%CO2的細胞培養箱內常規培養,每 1~2 d更換培養液 1 次。根據預實驗及參考文獻設置低、中、高PF劑量組與對照組。其中,二甲基亞砜(DMSO,0.01%)作用于對照組。PF低、中、高劑量組分別在加入0.5、1與2 mg·mL-1PF的DMEM培養液中培養48 h,PF用DMSO預溶,并用DMEM培養液稀釋至相應濃度。
1.3 MTT 法測細胞增殖率 將HO8910細胞接種于96孔板,待細胞貼壁后實驗組加入含終濃度分別為0.5、1與2 mg·mL-1PF的DMEM培養液。每組設6個復孔,在37 ℃,5%CO2的細胞培養箱內常規培養48 h后,棄細胞培養液,沖洗后加入MTT的培養液(10 μL),4 h后棄上清溶液并加入DMSO。震蕩10 min后用酶標儀于490 nm波長處測定吸光度(A)值,并重復上述實驗3次。
增殖抑制率=(對照組OD值-各組實驗組OD值/對照組OD值-空白組OD值)×100%。
1.4 TUNEL法檢測細胞的凋亡率 將上述對照組及各芍藥苷劑量組干預后的細胞用4%的多聚甲醛固定1 h后,根據該實驗試劑盒所述的雙重染色法,TUNEL檢測液可將凋亡細胞的細胞核染呈綠色。DAPI可將所有細胞的細胞核染成藍色。每組細胞隨即在熒光顯微鏡下選擇6個視野并觀察計數。計算HO8910細胞凋亡率。
1.5 細胞劃痕實驗細胞遷移率 用細胞劃痕實驗檢測HO8910細胞遷移:實驗步驟依據參考文獻[4]。將混勻的血管內皮細胞以5×105均勻種于6孔板內,并鋪滿整個孔板。各組給予上述相應處理后,以P200移液器槍頭垂至于6孔板劃出3條平行的“損傷”。用PBS洗細胞3次,去處劃下的細胞,加入5%胎牛血清培養基后,放入37 ℃,5% CO2培養箱培養8 h。運用倒置相差顯微鏡(Olympus BX61)對遷移的各組細胞進行拍照,并計算出劃痕上下界限之間距離的平均值。將對照組的設定為100%。
1.6 Western blot法檢測 細胞內caspase-3、Bcl-2、NF-κB p56蛋白表達水平HO8910細胞的前期培養與干預方案同上。各組細胞處理48 h后通過裂解提取蛋白,并根據BCA蛋白定量方法所得結果加入各組蛋白樣品。依次通過電泳、轉膜、封閉,然后分別滴加抗NF-κB p56、 Bcl-2、caspase-3和β-actin抗體(1∶1 000稀釋),4 ℃過夜,清膜、孵育對應二抗后,再次洗膜后用配置新鮮發光液進行曝光顯影,Bio-Rad照相系統進行照相并用其附帶的軟件分析蛋白的相對表達量。

2 結果
2.1 各組細胞增殖抑制率、凋亡率及遷移率比較各組細胞處理之后,MTT法測定各組細胞增殖率;TUNEL染色法測定各組細胞的凋亡率;細胞劃痕法測定各組細胞遷移率。其數據統計如表1所示,與對照組相比,PF中劑量組、PF中劑量組細胞增殖率、遷移率明顯降低,而凋亡率明顯升高(P<0.05,P<0.01),并且隨PF濃度的增加而效果明顯。

表1 各組細胞增殖率、凋亡率及遷移率比較
注:與對照組比較,*P<0.05,**P<0.01;與PF中劑量組比較,#P<0.05
2.2 各組細胞內caspase-3、Bcl-2、NF-κB p56蛋白表達比較PF中劑量組、PF中劑量組細胞內caspase-3表達水平較對照組明顯升高(P<0.05),Bcl-2、NF-κB p56表達水平較對照組明顯降低(P<0.05),且呈現劑量依賴性(P<0.05,P<0.01),并且隨PF濃度的增加而效果明顯,結果見表2。
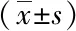
表2 各組細胞caspase-3、Bcl-2、NF-κB p56表達比較
注:與對照組比較,*P<0.05,**P<0.01;與PF中劑量組比較,#P<0.05
3 討論
卵巢癌惡性程度高,侵襲轉移能力強,早期臨床癥狀隱匿不易診斷,治療效果及預后較差[1,5]。雖然目前對卵巢癌的診療取得了一定的進展,但患者的5年死亡率仍維持在25%~30%左右[6]。目前臨床上用于治療卵巢癌的藥物不良反應大,且易產生耐藥性[7]。因此,新藥的研發對改善卵巢癌的治療形成尤為重要。
芍藥苷是白芍的主要有效成分,它具有抗炎、免疫調節、保肝、調節免疫等多方面功效[8-9]。但近幾年研究顯示,芍藥苷還對部分腫瘤有抑制作用,如胰腺癌、胃癌、黑色素瘤等[2-3,10]。它可以抑制這些腫瘤細胞的增殖并誘導其死亡。但芍藥苷在卵巢癌的增殖、遷移情況的作用確未有報道。本實驗中,通過細胞增殖實驗主要證實芍藥苷對人上皮性卵巢癌HO8910細胞的增殖、遷移能力的抑制作用。實驗中應用不同濃度的(0.5、1與2 mg·mL-1)芍藥苷處理后發現,芍藥苷可劑量依賴的抑制HO8910細胞增殖、遷移,促進HO8910細胞的凋亡。
絕大多數化療藥物殺傷腫瘤細胞是通過誘導細胞凋亡來實現的,但化療藥物誘導凋亡的同時也會誘導相應腫瘤細胞產生耐藥性,這是腫瘤化療失敗的主要原因之一。其中被化療藥物所激活的NF-κB是腫瘤細胞獲得耐藥的重要機制之一[11]。研究發現NF-κB一旦激活后即從細胞質內轉入胞核中調控抗凋亡因子Bcl-2家族、MDR等蛋白的表達[12],抑制caspase凋亡家族的表達[13],參與腫瘤細胞的增值與遷移。本實驗中再次驗證了芍藥苷可使NF-κB蛋白表達水平明顯降低。本實驗亦發現芍藥苷可明顯抑制抗凋亡蛋白Bcl-2表達,上調凋亡蛋白caspase-3的表達。結合 MTT及凋亡檢測結果,可見伴隨著對 NF-κB活性的抑制增強,卵巢癌HO8910細胞增殖抑制率及凋亡率也隨之增加,遷移率明顯降低。
綜上,芍藥苷具有抑制人上皮性卵巢HO8910細胞增殖、遷移,并促進其凋亡的作用。其作用機制可能通過NF-κB信號通路以上調凋亡蛋白caspase-3,下調抗凋亡蛋白Bcl-2進而誘導HO8910細胞凋亡,但具體的作用機制需要進一步證實。

