尼群地平片人體生物等效性預研究
魯婷婷,崔佳麗,梅 晶,趙高瓊,李竇紅,劉紅斌 ,王京昆
(1.大理大學,云南 大理 671000;2.云南省藥物研究所,云南 昆明 650111;3.云南白藥集團創新研發中心,云南 昆明 650111;4.云南省中藥和民族藥新藥創制企業重點實驗室,云南 昆明 650111)
尼群地平為德國拜耳公司 (Bayer Vital GmbH)研發的二氫吡啶類鈣離子拮抗劑,由于起效迅速、療效確切、副作用小等特點,被廣泛應用于治療各類型高血壓及冠心病[1]。截止2012年,我國已有191家企業仿制生產尼群地平片[2]。為促使企業全面提高仿制藥質量,國家食品藥品監督管理總局《關于開展仿制藥質量一致性評價工作的通知》中提出:“對2007年修訂的《藥品注冊管理辦法》施行前批準基本藥物和臨床常用仿制藥,分期分批進行質量一致性評價”[3]。而生物等效性 (bioequivalence,BE)評價是仿制藥質量與療效一致性評價的重點內容之一[4-5]。只有仿制藥與原研藥具有生物等效性,臨床上才可以仿制藥替代原研藥[6]。本研究進行空腹狀態和餐后狀態下尼群地平受試制劑與參比制劑生物等效性預研究,以期獲得尼群地平生物等效性評價結果,為尼群地平片生物等效性正式試驗的設計提供參考和指導。
1 儀器和試藥
1.1 儀器
Agilent 1200SL HPLC(美國安捷倫科技有限公司)、API3200 Q-Trap質譜儀(美國AB公司)、Allegra 64R臺式高速冷凍離心機(美國Beckman公司)、DV215CD電子天平 (上海OHAUS公司)。
1.1 藥品與試劑
受試制劑:尼群地平片(云南白藥集團股份有限公司,批號ASPL201702,規格10 mg);參比制劑:尼群地平片(Bayer Vital GmbH,批號BJ33777,規格10 mg)。尼群地平對照品(中國食品藥品檢定研究院,含量為99.4%,批號:100585-201705);內標:氘代尼群地平(TORONTO RESEARCH CHEMICALS INC,批號:15-BHW-78-4);甲酸、乙腈為色譜純,水為超純水。
2 試驗方法
2.1 血漿樣品分析方法的建立
2.1.1 血漿樣品處理方法
精密量取100 μL血漿,置1.5 mL棕色離心管中,加入200 μL的內標沉淀劑,渦旋3 min,于15000 r·min-1,4℃離心10 min后,取上清液進行分析檢測。
2.1.2 色譜條件與質譜條件
色譜條件:色譜柱為 XBridge○RBEH C18柱(4.6mm×75mm,2.5μm);流動相為0.1%甲酸水-乙腈,洗脫梯度為0.0~2.0 min,乙腈10%;2.0~7.5 min,乙腈90%;7.5~12 min,乙腈10%;柱溫為20℃;流速為350 μL·min-1;進樣量為10 μL。
質譜條件:電噴霧離子源 (ESI),多反應監測 (MRM)方式進行負離子檢測,對質譜參數進行優化,優化后的質譜參數,噴霧電壓 (IS):-4500 V,霧化溫度 (TEM):600℃,氣簾氣(CUR):30 psi,霧化氣 (GS1):85 psi,輔助氣(GS2):60 psi,碰撞氣 (CAD):Low;尼群地平[M-H]-母離子m/z:359.10,定量/定性碎片離子m/z:122.00/236.00;解簇電壓(DP):-40V/-50 V,射入電壓(EP):-5V/-5V,碰撞池入口電壓(CEP):-15 V/-13 V,碎裂電壓 (CE):-26V/-25 V,碰撞室射出電壓(CXP):-2 V/-2 V;氘代尼群地平 [M-H]-母離子m/z:364.10,定量/定性碎片離子m/z:122.00/241.10;解簇電壓(DP):-50V/-50 V,射入電壓 (EP):-5V/-5 V,碰撞池入口電壓(CEP):-15 V/-15 V,碎裂電壓 (CE):-27 V/25 V,碰撞室射出電壓(CXP):-2 V/-2 V。
2.2 溶液的配置
精密稱定尼群地平對照品5.84mg于10 mL棕色容量瓶,用乙腈溶解并定容稀釋成濃度分別為1.97、4.93、14.8、44.3、133、400ng·mL-1的標準曲線工作液;同法精密稱定尼群地平對照品5.26mg和內標氘代尼群地平對照品2.60 mg用乙腈分別稀釋成質量濃度分別為 3.90、82.0、328ng·mL-1的質控工作液和質量濃度為2.08 ng·mL-1的內標沉淀劑。
2.3 分析方法的確證
2.3.1 特異性
測定空白血漿樣品、空白血漿加標樣品及任一志愿者服藥后的未知濃度血漿樣品,由尼群地平、氘代尼群地平定量離子對(m/z359.10→m/z122.00、m/z 364.10→m/z122.00) 的提取離子流圖可知,血漿中內源性物質和代謝物不干擾尼群地平和內標的測定,方法的特異性良好。
2.3.2 標準曲線及定量下限
配制血藥質量濃度為 0.197、0.493、1.48、4.43、13.3、40.0 ng·mL-1的標準曲線樣品,進樣檢測,得標準曲線回歸方程為Y=0.284X+0.00962(r=0.9996),結果表明,尼群地平血藥質量濃度在0.197~40.0 ng·mL-1范圍內線性關系良好,定量下限為 0.197 ng·mL-1。2.3.3 精密度與準確度
處理定量下限、低、中、高4個質量濃度(0.197、0.390、8.20、32.8 ng·mL-1)的血漿樣品各6份,連續3天,進樣檢測,得批內準確度為88.32%~111.28%,批內精密度為RSD%為1.75%~6.42%,批間準確度為102.03%~106.15%,批間精密度為RSD%為2.83%~10.95%,符合生物樣本分析檢測要求。
2.3.4 提取回收率
配制質量濃度分別為0.390、8.20、32.8 ng·mL-1的質控血漿樣品,每樣6份,與相應質量濃度標準品溶液以水代替血漿同法配制的6份樣品比較,計算提取回收率,3個質量濃度尼群地平的提取回收率分別為 (106.14±4.82)%,(103.93±3.22) %和 (101.53±4.50) %,相對標準偏差RSD%分別為4.53%、3.10%和4.43%,平均提取回收率為103.89%,相對標準偏差RSD%為2.22%,回收對尼群地平及內標氘代尼群地平的影響較小,符合生物樣本分析檢測要求。
2.3.5 基質效應

圖1血漿中尼群地平和內標氘代尼群地平的提取離子流圖Fig.1 Extracted ion chromatograms of nitrendipine(m/z359.10 →m/z122.00,1) and nitrendipine-d5(m/z 364.10 →m/z122.00,2) in plasma samples
處理低、中、高(0.390、8.20、32.8ng·mL-1)3個質量濃度的尼群地平基質樣品,每濃度各6份,與相應濃度標準品以水代替血漿照“血漿樣品的預處理”方法操作處理后的6份樣品進樣比較,計算內標歸一化基質效應,尼群地平各質量濃度的內標歸一化基質效應分別為(112.85±4.20) % , (111.56±4.42) % 和 (111.84 ±4.23)%,相對標準偏差RSD%分別為3.72%、3.96%、3.78%,平均內標歸一化基質效應為112.20%,相對標準偏差RSD%為0.61%,基質對尼群地平及內標氘代尼群地平的影響較小,滿足生物樣品分析檢測要求。
2.3.6 穩定性
取低、中、高3個質量濃度(3.90、82.0、328ng·mL-1)的質控標準工作液各15份,室溫氮氣吹干,加入100 μL空白血漿,渦勻,分別考察室溫避光放置10 h和室溫不避光放置3 h及處理后放置7d的穩定性。結果所有樣品相對偏差RE%在-10.37%~8.21%范圍內,RSD%在1.23%~8.49%范圍內,表明尼群地平血漿樣本在上述條件下均穩定。
2.4 臨床試驗
試驗方案實施前經倫理委員會審查批準,16名健康志愿者體格檢查、心電圖檢查和實驗室檢查均正常。試驗前兩周至試驗結束未使用影響尼群地平片體內過程或安全性評價的藥物或食物,自愿簽署知情同意書,采用自身交叉對照設計,將志愿者隨機分為空腹給藥組和餐后給藥組,空腹給藥組服藥前禁食10h,餐后給藥組服藥前禁食10h并于服藥前30 min內進食高脂高熱量餐,服藥劑量為10 mg,清洗期7天,服藥前(1 h內) 及服藥后0.5 h、0.75 h、1 h、1.25 h、1.5 h、2 h、2.5 h、3 h、4 h、5 h、6 h、8 h、10 h、12 h、24 h采集靜脈血,所采血液在3000 r·min-1,2~8℃條件下離心10 min,然后分離血漿樣品,于-80℃冰箱中保存待測(全血采集和離心分裝等均在避光環境下進行操作)。

圖2 志愿者空腹狀態 (A)和餐后狀態 (B)下服用兩種制劑后平均血藥濃度-時間曲線 (n=8)Figure.2 Mean plasma concentration-time curves of oral administration of twopreparation under fasting (A)and fed (B)conditions in healthy volunteers(n=8)
2.5 統計學處理
采用DAS3.3.0軟件非房室模型計算藥代動力學參數,對藥動學參數AUC和Cmax經對數轉換后進行多因素方差分析和雙單側t檢驗,以AUC和Cmax的90%置信區間 (90%CI)評價尼群地平片的生物等效性。以多因素方差分析得到的殘差(mean square error,MSE)[7],采用 DAS3.3.0 軟件計算尼群地平空腹服藥及餐后服藥Cmax、AUC0-t、AUC0-∞的個體內變異和個體間變異。
3 結果
3.1 藥-時曲線
志愿者餐后或空腹服用尼群地平參比制劑和受試制劑平均血藥濃度-時間曲線,見圖2。
3.2 藥動學參數
采用DAS3.3.0軟件計算得到的藥代動力學參數結果見表1。
3.3 生物等效性評價
尼群地平片空腹狀態或餐后狀態服藥后Cmax、AUC0-t、AUC0-∞的 90%CI 結果見表 2。Cmax、AUC0-t、AUC0-∞的 90%CI均超出 80%~ 125%,尼群地平兩制劑不符合生物等效性假設,餐后服藥藥動學參數AUC在個體間差異有統計學意義
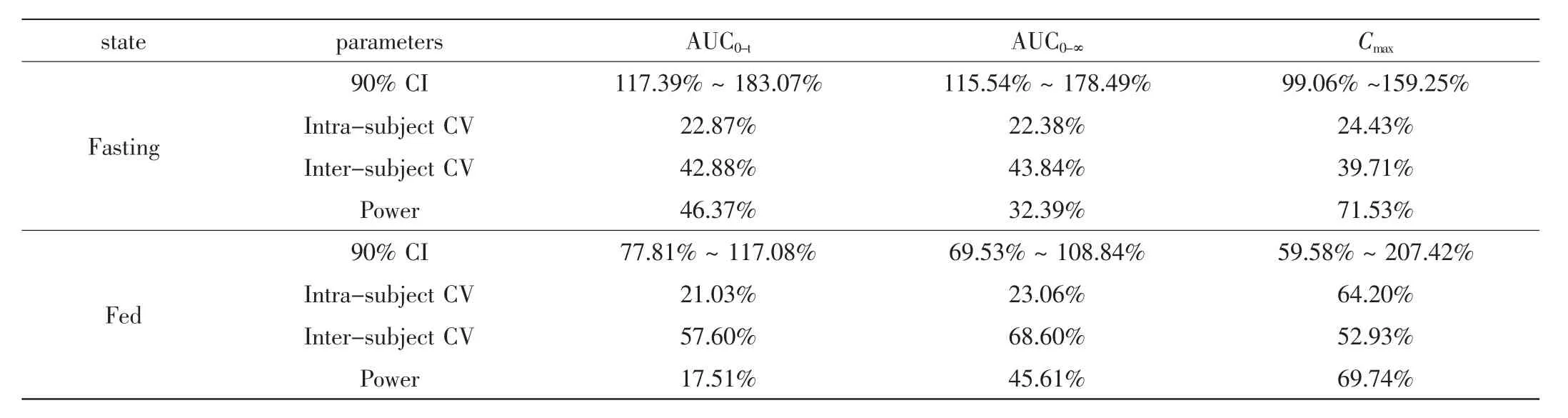
表2 受試者空腹及餐后狀態下經口給予受試制劑與參比制劑后等效性統計檢驗Tab.2 Statistical test of bioequivalence after oral administration of test or reference preparation under fasting and high-fat diet conditions
(P<0.05),空腹服藥藥動學參數Cmax在個體間、AUC在個體間及藥物間差異有統計學意義(p<0.05)。
空腹服用尼群地平片后Cmax、AUC0-t、AUC0-∞個體內變異為24.43%、22.87%、22.38%,個體間變異為39.71%、42.88%、43.84%;餐后服用尼群地平片后Cmax、AUC0-t、AUC0-∞個體內變異為64.20%、21.03%、23.06%,個體間變異為52.93%、57.60%、68.60%。
4 討論
藥動學參數Cmax、AUC個體間差異有統計學意義,可能與尼群地平藥物本身個體間變異有關[8],空腹狀態或餐后狀態服藥后藥動學參數Cmax、AUC置信區間均超出80%~125%,兩個企業生產的尼群地平片生物不等效,說明受試制劑與原研藥仍存在一定差距,提示后續需要繼續優化尼群地平片處方、改善制劑工藝,以期獲得等效性結果。

