人誘導(dǎo)多能干細胞體外多向分化能力的方法驗證
馮頂麗,卓麗丹,蘆 笛,李 紅,郭紅延
人誘導(dǎo)多能干細胞(induced pluripotent stem cells, iPSC)是由日本 Yamanaka 研究小組于2006 年首次成功創(chuàng)建[1],隨后,國內(nèi)外多家實驗室通過轉(zhuǎn)染外源特定的基因組合來誘導(dǎo)成體細胞向 iPSC的重編程。iPSC類似于胚胎干細胞,具備基因多樣性,能自我更新并分化成為多種類型的組織和體細胞。另外,iPSC的誕生克服了胚胎干細胞在臨床應(yīng)用時涉及的移植免疫排斥與倫理問題,且成瘤率較低[2,3]。加之,與胚胎干細胞比較iPSC具有來源廣泛的巨大優(yōu)勢,任何一個成體細胞經(jīng)重編都有獲得iPSC的潛能[4],遺傳多樣性和患者特異性細胞數(shù)量呈指數(shù)級增長,擴展的細胞庫有利于新藥在目標人群樣本中的測試,從而有助于精準醫(yī)學(xué)的發(fā)展[5]。另外,多能干細胞用于誘導(dǎo)產(chǎn)生人體功能性細胞和功能性類器官,構(gòu)建研究模型。如iPSC經(jīng)3D培養(yǎng)產(chǎn)生膽管細胞[6],心肌細胞[7],腎臟[8],胃[9],人體腸道器官[10],人肺類器官[11],神經(jīng)構(gòu)建體[12]等。這種潛能有利于對遺傳性疾病的研究與治療[13],因此具有重要的臨床應(yīng)用價值。iPSC具有向三胚層細胞分化的能力,本研究旨在驗證誘導(dǎo)iPSC為中胚層的成骨細胞、成軟骨細胞及外胚層神經(jīng)細胞的技術(shù)方法。
1 材料與方法
1.1 材料 iPSC購自上海中國科學(xué)院干細胞庫(干細胞庫編號為SCSP-1302,細胞描述為將人皮膚細胞誘導(dǎo)成IPS細胞,重編程轉(zhuǎn)錄因子為OCT4、SOX2、KLF4、MFC)。mTeSRTM1 培養(yǎng)液 (Stem cell, 加拿大);Matrigel 基質(zhì)膠 (BD, 美國);DMEM高糖基礎(chǔ)培養(yǎng)液、DMEM/F12、胎牛血清(FBS)、Dispase、 B-27補充劑(50X)、N-2補充劑(100X)、MEM非必需氨基酸溶液100X (Gibco); ITS+1、抗壞血酸2-磷酸、β-甘油磷酸鈉、堿性磷酸酶檢測試劑盒、地塞米松、丙酮酸鈉、L-谷氨酰胺、2-巰基乙醇(Sigma,美國);轉(zhuǎn)化生長因子β1(PeproTech,美國);Y27632(APExBIO,美國);40 g/L多聚甲醛、甲苯胺藍溶液(Solarbio,北京)。倒置顯微鏡(DSZ2000X,奧特光學(xué),重慶)。
1.2 方法
1.2.1 iPSC的培養(yǎng) 使用DMEM-F12培養(yǎng)液按30∶1 比例稀釋Matrigel 基質(zhì)膠預(yù)先處理培養(yǎng)板,約2 h, iPSC復(fù)蘇后培養(yǎng)在預(yù)先處理好的六孔板內(nèi),培養(yǎng)液為補充有10 mM Y27632(ROCK1抑制劑)的mTeSR1,置于37 ℃ 5% CO2的飽和濕度培養(yǎng)箱中培養(yǎng),每日更換培養(yǎng)液mTeSRTM1,直到細胞生長至六孔板底面積的80%~90%,進行傳代。
將生長至六孔板底面積的80%~90%的iPSC,PBS 沖洗 2 遍,用dispase酶消化并中和后,用移液管盡可能劃成均勻小塊狀后,用刮板收集iPSC 懸浮于EB形成培養(yǎng)液中 (DMEM-F12培養(yǎng)液+2 mmol/L L-谷氨酰胺+0.2 mmol/L抗壞血酸-2-磷酸), 輕輕吹打5~10次使細胞克隆變?yōu)榇笮≥^均一的小細胞團,每 2 d 更換1次培養(yǎng)液,培養(yǎng)7 d。
將培養(yǎng)瓶中的EB球,用DMEM-F12 基礎(chǔ)培養(yǎng)沖洗 2 遍后,更換MSCs 誘導(dǎo)培養(yǎng)液(DMEM高糖基礎(chǔ)培養(yǎng)液+10% FBS+2 mmol/L L-谷氨酰胺+0.1 mmol/L 2-巰基乙醇+非必需氨基酸),將培養(yǎng)液和細胞的混合液吸至Matrigel 基質(zhì)膠鋪板的6孔板內(nèi),讓其貼壁并增殖4~7 d,進行下一步操作,后續(xù)所有實驗均重復(fù)3次。
0.25%胰酶消化細胞制成單細胞懸液,接種至6孔板內(nèi),并繼續(xù)使用 MSCs誘導(dǎo)培養(yǎng)液培養(yǎng)細胞,當細胞達到90%后,0.25%胰酶消化細胞并按照1∶3的比例進行細胞傳代培養(yǎng)。傳代培養(yǎng)的細胞可用來進行流式細胞術(shù)表面標志物的鑒定及成骨、成軟骨的鑒定。
1.2.2 流式細胞術(shù)鑒定細胞表面標志 胰酶消化iPS-MSCs 后重懸細胞分為5管,每管加入濃度為 2×105/100 μl細胞懸液后,300 g 離心7 min 后去上清,分別加入熒光標記小鼠抗人單克隆抗體CD29 CD105 CD34 CD45,對照管不做處理;室溫下避光反應(yīng)15 min,加入1 ml PBS混勻,以300 g離心7 min,洗滌3次。200 μl PBS液重懸,上機進行檢測。
1.2.3 成骨誘導(dǎo)分化及檢測 將誘導(dǎo)的MSCs 樣細胞以8×104個/cm2的密度接種于6孔板,第 2天換成骨誘導(dǎo)液(α-MEM、15% 胎牛血清、0.1 μmol/L地塞米松、50 μmol/L維生素 C、10 mmoL/L β-甘油磷酸鈉),每 3 d換液 1次。誘導(dǎo)期間每天在倒置顯微鏡下觀察細胞形態(tài)變化。成骨誘導(dǎo)14 d后按試劑盒說明進行堿性磷酸酶(Alkaline phosphatase)活性檢測,倒置顯微鏡觀察染色細胞并拍照。
1.2.4 成軟骨誘導(dǎo) 將3×105個iPS-MSCs細胞置于15 ml聚丙烯管中,以1200 r/min離心3 min,并重新懸浮于軟骨形成培養(yǎng)液(高糖DMEM,10%FBS,1%ITS+1,1mM丙酮酸鈉,50 μg/ml抗壞血酸2-磷酸,50 μg/ml脯氨酸,人10 ng / ml TGF-β1,100 nM地塞米松),旋松離心管蓋,正立于37 ℃、5% CO2、濕度大于 95% 的培養(yǎng)箱培養(yǎng)。24 h 后,加入成軟骨誘導(dǎo)體系 0.5 ml。每 3 d換液,誘導(dǎo)4周后,將細胞微球以 10%中性甲醛固定,送病理科進行石蠟包埋切片。切片用5% 甲苯胺藍37 ℃染色 30 min,水洗、封片、拍照。
1.2.5 成神經(jīng)細胞誘導(dǎo) 將EB 鋪板,培養(yǎng)4 d的細胞以8×104個/cm2的密度接種于 6孔板,第 2天換成神經(jīng)細胞誘導(dǎo)液[DMEM / F-12培養(yǎng)液,神經(jīng)基礎(chǔ)培養(yǎng)液,1%FBS,1×谷氨酰胺,1× N2添加劑,和1×B27添加劑],BDNF/GDNF 10 μg/ml誘導(dǎo)期間每天在倒置顯微鏡下觀察細胞形態(tài)變化。
2 結(jié) 果
2.1 iPSC及誘導(dǎo)后細胞形態(tài)的變化 iPSC在Matrigel 基質(zhì)膠上呈典型的克隆狀生長,克隆呈集落狀、隆起的圓形或者橢圓形,邊界清晰,細胞團內(nèi)細胞排列緊密,界限和形態(tài)不易區(qū)分(圖 1A);將細胞團進行懸浮培養(yǎng)形成EB過程中,細胞團逐漸變大且變得致密,顯微鏡下為大小較為均勻的小球(圖 1B);將EB球接種在6孔板后,細胞球在板內(nèi)鋪展生長,增殖速度加快,細胞之間排列更加致密,細胞呈現(xiàn)層疊生長(圖 1C);單個細胞接板進行培養(yǎng)后,可見細胞體積逐漸增大,逐漸向集落周圍伸展,隨著培養(yǎng)天數(shù)的增多,向外伸展的細胞逐漸增多,并呈圓形或橢圓形平鋪于培養(yǎng)板底,細胞排列緊密,胞質(zhì)豐富(圖1D)。

圖1 iPSC向MSCs細胞分化過程中不同階段細胞形態(tài)
2.2 細胞表面標志物的鑒定 流式細胞術(shù)結(jié)果顯示,iPSC中 CD105、CD29表達陽性, CD34、CD45表達陰性,符合iPSC--- MSCs表面標志物表達結(jié)果(圖2)。
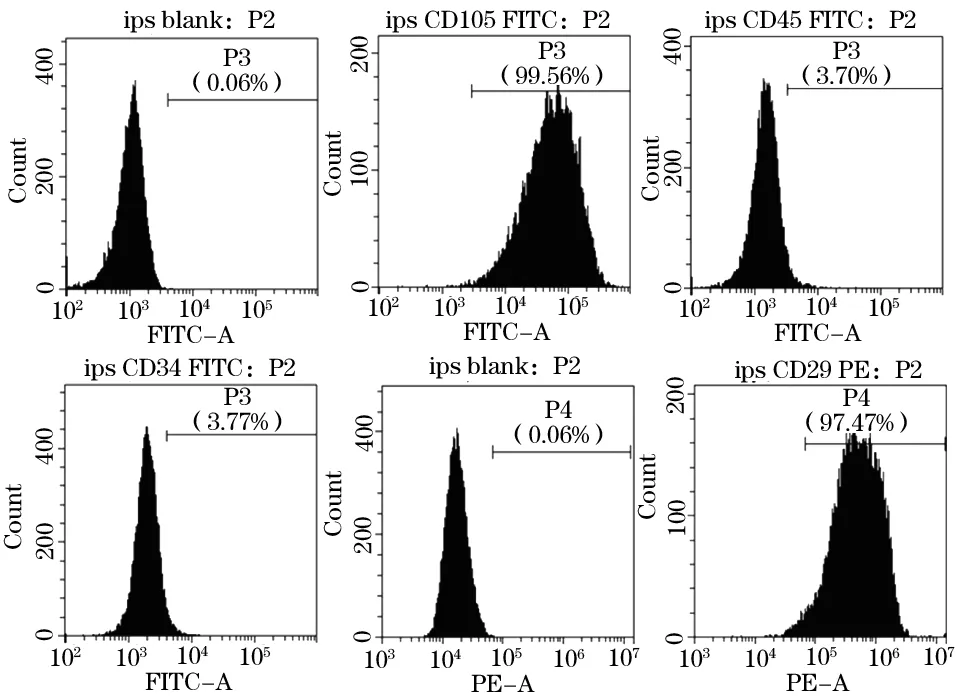
圖2 流式細胞術(shù)鑒定 iPS-MSCs 細胞表面標志物
2.3 iPSC-MSCs分化能力的鑒定 (1)成骨誘導(dǎo): iPSC-MSCs成骨誘導(dǎo)14 d倒置顯微鏡下可見較多細胞由梭形變?yōu)槎嘟切魏蜋E圓形,且胞體增大,突起增多,胞核變大變圓,胞質(zhì)內(nèi)出現(xiàn)較多顆粒。堿性磷酸酶染色示細胞細胞質(zhì)內(nèi)出現(xiàn)藍色沉淀(圖 3A)。(2)成軟骨誘導(dǎo): iPSC-MSCs 經(jīng)成軟骨誘導(dǎo)培養(yǎng)液培養(yǎng)4周后可見細胞團聚集成小球狀, 切片經(jīng) 1% 甲苯胺藍染色后可見軟骨基質(zhì)呈藍色(圖3B)。(3)成神經(jīng)細胞誘導(dǎo):經(jīng)貼壁培養(yǎng)可觀察到神經(jīng)纖維狀突起呈放射狀從克隆團周圍伸出。維持培養(yǎng),形態(tài)學(xué)改變的細胞數(shù)目增加,細胞分叉增多,呈現(xiàn)神經(jīng)元樣形態(tài)(圖3C)。
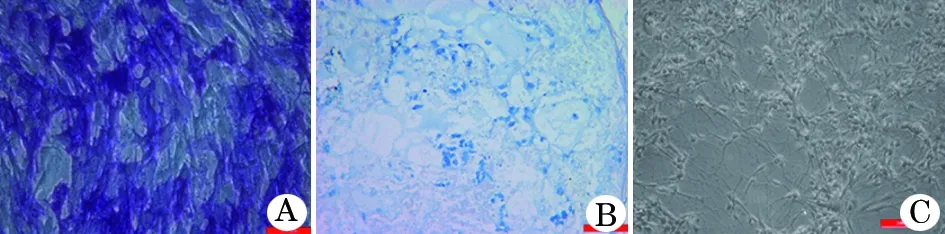
圖3 iPSC-MSCs 多向分化能力的鑒定
3 討 論
iPSC 技術(shù)的誕生極大豐富了干細胞的來源[14,15]。近年來,iPSC技術(shù)發(fā)展迅速,早期如致瘤率高、誘導(dǎo)效率低、iPSC全能性差等問題都逐漸得到解決。目前,雖然iPSC還不能完全代替胚胎干細胞,但是其成功地避免了免疫排斥和倫理問題,因此成為再生醫(yī)學(xué)理想的種子細胞。
本實驗培養(yǎng)的人iPSC具有和胚胎干細胞類似的生長特性,能在體外長期穩(wěn)定地傳代培養(yǎng)并保持未分化狀態(tài)。將iPSC培養(yǎng)形成EB球后,經(jīng)特定培養(yǎng)液誘導(dǎo)后外胚層細胞可分化為神經(jīng)細胞,中胚層細胞經(jīng)誘導(dǎo)培養(yǎng)可表現(xiàn)出MSCs 的生長特性和分化特性,中、外胚層的多向分化特性綜合證明了該實驗培養(yǎng)及誘導(dǎo)方法的有效性和可借鑒性。
在iPSC的培養(yǎng)階段,諸多研究者會用滋養(yǎng)層對iPSC進行培養(yǎng)[16-18],但因考慮到飼養(yǎng)層細胞的好壞可以影響iPSC細胞的生長狀態(tài)及進行飼養(yǎng)層培養(yǎng)的復(fù)雜性,本實驗以Matrigel 基質(zhì)膠代替飼養(yǎng)層組織,結(jié)合 mTeSRTM 1 培養(yǎng)液培養(yǎng)iPSC,簡化了實驗操作過程。
iPSC培養(yǎng)形成EB球后,因神經(jīng)細胞是由外胚層細胞分化而來,本實驗將形成的EB球直接用于成神經(jīng)細胞誘導(dǎo)培養(yǎng)而不經(jīng)過MSCs階段,區(qū)別于后續(xù)成骨、成軟骨細胞的誘導(dǎo)。
從EB球到誘導(dǎo)形成MSCs 樣細胞, 并經(jīng)多次傳代純化MSCs細胞。從形態(tài)學(xué)上發(fā)現(xiàn)MSCs 樣細胞逐漸展現(xiàn)出長梭形。表面標記已成為鑒定MSCs群體的標準工具,通過流式細胞術(shù)鑒定iPSC-MSCs 表面標志物表達情況時發(fā)現(xiàn)iPSC-MSCs中 MSCs標記物內(nèi)皮糖蛋白CD105,整合素家庭成員CD29 均表達陽性,表達量分別為 99.56%和99.47%,造血干細胞標志物 CD34 和泛白細胞標志抗原CD45 均表達陰性(3.77% 和3.70%),與MSCs 表面標記物的表達結(jié)果相符。說明通過該方法可以成功將 iPSC 誘導(dǎo)為MSCs樣細胞,誘導(dǎo)后 iPSC -MSCs 經(jīng)多次傳代后均能保持一致,且經(jīng)分化誘導(dǎo)后,成骨、成軟骨染色都為陽性結(jié)果。
本實驗中iPSC -MSCs的誘導(dǎo)是采取經(jīng)典策略---逐步分化,即先將iPSC 在體外形成擬胚體,隨后通過更換擬胚體細胞培養(yǎng)液培養(yǎng),再進一步使用MSCs培養(yǎng)液誘導(dǎo)其分化為MSCs樣細胞,最后通過誘導(dǎo)分化培養(yǎng)液將MSCs樣細胞進行定向誘導(dǎo)分化[11-13]。該方法獲得的MSCs樣細胞純度高,但需經(jīng)過多次傳代分選,操作相對繁瑣。有研究者在此基礎(chǔ)上做了簡化,iPSC不先形成EB球,而是通過將iPSC一步分化為MSCs后誘導(dǎo)為譜系細胞[14,15]。
本研究采用較為簡便的方法成功驗證iPSC的多向分化能力,為進一步研究和應(yīng)用iPSC 奠定了理論和技術(shù)基礎(chǔ)。隨著研究的深入,iPSC可能成為再生治療組織損傷的一種新的細胞來源。但是,iPSC的研究仍處于初級階段,今后需要更深入研究iPSC定向分化的具體機制、調(diào)控要點、影響因素等,明確功能恢復(fù)機制、優(yōu)化細胞移植條件,使得iPSC真正成為再生醫(yī)學(xué)中的理想工具。

