過硫酸銨在濕法鋅冶煉系統中除錳的研究與應用
楊志鋒, 任 杰
(巴彥淖爾紫金有色金屬有限公司, 內蒙古 巴彥淖爾 015543)
1 概述
巴彥淖爾紫金有色金屬有限公司采用硫酸鋅溶液濕法煉鋅,選用MnO2做氧化劑除去硫酸鋅浸出液中Fe,將Mn2+留在系統中[1]。在正常的生產中,濕法系統中含Mn2+離子濃度為10~12 g/L,此時在電解過程中在陽極板上電極出致密的MnO2薄膜層,有效地起到保護陽極板的作用[2],從而抑制陰極鋅含鉛超標。但有時候,因為一些技術操作及其他原因,導致Mn2+離子升高,對生產造成很大的影響。例如焙砂殘硫較高時,MnO2使用量大增,使系統的Mn2+離子濃度在短時間內升至20 g/L左右,電解時,產生大量的陽極泥,造成電解清槽工作量增大,剝離陽極泥會使陽極板受到損害,電解液含鉛升高,以至陰極鋅含鉛升高[3]。同時造成電耗增大,電流效率降低,與正常生產時相比,電流效率下降3%~4%,對生產造成了很壞的影響。因此,維持系統中Mn2+離子濃度在合適的范圍內,對現場生產具有重要的意義。
從幾種傳統的硫酸鋅溶液凈化除錳方法來看[4-5]:漂白粉和次氯酸鈉兩種氧化法會將Cl-離子帶入系統中,對設備危害較大;采用電解法在公司系統內實施較為困難,高錳酸鉀價格較貴;用過硫酸銨除錳時,加入的銨、鈉離子,可以作為沉礬的配位劑,不會引入對生產有害的雜質,而且過量的過硫酸銨在液體中分解放出氧氣,不會對凈化造成影響。所以,本文重點考察過硫酸銨對除錳的效果。
2 試驗部分
2.1 實驗原理和方法
1)實驗原理。過硫酸銨為強氧化劑,在中性溶液中,能將Mn2+離子氧化成MnO2沉淀。其反應方程式見式(1)~(3)。

(1)

(2)

2H2SO4+(NH4)2SO4
(3)
2)實驗方法。取中上清500 mL,加熱至一定溫度后,加入一定量的過硫酸銨反應,同時滴加碳酸鈉溶液來調節酸度,反應結束后過濾,測后液含錳離子濃度。
2.2 實驗數據與討論
通過實驗,分別考察反應時間、反應溫度和酸度等條件對除錳的影響。
2.2.1 反應時間對除錳的影響
反應溫度90 ℃,保持pH=5.2~5.4,過硫酸銨加入量120%,考察不同反應時間對除錳的影響,實驗數據見表1。

表1 應時間對除錳的影響 g/L
從表1可以看出,隨著反應時間的增加,溶液中錳離子逐漸下降,但大部分錳離子在1 h內已經沉淀。
2.2.2 反應溫度對除錳率的影響
保持pH=5.2~5.4,過硫酸銨加入量120%,反應時間3 h,考察不同反應溫度對除錳的影響,實驗數據見表2。
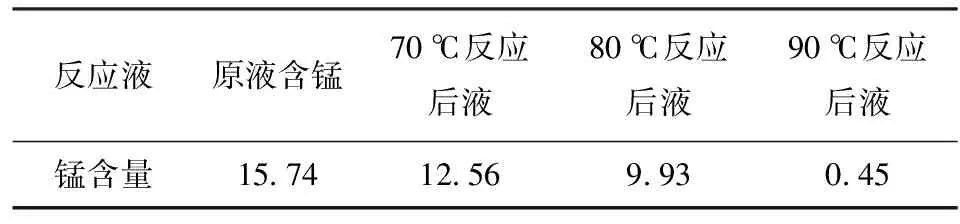
表2 反應溫度對除錳的影響 g/L
從表2可以看出,隨著溫度的升高,溶液中錳離子逐漸下降,因此除錳最佳溫度控制在90 ℃以上。
2.2.3 酸度對除錳的影響
反應溫度90 ℃,過硫酸銨加入量120%,反應3 h后,考察不同酸度對除錳的影響,實驗數據見表3。

表3 酸度對除錳的影響 g/L
從表3可以看出,保持pH=5.2~5.4,對溶液除錳有一定好處,與反應動力學原理相符合,后液含錳約降低一倍,但相差不是很大,為了對下一步的溶液凈化產生影響,應對pH值進行控制。
2.2.4 最優條件平行試驗
反應條件按照:反應溫度90 ℃,過硫酸銨加入量120%,加入碳酸鈉保持pH=5.2~5.4,反應3 h后,進行壓濾分析,結果見表4。

表4 平行試驗 g/L
備注:序號1#~3#為平行試驗。
從表4可以看出,試驗除錳氯高達95%以上,效果比較理想。
2.3 中試擴大試驗
取中上清750 L,加入1 000 L反應槽中,按照小試最優條件:反應溫度90 ℃,過硫酸銨加入量120%,加入碳酸鈉保持pH=5.2~5.4,反應3 h后,壓濾分析,結果見表5。

表5 中試除錳數據 g/L
注:序號1#~3#為平行試驗。
從表5發現,試驗除錳氯高達95%以上,效果比較理想。
2.4 工業化試驗
取中上清45 m3,加入50 m3反應槽中,按照小試最優條件:反應溫度90 ℃,過硫酸銨加入量120%,加入碳酸鈉保持pH=5.2~5.4,反應3 h后,壓濾分析,其結果見表6。

表6 工業化除錳數據 g/L
注: 1#、2#為平行試驗。
從表6發現,試驗除錳氯高達96%以上,效果較為理想。
3 結論與建議
在采用硫酸鋅溶液濕法煉鋅工藝中,采用過硫酸銨在中上清中除錳可以取得很好的效果,最佳反應條件為:反應溫度90 ℃,過硫酸銨加入量120%,加入碳酸鈉保持pH=5.2~5.4,反應3 h后,后液含錳可達0.45 g/L,除錳率達95%以上。
由于公司為20萬t/a電鋅濕法系統,總體積約有6萬m3,用此方法除錳,除錳時新增設備較大,成本較高,因此結合現場提出以下建議。
1)除去2萬m3液體中的錳離子,就可以使錳離子下降到理想濃度,但要注意與未除錳液混勻; 因為在1 h后,除錳后液即可降至3.03 g/L,大部分錳離子已經沉淀,建議反應時間縮短至1 h。
2)同時建議在焙砂殘硫偏高、二氧化錳使用量增加時,用過硫酸銨代替部分二氧化錳,有效避免系統錳離子急劇升高,對生產系統帶來的影響。

