核因子κB信號通路與變應性鼻炎的關系
李 麗,張小兵
(1.蘭州大學第一臨床醫學院,蘭州 730030;2.蘭州大學第一醫院耳鼻咽喉頭頸外科,蘭州 730030)
變應性鼻炎(allergic rhinitis,AR)是發生在鼻腔黏膜的變態反應。目前,AR已成為全球性健康問題,我國患病人數多達4億,發病率仍呈逐年升高趨勢[1]。AR的發病與攜帶易感基因、免疫失衡、炎性介質釋放等因素有關。AR的主要臨床特征為鼻癢、打噴嚏、大量清水涕等。2015年《變應性鼻炎診斷和治療指南》建議,鼻用糖皮質激素是AR的一線用藥,但由于AR的病程長和易反復發作等特點,現有治療方案僅能短期緩解患者臨床癥狀,激素耐藥問題也日益突出,成為困擾臨床醫師和患者的難題[2]。近年來,國內外大量研究表明,核因子κB(nuclear factor κB,NF-κB)信號通路與細胞因子、炎性因子、趨化因子的合成以及調控相關免疫細胞的發育及其正常功能的行使密切相關,以NF-κB為靶點的藥物研究為治療變應性炎癥提供了新思路[3-6]。目前,AR與NF-κB信號通路的關系及作用機制的研究已取得一定進展,已研發出相關小分子靶向藥物。現就NF-κB信號通路與AR黏膜高分泌、免疫細胞發育相關基因和T細胞分化的關系以及靶向抑制NF-κB的策略和臨床意義予以綜述,以探究其在AR中的臨床應用前景。
1 NF-κB信號通路的概述
NF-κB是核轉錄因子蛋白家族成員,由兩組5個結構類似的蛋白成員組成,第1組是NF-κB發揮活性作用的形式,包括p65相關因子(related,Rel)A、RelB和c-Rel;第2組包括NF-κB1(p105/p50)和NF-κB2(p100/p52)[7]。靜息狀態下,NF-κB抑制蛋白(inhibitor-NF-κB protein,IκB蛋白)可使NF-κB二聚體以無活性形式滯留在細胞質中。當細胞受到外界刺激后,可使IκB激酶激活,IκB激酶磷酸化IκB蛋白,繼而泛素化并降解,使NF-κB暴露核定位的位點,從而釋放NF-κB二聚體,隨后NF-κB二聚體進入細胞核,并與DNA的特異性位點結合,調節靶基因的表達[8]。NF-κB激活后,可導致白細胞介素(interleukin,IL)1β、IL-6、腫瘤壞死因子α(tumor necrosis factor α,TNF-α)等炎性細胞因子的表達,而IL-1β、TNF-α的基因產物又可直接激活NF-κB信號通路,擴大炎癥反應,即信號通路激活中的級聯瀑布效應[9]。
2 NF-κB信號通路在AR發病機制中的作用
2.1與AR鼻黏膜高分泌的關系 鼻黏膜高分泌性是AR的主要特征之一,正常情況下黏液的產生與代謝保持動態平衡,但在病理狀態下,黏液的異常分泌可降低呼吸道黏膜功能和變應原的清除,從而加劇AR的慢性炎癥過程。AR的黏液高分泌與白三烯、TNF-α、前列腺素、IL-4、IL-9和IL-13等炎性因子和細胞因子密切相關,而NF-κB信號通路廣泛參與炎性介質和前炎性介質(TNF-α、IL-1β)以及一些炎癥相關酶類(基質金屬蛋白酶、環加氧酶和一氧化氮合酶)等基因的調控[10]。水通道蛋白(aquaporin,AQP)家族與氣道液體分泌密切相關,其中AQP5大量分布于鼻黏膜上皮細胞。Song和Verkman[11]用毛果蕓香堿刺激AQP5缺失小鼠和野生型小鼠發現,AQP5可能是氣道液體分泌的重要因素,同時也是氣道液體分泌的限速屏障。NF-κB可下調AQP5的表達,王偉偉[12]通過建立AR大鼠模型發現,AQP5、磷酸化環腺苷酸反應元件結合蛋白(cAMP-responsive element-binding protein,CREB)的表達與NF-κB的p65表達呈負相關,AQP5的表達與磷酸化CREB呈正相關,磷酸化CREB的表達與TNF-α、IL-1β、IL-6等炎癥基因呈負相關,由此推測,NF-κB信號通路可能通過炎性細胞因子抑制CREB磷酸化途徑或通過NF-κB的p65與磷酸化CREB在133位點(Ser133)競爭性結合細胞核內轉錄輔助因子結合位點,下調AQP5表達。Wang和Zheng[13]的研究證明,NF-κB的活化可能通過上調TNF-α和IL-6兩種炎性因子的表達導致AR小鼠模型中黏蛋白5AC的高分泌。Towne等[14]的研究發現,TNF-α能夠激活TNF-α受體1從而抑制AQP5的表達,而NF-κB信號通路參與TNF-α受體1的激活。Wang和Zheng[15]發現,NF-κB能夠通過IL-1β下調AQP5的表達,導致大鼠AR的發生。綜上所述,NF-κB信號通路可直接調控參與AR黏液高分泌的炎性細胞因子基因表達,并可通過上調炎性因子導致黏蛋白5AC高分泌和AQP5的表達減少,引起鼻腔分泌物清除或重吸收障礙,從而導致AR高分泌性。
2.2NF-κB活化與機體免疫應答的關系 AR屬于Ⅰ型變態反應,發病過程涉及肥大細胞、嗜酸粒細胞、中性粒細胞、巨噬細胞、T淋巴細胞等多種免疫細胞。NF-κB信號通路不僅在自然殺傷細胞、樹突狀細胞、單核細胞、粒細胞系等免疫細胞的發育和功能行使中發揮作用,還通過調節細胞因子和趨化因子的基因轉錄表達在免疫應答中發揮關鍵作用[16]。氣道細胞由NF-κB調控的炎癥靶分子主要包括以下幾種。①淋巴細胞:包括嗜酸粒細胞趨化因子1、調節激活正常T細胞表達和分泌的細胞因子、γ干擾素(interferon γ,IFN-γ)、IL-2、IL-4、IL-5、IL-13;②嗜酸粒細胞:TNF-α、IL-8、細胞間黏附分子1、白細胞功能相關抗原1;③中性粒細胞:IL-8、IL-1Ra、粒細胞-巨噬細胞集落刺激因子;④巨噬細胞:單核細胞趨化蛋白1、IL-8、生長相關性癌基因α;⑤上皮細胞:胸腺基質淋巴細胞生成素、細胞間黏附分子1、血管細胞黏附分子1、IL-8、IL-6、粒細胞-巨噬細胞集落刺激因子、生長相關性癌基因α、調節和激活正常T細胞表達和分泌、單核細胞趨化蛋白1、黏蛋白5AC等[17]。有研究表明,在以上炎性細胞相關基因調控元件中存在不同數量的κB基序,與NF-κB結合后,以多位點協同作用上調細胞因子的表達。此外,NF-κB參與重要免疫受體表達的調節,如可在主要組織相容性復合體Ⅰ類分子和T細胞受體基因的調控區發現κB基序,并在細胞介導的免疫應答中起關鍵作用[18]。NF-κB在初級(骨髓和胸腺)和次級(淋巴結、派氏集合淋巴結、黏膜相關淋巴組織和脾臟)淋巴組織的發育以及功能行使中發揮重要作用[16]。綜上所述,NF-κB信號通路的活化貫穿機體的整個免疫應答過程。
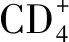
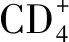
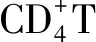
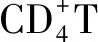
2.3.4NF-κB信號通路在Treg細胞分化中的作用 Treg細胞通過分泌IL-10、轉化生長因子β等抑制由效應T細胞引起的免疫應答介導機體的抗炎反應,Treg細胞功能低下可能導致變應性疾病的發生[20]。Treg細胞在胸腺中經過自然選擇過程后,依據發育來源分為天然Treg細胞和胸腺Treg細胞,其中胸腺Treg細胞的發育需經過T細胞受體依賴的和非T細胞受體依賴兩個步驟,而IκB激酶作為T細胞受體信號傳遞中的重要介質,其數量減少或缺乏可導致胸腺Treg細胞數量下降,提示NF-κB可能在胸腺Treg細胞發育中起作用[24]。此外,Treg細胞發揮免疫調節作用依賴于叉狀頭/翅膀狀螺旋轉錄因子3的高水平穩定表達,現已發現叉狀頭/翅膀狀螺旋轉錄因子3基因座中存在CNS1、CNS2和CNS3三個高度保守的非編碼序列,其中NF-κB亞基c-Rel與CNS3結合,在胸腺和外周叉狀頭/翅膀狀螺旋轉錄因子3的表達和Treg細胞分化中起主要作用[32-33]。總之,NF-κB在特異性T細胞亞群的發育與活化過程中具有不同的作用,在免疫細胞功能失衡和免疫反應失調中與其他信號通路的交互作用仍是新的研究領域,有望研究出針對失衡細胞類型或細胞功能的靶向治療方法。
3 靶向抑制NF-κB的策略
NF-κB的激活包括IκB激酶激活、IκB磷酸化和泛素化、IκB解體、NF-κB向核內遷移、NF-κB亞基與DNA結合等過程,故可針對以上環節抑制NF-κB過量激活[34]。NF-κB小分子靶向抑制劑的研究是目前的重點,現已發現:①NF-κB靶向抑制劑誘餌寡脫氧核苷酸是一組雙鏈DNA片段,具有與DNA上轉錄因子結合位點相同的序列,這種競爭性占位效應阻礙了基因啟動區NF-κB結合位點與NF-κB的結合,顯著降低了下游基因的表達[35]。Wee等[9]的AR小鼠模型證實,誘餌寡脫氧核苷酸可下調血清總IgE、IgG1和卵清蛋白特異性IgE的水平,對鼻黏膜中IL-5、TNF-α和細胞間黏附分子1的表達也有抑制作用,此外,誘餌寡脫氧核苷酸還可明顯下調脾臟中Th2型細胞因子IL-4和IL-5的表達。②Towne等[14]發現,NF-κB特異性抑制藥二硫代氨基甲酸吡咯烷能夠通過抑制AR大鼠TNF-α和IL-6的表達從而抑制鼻腔黏蛋白5AC的分泌。另有動物實驗也證實二硫代氨基甲酸吡咯烷有廣泛的抗氧化應激和抗炎作用[36-37]。③NF-κB必需調節劑是NF-κB介導的信號轉導中的關鍵調節因子,可通過傳遞細胞外或細胞內信號阻止IκB激酶復合物促炎反應活性的激活,控制NF-κB調節的基因,為選擇性調節NF-κB功能藥物的開發提供新的靶向[38]。④Shimizu等[39]發現,NF-κB的特異性抑制劑脫氫甲基環氧醌霉素可通過抑制NF-κB組分與DNA的結合來抑制哮喘小鼠模型中支氣管上皮細胞嗜酸粒細胞趨化因子1的表達以及嗜酸性氣道炎癥,包括Th2型細胞因子的產生和后續的氣道重塑過程,但其對AR的相關炎性因子的抑制作用還需進一步探究。⑤Sidthipong等[40]設計并合成了一種脫氫甲基環氧醌霉素的類似物——(S)-β-水楊酰氨基-α-外-亞甲基-γ-丁內酯,可在體外抑制NF-κB的p65亞基與DNA結合,從而抑制脂多糖誘導的NF-κB活化、誘導型一氧化氮合酶表達和炎性細胞因子的分泌,在水溶液中較脫氫甲基環氧醌霉素具有更高的穩定性,有望成為新的抗炎藥物候選者。
4 問題與展望
隨著精準醫學概念的提出,分子生物學、信號轉導機制、信號通路交互作用已成為研究熱點。對NF-κB信號通路與AR發病間關系及其機制的探究有利于進一步尋找具有靶細胞特異性的NF-κB活化阻斷劑,對AR治療具有潛在意義。目前仍面臨的主要問題有:①AR是基因調節下多細胞、多通路參與的慢性炎癥性疾病,其發病機制及信號通路間的交互作用深入而復雜,抑制NF-κB信號通路后是否會影響其他通路的正常功能仍需探究;②NF-κB是最常見、最豐富的轉錄因子,可作為關鍵性核轉錄因子參與多條炎癥反應信號通路,調節炎癥反應和免疫反應,因此,如何在不影響正常功能發揮的前提下抑制其調節失衡是需要攻克的難點;③大多數相關研究均使用細胞培養和動物模型完成,未來仍需進行研究來確定其在人類疾病中的臨床重要性。期待進一步的研究能對兩者間的關系做出全面闡述。

