針灸預處理對大鼠心肌缺血再灌注損傷保護作用
朱建剛 宋先斌 楊紅娟 翟昌林


[摘?要]?目的?研究針灸預處理調節內質網應激對心肌缺血再灌注損傷的保護作用。方法?將45只SD大鼠隨機分為四組,即:假手術組(Sham組)、模型組(I/R組)、針灸預處理組(EP組)、針灸預處理+LY294002組(EP+LY294002組)。I/R組、EP組、EP+LY294002組分別建立心肌缺血再灌注損傷模型,EP組與EP+LY294002組預先予以電針“內關穴”處理,EP+LY294002組于手術前1周皮下注射LY294002試劑。手術后1周超聲心動圖測定各組大鼠心功能,HE染色法觀察心肌組織損傷情況,蛋白免疫印跡法測定Akt通路及內質網應激相關蛋白GRP78、CHOP、Caspase12的表達情況。結果?超聲心動圖結果顯示,EP組左心室收縮末期壓力(LVESP)、壓力上升最大速率(dp/dt max)、壓力上升最小速率(dp/dt min)水平均高于I/R組,左心室舒張末期壓力(LVEDP)低于I/R組(均P<0.01),EP+LY294002組LVESP、dp/dt max、dp/dt min均低于EP組,LVEDP高于EP組(均P<0.01)。HE染色示,與I/R組相比,EP組心肌細胞損傷明顯減輕,少量炎性細胞堆積,心肌纖維走形較規律;與EP組相比,EP+LY294002組心肌組織損傷再次出現加重。蛋白免疫印跡結果顯示:與I/R組相比,EP組p-Akt表達明顯增加(P<0.01),與EP組相比,EP+LY294002成功阻斷p-Akt表達,內質網應激相關蛋白GRP78、CHOP、Caspase12表達顯著回升(均P<0.01)。結論?針灸預處理可有效降低內質網應激從而發揮心肌缺血再灌注損傷的保護作用,其機制可能與Akt通路激活相關。
[關鍵詞]?針灸;Akt通路;內質網應激;心肌缺血再灌注
中圖分類號:R542;R245
文獻標識碼:A文章編號:1009-816X(2019)02-0120-04
doi:10.3969/j.issn.1009-816x.2019.02.004
隨著社會發展,我國人民飲食結構及工作環境的改變導致冠心病的發病率居高不下,心肌缺血最有效的治療方式便是再灌注治療,但是心肌缺血后重新血液灌注會導致心肌細胞結構破壞和功能代謝障礙從而加重臨床癥狀,這一過程稱之為心肌缺血再灌注(ischemia reperfusion,I/R)損傷[1,2]。冠狀動脈搭橋術(CABG)、經皮冠狀動脈腔內成形術(PTCA)、急診溶栓等在治療冠心病的過程中勢必會引起I/R損傷,因此如何有效抑制心肌缺血再灌注損傷已成為臨床難題[3]。本研究旨在探索針灸預處理對于心肌缺血再灌注損傷的保護作用及其與內質網應激(ERS)相關的調節機制。
1?材料與方法
1.1?實驗材料:45只雄性SD大鼠購于浙江中醫藥大學實驗動物中心,動物許可證為:SCXK(浙)2016—0065,平均體質量(250.08±30.11)g,飼養于SPF動物房,充足食水喂養;Akt、GRP78、CHOP、Caspase12抗體均購自CST公司,羊抗兔二抗購自谷歌生物公司,Akt通路抑制劑LY294002試劑購自Sigma公司。45只SD大鼠隨機分為4組,即假手術組(Sham組)9只、模型組(I/R組)12只、針灸預處理組(EP組)12只、針灸預處理+LY294002組(EP+LY294002組)12只。
1.2?方法:(1)Sham組:僅進行開胸手術,穿線但不結扎左心房(LA)動脈,開胸1.5h后關閉胸腔;(2)I/R組:建立心肌I/R損傷模型;(3)EP組:于手術前2周進行電針大鼠“內關穴”處理,進針深度0.4~0.6cm,電流設定為0.1Ma,頻率設定為1赫茲,隔日1次,每次針灸15min,共針灸7天。(4)EP+LY294002組:在針灸“內關穴”基礎上,于手術前1周予以皮下注射LY294002溶液,劑量為4mg/kg每天,連續注射7天。
1.2.1?心肌I/R損傷模型的建立:參照Dhalla等[4]的方法建立大鼠心肌I/R損傷模型,戊巴比妥鈉(80mg/mL)腹腔注射,待大鼠翻轉反射消失后固定于手術臺面,予氣管插管后連接大鼠呼吸機(SAR-830),正壓通氣,每分鐘頻率60次,心前區備皮,于胸骨左緣1cm處做一縱行切口,依次分離皮下筋膜及肌肉組織,定位第4肋間,有齒鑷提拉心包膜,組織剪做一小切口,鈍性分離,充分暴露心臟,定位于肺動脈圓錐與左心耳之間,左心耳往下2~3cm處穿線結扎冠狀動脈,血流阻斷30min后松開結扎線,予血流再灌注1小時,I/R損傷模型的建立以心電圖結果判斷:ST段弓背向上抬高0.5mv定義為心肌缺血,再灌注后抬高的ST段至少下降一半,伴有病理性Q波或心律失常出現。I/R損傷建立后逐層縫合關閉胸腔,術后予肌注青霉素100萬單位預防性抗感染,手術中死亡大鼠剔除實驗,手術后繼續常規
無特定病原體(SPF)級動物房喂養1周后行超聲心動圖檢查,而后處死各組大鼠,提取心臟組織進一步檢測相關指標。
1.2.2?HE染色:大鼠處死后,摘除各組大鼠心臟,冰0.9%氯化鈉溶液潤洗后固定于4%多聚甲醛中,組織脫水、石蠟包埋,3uM厚度組織切片,常規脫蠟,蘇木精染色5~10min,自來水流動沖洗,1%鹽酸乙醇中分化,自來水沖洗5min,伊紅染色3min,沖洗后于梯度乙醇脫水,中性樹膠封片后于顯微鏡下觀察拍照(奧林巴斯BX51)。
1.2.3?蛋白免疫印跡實驗:取梗死區心肌組織,以100mg:900ul的比例加入組織裂解液,于冰上勻漿裂解,4℃,12000g/min離心15min,取上清液以BCA法測定蛋白濃度,補充裂解液調節各組樣品蛋白濃度一致后加入上樣緩沖液,95℃變性5min后即可用于蛋白電泳,制適宜濃度的分離膠與濃縮膠,待凝固后每組樣品上樣80ug蛋白,60V電泳至marker分離,100V電泳至溴芬藍跑出后停止,制作轉膜三明治夾,100V電壓轉膜90min,TBST洗膜后5%脫脂牛奶室溫下封閉1小時,根據條帶位置剪膜,分別孵育對應一抗:p-Akt(1:1000)、t-Akt(1:1000)、GRP78(1:1000)、CHOP(1:1000)、Caspase12(1:1000),4℃搖床孵育過夜后TBST洗膜,羊抗兔二抗(1:5000)室溫下孵育1小時,洗膜后予以ECL化學顯影,Quantity One圖像分析軟件計算條帶灰度值。
1.3?統計學處理:采用SPSS 18.0版統計學軟件進行分析,計量資料首先進行正態性檢驗,符合正態分布的數據以(x-±s)表示,兩兩比較采用Dunnett-t檢驗,P<0.05為差異有統計學意義。
2?結果
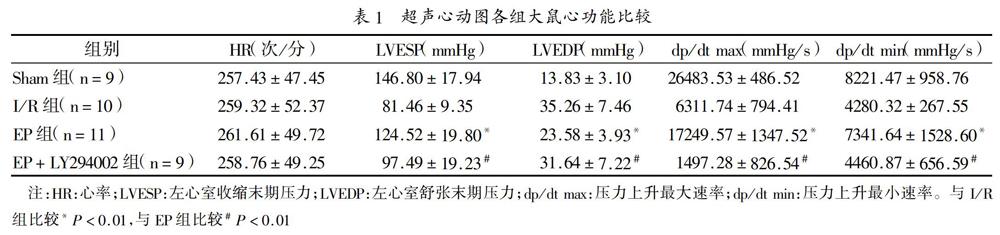
2.1?超聲心動圖心功能結果分析:手術過程中I/R組大鼠死亡2只,EP組大鼠死亡1只,EP+LY294002組大鼠死亡3只,手術后2周各組大鼠心功能比較結果為:EP組LVESP、dp/dt max、dp/dt min水平均高于I/R組,LVEDP低于I/R組,差異均有統計學意義(均P<0.01)。EP+LY294002組LVESP、dp/dt max、dp/dt min均低于EP組,LVEDP高于EP組,差異均有統計學意義(均P<0.01),見表1。
2.2?各組大鼠心臟梗死區HE染色結果比較:I/R組大鼠梗死區心肌組織中大量炎性細胞浸潤、組織損傷及細胞水腫明顯;與I/R組比,EP組心肌細胞損傷明顯減輕,無大片的炎性細胞堆積,心肌纖維走形較規整;與EP組比,Akt通路阻斷后,EP+LY294002組心肌組織損傷再次出現加重,圖1。
2.3?蛋白免疫印跡法分析Akt蛋白表達:與I/R組相比,EP組p-Akt表達明顯增加(P<0.01),EP+LY294002組p-Akt表達顯著降低,與各組相比均有統計學意義(均P<0.01),見圖2。
2.4?蛋白免疫印跡法分析內質網應激相關蛋白表達:與Sham組比,I/R組各內質網應激蛋白GPR78、CHOP、Caspase12的相對表達量明顯增高(均P<0.01),EP組相較于I/R組,各內質網應激蛋白相對表達量均出現明顯降低(均P<0.01)。而EP+LY294002組相較于EP組,各內質網應激蛋白的相對表達量均出現增高(均P<0.01),見圖3。
3?討論
心肌I/R損傷通常會造成心肌組織不可逆性損傷,心肌組織結構破壞及功能代謝障礙通常較急性心肌梗死發生時更為劇烈,患者心源性猝死機率也更高,因此緩解和治療缺血再灌注損害目前已成為臨床研究熱點[5,6]。
多種疾病的病理生理過程通常都涉及ERS,目前已知I/R損傷必然會引起心肌細胞的壞死及凋亡加重,但心肌細胞的凋亡與ERS發生的關系須進一步探討。Nickson等[7]研究證實ERS促進劑可顯著促進心肌“促凋亡蛋白Bcl-2”的轉錄上升,說明ERS與心肌細胞的凋亡存在正性聯系。Terai等[8]實驗證實心肌細胞在缺血缺氧后Caspase12與CHOP的表達明顯上升,該過程證實了心肌梗死中必然伴隨ERS的發生,從而引起心肌細胞凋亡;因此抑制ERS可有效減輕心肌梗死所致心肌損傷。Zhao等[9]研究證實,在心肌細胞培養液中添加脂氧素A4可抑制GRP78、CHOP因子的轉錄,從而減輕ERS反應對缺血缺氧后復氧的心肌細胞產生保護效應。Yu等[10]對大鼠腹腔注射曲古抑菌素后發現I/R損傷后的ERS反應明顯減弱了。上述研究結果提示抑制ERS可有效緩解I/R損傷所致的心肌細胞凋亡及功能障礙,而本文實驗結果也證實了這一點,即通過針灸預處理可有效降低I/R所致的內質網應激相關蛋白的指標。目前,針灸“內關穴”在改善心肌缺血及其機制已得到多方面的證實,如針灸預處理可有效減少蛋白激酶C的轉錄從而部分抑制心交感神經的活動[11];此外針灸預處理可促進血液中過氧化氫酶表達增加,一氧化碳釋放增多從而促進血管舒張保護心肌缺血[12];電針預處理亦可調節心肌酶的轉錄從而對缺血心肌產生保護作用[13]。我們先前的研究進一步證實了針灸預處理可對心肌缺血后的再灌注損傷有相應的保護作用,其機制與ERS的抑制顯著相關[14],然而針灸預處理如何調控ERS的發生發展而保護I/R損傷依然尚不明確,有待我們在以后實驗中進行深入探索。本研究通過超聲心動圖及HE染色再次證實了電針預處理可有效減輕由I/R損傷所導致的心功能損害及心肌組織損傷,當使用LY294002對Akt蛋白轉錄進行阻斷后,針灸對I/R損傷的保護作用驟然降低,此外通過蛋白免疫印跡實驗發現,Akt蛋白表達抑制后,針灸對I/R損傷所致的內質網應激蛋白GRP78、CHOP、Caspase12的抑制作用也明顯減弱。結合以上結果本文認為:針灸預處理抑制了I/R損傷所致的ERS的發生,該種保護作用可能與針灸預處理增加了Akt蛋白的表達相關。相關文獻也應證了本文結論:Tao等[15]發現Apelin-13蛋白可有效拮抗I/R所引起的ERS心肌細胞凋亡,其中PI3K/Akt通路的活化在其中扮演了重要角色;Yuan等[16]實驗建立了大鼠腦I/R損傷模型,同樣的使用了LY294002后,ERS所致的腦細胞損傷加重了,說明了PI3K/Akt通路的激活在腦缺血再灌住ERS細胞損傷中也發揮了重要作用。因此,Akt信號通路的活化與ERS的抑制在不同臟器的缺血再灌注損傷中均有密切的關系。綜上所述,針灸預處理可有效降低ERS發揮心肌I/R損傷的保護作用,其機制可能與Akt通路激活相關,從而為臨床針灸治療心肌I/R損傷提供了重要依據。
參考文獻
[1]Abrial M, Da Silva CC, Pillot B, et al. Cardiac fibroblasts protect cardiomyocytes against lethal ischemia-reperfusion injury[J]. Journal of molecular and cellular cardiology,2014,68(3):56-65.
[2]Bae S, Yalamarti B, Ke Q, et al. Preventing progression of cardiac hypertrophy and development of heart failure by paricalcitol therapy in rats[J]. Cardiovascular research,2011,91(4):632-639.
[3]Bulhak AA, Sjquist P O, Xu C B, et al. Protection against myocardial ischaemia/reperfusion injury by PPAR-α activation is related to production of nitric oxide and endothelin–1[J]. Basic research in cardiology,2006,101(3):244-252.
[4]Dhalla NS, Elmoselhi AB, Hata T, et al. Status of myocardial antioxidants in ischemia-reperfusion injury[J]. Cardiovascular research,2000,47(3):446-456.
[5]Chen WP, Tzeng HJ, Ku HC, et al. Thaliporphine ameliorates cardiac depression in endotoxemic rats through attenuating TLR4 signaling in the downstream of TAK-1 phosphorylation and NF-κB signaling[J]. Naunyn-Schmiedeberg's archives of pharmacology,2010,382(5-6):441-453.
[6]Hori M, Nishida K. Oxidative stress and left ventricular remodelling after myocardial infarction[J]. Cardiovascular research,2008,81(3):457-464.
[7]Nickson P, Toth A, Erhardt P. PUMA is critical for neonatal cardiomyocyte apoptosis induced by endoplasmic reticulum stress[J]. Cardiovasc Res,2007,73(1):48-56.
[8]Terai K, Hiramoto Y, Masaki M, et al. AMP-activated protein kinase protects cardiomyocytes against hypoxic injury through attenuation of endoplasmic reticulum stress[J]. Mol Cell Biol,2005,25(21):9556-9575.
[9]Zhao QF, Xia J, Shao L, et al. Effects of lipoxin A4 on endoplasmic reticulum stress during myocardial ischemia reperfusion injury in rats[J]. Zhonghua Yi Xue Za Zhi,2013,93(12):944-950.
[10]Yu L, Lu M, Wang P, et al. Trichostatin A ameliorates myocardial ischemia/reperfusion injury through inhibition of endoplasmic reticulum stress-induced apoptosis[J]. Arch Med Res,2012,43(3):190-196.
[11]Zhou W, Ko Y, Benharash P, et al. Cardioprotection of electroacupuncture against myocardial ischemia-reperfusion injury by modulation of cardiac norepinephrine release[J]. Am J Physiol Heart CircPhysiol,2012,302(9):H818-H825.
[12]宋春華,王爽,楊龍.電針心俞穴預處理對心肌缺血再灌注實驗大鼠血清 NO、CAT的影響[J].上海針灸雜志,2012,31(4):277-279.
[13]黃日龍,韓數,秦黎虹,等.電針預處理對再次心肌缺血模型家兔心肌酶的影響[J].針刺研究,2012,37(6)224-228.
[14]翟昌林,唐關敏,胡惠林,等.針灸預處理對大鼠心肌缺血再灌注后內質網應激的影響[J].中華危重癥醫學雜志(電子版),2014,7(3):16-19.
[15]Matsui T, Rosenzweig A. Convergent signal transduction pathways controllingcardiomyocyte survival and function: the role of PI 3-kinase and Akt[J]. J Mol Cell Cardiol,2005,38(1):63-71.
[16]Yuan Y, Guo Q, Ye Z, et al. Ischemic postconditioning protects brain from ischemia/reperfusion injury by attenuating endoplasmic reticulum stress-induced apoptosis through PI3K-Akt pathway[J]. Brain Res,2011,1367(1):85-93.
(收稿日期:2018-11-13)

