小麥選擇性自噬關(guān)鍵基因NBR1 的原核表達(dá)
劉彥妮 楊文文 王華忠
摘 ? ?要:自噬參與了動植物的生長、發(fā)育、衰老和逆境脅迫響應(yīng)等過程。NBR1是選擇性自噬的底物受體之一,其識別泛素化的特定蛋白底物并通過與自噬膜上的ATG8互作引導(dǎo)底物進(jìn)入自噬降解過程。在前期克隆了兩個(gè)小麥NBR1基因的基礎(chǔ)上,本研究通過常規(guī)的分子克隆技術(shù)構(gòu)建了兩個(gè)基因的原核表達(dá)載體并將其轉(zhuǎn)化到大腸桿菌中,利用SDS-PAGE方法鑒定了兩個(gè)NBR1基因在大腸桿菌中的表達(dá)情況。結(jié)果表明,導(dǎo)入大腸桿菌的兩個(gè)小麥NBR1均能夠被IPTG誘導(dǎo)表達(dá);表達(dá)重組蛋白兩端含有His(6)標(biāo)簽,其表觀分子量與理論分子量基本一致;重組蛋白在誘導(dǎo)后2 h即表現(xiàn)較高的表達(dá)量,并在誘導(dǎo)后4 h達(dá)到最高的表達(dá)量。研究結(jié)果為后續(xù)小麥NBR1蛋白的純化、抗體的制備以及該蛋白的互作性質(zhì)、表達(dá)特征等功能研究工作奠定了基礎(chǔ)。
關(guān)鍵詞:選擇性自噬;小麥;NBR1基因;原核表達(dá)
中圖分類號:S512.1 ? ? ? ? ? ?文獻(xiàn)標(biāo)識碼:A ? ? ? ? ? ? DOI 編碼:10.3969/j.issn.1006-6500.2019.04.001
Prokaryotic Expression of The Wheat Key Selective Autophagy Gene NBR1
LIU Yanni, YANG Wenwen, WANG Huazhong
(Tianjin Key Laboratory of Animal and Plant Resistance, School of Life Sciences, Tianjin Normal University, Tianjin 300387, China)
Abstract: Autophagy plays an important role in the growth, development, aging and stress responses of plants and animals. NBR1 functions in selective autophagy as a substrate receptor, which recognizes specific ubiquitinated proteins and presents them to the autophagic degradation process through its interaction with ATG8 on autophagic membranes. Previously, two wheat NBR1 genes were cloned in Tianjin key laboratory of animal and plant resistance. In this study, prokaryotic expression vectors for the two wheat NBR1s were constructed and transformed into E. coli. Results from SDS-PAGE showed that wheat NBR1s could express efficiently in E. coli through IPTG induction. The expressed recombinant proteins had N- and C- terminal His(6) tags, and their molecular weights were consistent with the predicted values. High levels of recombinant proteins were detected at as early as 2 h after IPTG induction, and the highest levels were reached at 4 h after IPTG induction. These results laid a foundation for the preparation of recombinant wheat NBR1 proteins and their antibodies for use in assays on the interaction and expression features of wheat NBR1s.
Key words: selective autophagy; wheat (Triticum aestivum L.); NBR1gene; prokaryotic expression
自噬(autophagy)是一種保守的真核生物細(xì)胞內(nèi)物質(zhì)降解過程。在自噬過程中,細(xì)胞質(zhì)物質(zhì)被雙層膜結(jié)構(gòu)的自噬小體包裹,隨后經(jīng)自噬小體外膜與液泡或溶酶體膜的融合過程以內(nèi)膜包裹的形式(此時(shí)稱為自噬小泡)進(jìn)入液泡或溶酶體腔中進(jìn)行降解,降解產(chǎn)生的小分子可以作為營養(yǎng)物質(zhì)重新利用[1]。自噬過程的執(zhí)行依賴于多種自噬相關(guān)因子ATG(AuTophaGy-related factor)的參與[1]。ATG8蛋白定位于自噬膜表面,在自噬小體的組裝及其與溶酶體/液泡膜的融合過程中發(fā)揮重要作用[2-4]。自噬分為批量自噬和底物特異性的選擇性自噬,ATG8在選擇性自噬的底物捕獲過程中也發(fā)揮了重要作用[1]。自噬膜表面的ATG8通過直接與特異性底物互作或與其受體互作的方式將底物捕獲到自噬小體中[5]。NBR1(Neighbor of BRCA1 gene 1)是目前鑒定到的重要選擇性自噬底物受體/ATG8互作蛋白之一。NBR1含有泛素結(jié)合結(jié)構(gòu)域和ATG8互作結(jié)構(gòu)域,其一方面識別并結(jié)合泛素化蛋白,另一方面通過與ATG8的互作將其識別的底物引導(dǎo)進(jìn)入自噬小體[6]。動物上有關(guān)NBR1研究的報(bào)道較多,發(fā)現(xiàn)其參與了蛋白質(zhì)聚集體自噬[6]和過氧化物酶體自噬[7]過程的底物識別。植物NBR1先后在擬南芥[8]和煙草(稱為Joka2)[9]上得到鑒定,證實(shí)了其與ATG8和泛素化蛋白質(zhì)底物的互作,參與了脅迫條件下泛素化蛋白質(zhì)聚集體和入侵病毒相關(guān)蛋白的選擇性自噬過程[9-13]。到目前為止,重要農(nóng)作物小麥上還未見有關(guān)選擇性自噬和NBR1研究的報(bào)道。
本研究在前期克隆了小麥兩個(gè)NBR1基因TaNBR1-1和TaNBR1-2的基礎(chǔ)上,構(gòu)建了兩個(gè)基因的原核表達(dá)載體,實(shí)現(xiàn)了兩個(gè)基因編碼蛋白在大腸桿菌中的誘導(dǎo)表達(dá),為后續(xù)小麥NBR1蛋白的純化、抗體的制備和該蛋白的互作性質(zhì)、表達(dá)特征等功能研究工作奠定了基礎(chǔ)。
1 材料和方法
1.1 基因、載體及試劑
克隆于質(zhì)粒載體上的兩個(gè)小麥NBR1基因TaNBR1-1和TaNBR1-2(均為全長cDNA)和原核表達(dá)載體pET30a由天津市動植物抗性重點(diǎn)實(shí)驗(yàn)室保存。實(shí)驗(yàn)用高保真DNA聚合酶primeSTAR、普通Taq酶、限制性內(nèi)切酶(EcoRⅠ、BamHⅠ和XhoⅠ)以及大腸桿菌DH5α和BL21(DE3)菌株感受態(tài)細(xì)胞均為TakaRa公司產(chǎn)品;快速連接試劑盒(LigaFast)購自Promega公司;引物合成委托北京六合華大基因科技有限公司完成;其他試劑均為國產(chǎn)分析純。
1.2 原核表達(dá)載體的構(gòu)建
設(shè)計(jì)合成用于擴(kuò)增TaNBR1-1基因完整開放閱讀框(open reading frame,ORF)的引物對NBR1-F(GCCATGGAGGCCAGTGAATTCATGTCCGGCCTGA
GCGCG)/NBR1-R(GTG GTGGTGGTGGTGCTCGAG
CTTGTCCTTCTTCTCCCTGGC)和擴(kuò)增TaNBR1-2基因完整ORF的引物對NBR2-F(GCCATGGCTGATA
TCGGATCCATGATGCCTCAACGGGACAC)/ NBR2-R(GTGGTGGTGGTGGTGCTCGAGCATCAGTTCCTTCA
GCTCCGC),擴(kuò)增片段兩端能夠帶上EcoRⅠ和XhoⅠ酶切位點(diǎn)(TaNBR1-1)或BamHⅠ和XhoⅠ酶切位點(diǎn)(TaNBR1-2)。使用引物對和高保真DNA聚合酶primeSTAR,分別以克隆有兩個(gè)TaNBR1基因的質(zhì)粒為模板進(jìn)行PCR擴(kuò)增。對擴(kuò)增片段進(jìn)行EcoRⅠ/XhoⅠ或BamHⅠ/XhoⅠ雙酶切,對載體pET30a質(zhì)粒進(jìn)行相應(yīng)的雙酶切。使用快速連接試劑盒(LigaFast)連接片段和載體。連接產(chǎn)物轉(zhuǎn)化大腸桿菌DH5α后,使用菌落PCR和酶切方法鑒定重組克隆即目標(biāo)基因的表達(dá)載體。鑒定到的表達(dá)載體經(jīng)測序進(jìn)行進(jìn)一步確認(rèn)。采用熱激法將表達(dá)載體導(dǎo)入到大腸桿菌表達(dá)菌株BL21(DE3)中。
1.3 原核表達(dá)
接種含有表達(dá)載體質(zhì)粒的大腸桿菌BL21(DE3)到2 mL含50 mg·L-1卡那霉素的LB液體培養(yǎng)基中,37 ℃ 振蕩培養(yǎng)過夜。按1 % 的比例擴(kuò)大到10 mL 相同的液體培養(yǎng)基中,37 ℃ 振蕩培養(yǎng)至對數(shù)生長期(3 h左右)。加入終濃度為0.5 mmol L-1的IPTG,于28 ℃條件下震蕩培養(yǎng)誘導(dǎo)目標(biāo)基因的表達(dá)。分別于誘導(dǎo)后0,2,4,6,8 h取1 mL菌液用于總蛋白的SDS-PAGE電泳分析。
1.4 SDS-PAGE電泳
將收集的1 mL菌液于10 000 rpm條件下離心10 min,倒掉上清,用80 μL的ddH2O重懸沉淀,再加入20 μL的5倍上樣緩沖液并混勻,沸水浴10 min裂解細(xì)胞變性蛋白。將裂解液于12 000 rpm條件下離心5 min,取20 μL上清進(jìn)行SDS-PAGE電泳(12 % 分離膠,4 % 濃縮膠)。電泳后用考馬斯亮藍(lán)R-250染色液染色1 h,脫色液脫色至背景無色后觀察并拍照。
2 結(jié)果與分析
2.1 兩個(gè)小麥NBR1基因原核表達(dá)載體的構(gòu)建
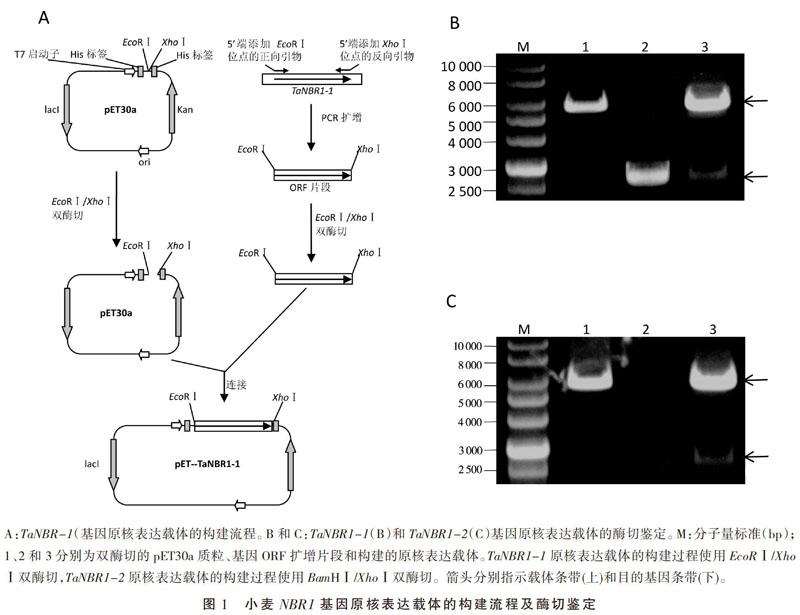
TaNBR1-1基因原核表達(dá)載體的構(gòu)建流程如圖1A所示,設(shè)計(jì)合成5端分別添加了EcoRⅠ和XhoⅠ位點(diǎn)的正、反向引物,使用該引物對并以克隆有TaNBR1-1全長cDNA的質(zhì)粒為模板進(jìn)行PCR擴(kuò)增獲得兩端添加了相應(yīng)酶切位點(diǎn)的TaNBR1-1基因ORF片段,對ORF片段和pET30a載體進(jìn)行EcoRⅠ/XhoⅠ雙酶切和連接,連接產(chǎn)物轉(zhuǎn)化大腸桿菌后通過菌落PCR方法初步鑒定重組克隆。隨后的EcoRⅠ/XhoⅠ雙酶切鑒定結(jié)果(圖1B)表明,重組載體能夠正確切出5 422 bp 的載體片段和2 613 bp的插入基因片段。重組載體經(jīng)測序得到進(jìn)一步確認(rèn),表明TaNBR1-1基因的原核表達(dá)載體構(gòu)建成功,并將其命名為pET-TaNBR1-1。
TaNBR1-2基因原核表達(dá)載體的構(gòu)建流程與TaNBR1-1基因類似,不同的是酶切位點(diǎn)選擇的是BamHⅠ和XhoⅠ。BamHⅠ/XhoⅠ雙酶切鑒定結(jié)果(圖1C)表明,構(gòu)建的重組載體能夠正確切出5 422 bp 的載體片段和2 538 bp的插入基因片段。重組載體經(jīng)測序得到進(jìn)一步確認(rèn),表明TaNBR1-2基因的原核表達(dá)載體構(gòu)建成功,并將其命名為pET-TaNBR1-2。
2.2 小麥TaNRB1-1基因的原核表達(dá)
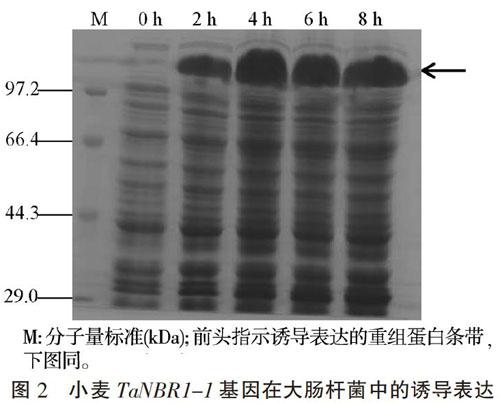
將導(dǎo)入pET-TaNBR1-1載體質(zhì)粒的大腸桿菌BL21(DE3)接種到LB培養(yǎng)基中并在28 ℃條件下進(jìn)行震蕩培養(yǎng),培養(yǎng)基中添加了0.5 mmol·L-1 IPTG誘導(dǎo)目的基因的表達(dá)。于誘導(dǎo)后不同時(shí)間取1 mL菌液提取總蛋白進(jìn)行SDS-PAGE分析(圖2)。結(jié)果表明,誘導(dǎo)0 h的總蛋白中無目標(biāo)重組蛋白條帶,而經(jīng)IPTG 誘導(dǎo)2 h后的總蛋白中出現(xiàn)兩端融合組氨酸標(biāo)簽的His(6)-TaNBR1-1-His(6)重組蛋白條帶,其表觀分子量與理論分子量(101.6 kDa)基本一致。重組蛋白在誘導(dǎo)后2 h即表現(xiàn)較高的表達(dá)量,并在誘導(dǎo)后4 h達(dá)到最高的表達(dá)量。
2.3 小麥TaNRB1-2基因的原核表達(dá)
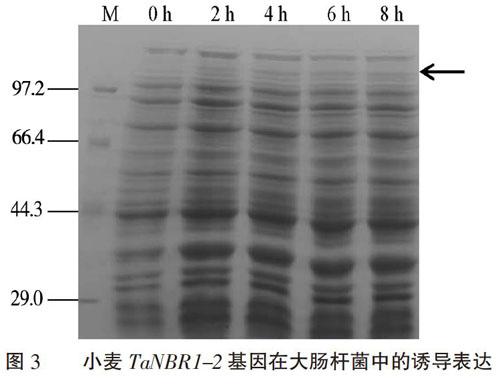
經(jīng)IPTG誘導(dǎo),導(dǎo)入大腸桿菌的TaNBR1-2基因也能正常表達(dá)出兩端融合組氨酸標(biāo)簽的重組蛋白His(6)-TaNBR1-2- His(6),但表達(dá)量不高(圖3)。重組蛋白在誘導(dǎo)2 h后開始出現(xiàn),至誘導(dǎo)后4 h達(dá)到最高的表達(dá)量。重組蛋白的表觀分子量稍大于理論分子量(97.28 kDa)。
3 結(jié)論與討論
自噬過程的分子機(jī)制和生理功能是近年來生命科學(xué)的熱點(diǎn)研究領(lǐng)域。NBR1是選擇性自噬的重要底物識別蛋白之一。NBR1參與的選擇性自噬與植物抵抗細(xì)菌[14]、卵菌[15-16]和病毒[12-13]的侵染密切相關(guān),也與植物耐受高溫、氧化、干旱和高鹽等逆境脅迫密切相關(guān)[10]。圍繞NBR1功能研究的核心內(nèi)容是其與多種蛋白的互作機(jī)制(自身互作形成二聚體,與底物互作,與ATG8互作和與細(xì)胞骨架互作等)及這種互作的生理意義。開展pull-down、免疫共沉淀等蛋白質(zhì)互作實(shí)驗(yàn)離不開目標(biāo)蛋白的原核表達(dá)、純化和相應(yīng)抗體的制備。在選擇性自噬過程中,NBR1與被其識別的底物蛋白一起進(jìn)入自噬小體并最終在液泡中被降解。因此,細(xì)胞內(nèi)NBR1的降解情況即NBR1的蛋白水平可以作為一個(gè)指標(biāo)用于監(jiān)測細(xì)胞內(nèi)自噬流的強(qiáng)度,NBR1蛋白水平的下降預(yù)示著自噬流強(qiáng)度的上升[17-18]。此類依賴western雜交方法的蛋白質(zhì)水平鑒定也需要利用原核表達(dá)的重組蛋白制備相應(yīng)的抗體。目前植物NBR1的功能研究主要集中在模式物種擬南芥上,在圍繞擬南芥NBR1的互作機(jī)制和基于該蛋白的自噬流強(qiáng)度監(jiān)測研究的關(guān)鍵實(shí)驗(yàn)中都涉及該蛋白抗體的制備和使用[8,13-14,19]。
本實(shí)驗(yàn)室前期在重要農(nóng)作物小麥上克隆了兩個(gè)NBR1基因,正在對這兩個(gè)基因及其參與的選擇性自噬過程的生理功能開展深入研究。本研究構(gòu)建了兩個(gè)小麥NBR1基因的原核表達(dá)載體,實(shí)現(xiàn)了兩個(gè)基因在大腸桿菌中的誘導(dǎo)表達(dá),產(chǎn)生的兩端融合His(6)標(biāo)簽的重組蛋白分子量與理論值基本一致。His(6)標(biāo)簽的存在方便了重組蛋白的純化工作;誘導(dǎo)表達(dá)的時(shí)間規(guī)律分析確定了兩個(gè)基因在誘導(dǎo)后4 h即可以達(dá)到最高的表達(dá)量。研究結(jié)果可為后續(xù)小麥NBR1蛋白的純化、抗體的制備和該蛋白的互作性質(zhì)、表達(dá)特征等功能研究工作奠定了基礎(chǔ)。
參考文獻(xiàn):
[1]LI F Q, VIERSTRA R D. Autophagy: a multifaceted intracellular system for bulk and selective recycling[J].Trends in plant science,2012,17(9):526-537.
[2]NAKATOGAWA H, ICHIMURA Y, OHSUMI Y. Atg8, a ubiquitin-like protein required for autophago-some formation, mediates membrane tethering and hemifusion[J].Cell, 2007, 130: 165-178.
[3]XIE Z P, NAIR U, KLIONSKY D J. Atg8 controls phagophore expansion during autophagosome formation[J].Molecular biology of the cell,2008,19(8):3290-3298.
[4]NAIR U, YEN W L, MARI M, et al. A role for Atg8-PE deconjugation in autophagosome biogenesis[J].Autophagy, 2012, 8: 780-793.
[5]BIRGISDOTTIR A B, LAMARK T, JOHANSEN T. The LIR motif-crucial for selective autophagy[J].Journal of cell science, 2013,126(15):3237-3247.
[6]KIRKIN V, LAMARK T, SOU Y S, et al. A role for NBR1 in autophagosomal degradation of ubiquitinated substrates[J].Molecular cell, 2009,33(4):505-516.
[7]DEOSARAN E, LARSEN K B, HUA R, et al. NBR1 acts as an autophagy receptor for peroxisomes[J].Journal of cell science, 2013,126(4):939-952.
[8]SVENNING S, LAMARK T, KRAUSE K, et al. Plant NBR1 is a selective autophagy substrate and a functional hybrid of the mammalian autophagic adapters NBR1 and p62/SQSTM1[J].Autophagy, 2011, 7(9):993-1010.
[9]ZIENTARA-RYTTER K, LUKOMSKA J, MONIUSZKO G, et al. Identification and functional analysis of Joka2, a tobacco member of the family of selective autophagy cargo receptors[J].Autophagy, 2011, 7: 1145-1158.
[10]ZHOU J, WANG J, CHENG Y, et al. NBR1-Mediated selective autophagy targets insoluble ubiquitinated protein aggregates in plant stress responses[J].PLOS genetics,2013,9(1):e1003196.
[11]ZIENTARA-RYTTER K, SIRKO A. Significant role of PB1 and UBA domains in multimerization of Joka2, a selective autophagy cargo receptor from tobacco[J].Frontiers in plant science,2014,5:13.
[12]HAFREN A, USTUN S, HOCHMUTH A, et al. Turnip mosaic virus counteracts selective autophagy of the viral silencing suppressor HCpro[J].Plant physiology,2018,176(1):649-662.
[13]HAFREN A, MACIA J L, LOVE A J, et al. Selective autophagy limits cauliflower mosaic virus infection by NBR1-mediated targeting of viral capsid protein and particles[J].PNAS, 2017, 114: 2026-2035.
[14]USTUN S, HAFREN A, LIU Q S, et al. Bacteria exploit autophagy for proteasome degradation and enhanced virulence in plants[J].Plant cell,2018,30(3):668-685.
[15]DAGDAS Y F, BELHAJ K, MAQBOOL A A, et al. An effector of the Irish potato famine pathogen antagonizes a host autophagy cargo receptor[J].Elife, 2016,5:e10856.
[16]DAGDAS Y F, PANDEY P, TUMTAS Y, et al. Host autophagy machinery is diverted to the pathogen interface to mediate focal defense responses against the Irish potato famine pathogen[J].Elife, 2018, 7: e37476.
[17]MIZUSHIMA N, YOSHIMORI T. How to interpret LC3 immunoblotting[J].Autophagy,2007,3(6):542-545.
[18]BAO Y, MUGUME Y, BASSHAM D C. Biochemical methods to monitor autophagic responses in plants[J].Methods enzymol, 2016, 588: 497-513.
[19]LUO L, ZHANG P, ZHU R, et al. Autophagy is rapidly induced by salt stress and is required for salt tolerance in Arabidopsis[J].Front plant sci, 2017, 8:1459.

