回盲部腹、背側聯合入路法行腹腔鏡右半結腸癌根治術安全性與可行性的臨床分析
阮小蛟,朱恒梁,葉百亮,韓少良,鄭曉風
(1.溫州醫科大學附屬第一醫院,浙江 溫州,325015;2.深圳大學總醫院)
Jacobs等[1]于1991年首先報道了腹腔鏡右半結腸切除術。此后的臨床試驗相繼證明了腹腔鏡根治性結腸癌切除術的有效性與安全性[2-3]。2009年德國學者Hohenberger等[4]提出了全結腸系膜切除(complete mesocolic excision,CME)的概念。近年研究證實,CME可獲得更多的淋巴結清掃、更好的腫瘤學結局[5]。右半結腸因血管解剖變異率高,CME手術難度大,對于腹腔鏡CME右半結腸癌根治術的入路選擇一直爭論不斷,仍無統一的標準入路。本研究回顧性分析2016年1月至2017年6月我院收治的行回盲部腹、背側聯合入路法腹腔鏡CME右半結腸癌根治術的56例患者的臨床資料,探討其安全性、可行性及臨床應用效果。現將體會報道如下。
1 資料與方法
1.1 臨床資料 收集2016年1月至2017年6月我院收治的行回盲部腹、背側聯合入路法腹腔鏡CME右半結腸癌根治術患者的臨床資料,記錄患者性別、年齡、BMI、腫瘤部位、術前腸鏡檢查結果,術前胸-腹增強CT結果、ASA評分、術前合并癥、腹部手術史;其中男35例,女21例,平均(59.2±11.5)歲,BMI平均(23.0±3.1)kg/m2,腫瘤位于盲腸13例、升結腸25例、結腸肝曲18例,術前均經腸鏡活檢病理確診結腸腺癌,術前常規胸腹部增強CT排除遠處轉移,ASA評分Ⅰ~Ⅲ級,評估可耐受腹腔鏡手術。合并糖尿病3例、高血壓病7例;有腹部手術史5例,其中膽道手術史2例,剖宮產史3例。
1.2 手術方法 本研究手術方法經醫院倫理委員會審批通過,醫務科備案,并取得患者知情同意。術者具有20年腹腔鏡手術經驗,團隊配合熟練。
1.2.1 術前準備 術前1 d進流質飲食,清潔腸道,根據排便情況聯合機械灌腸,不常規留置胃管,術前30 min~1 h預防性應用抗生素。
1.2.2 手術步驟 采用氣管插管全身麻醉,患者取仰臥、分腿位,雙上肢內收,建立氣腹后調整體位至頭低足高并右高左低,術中根據操作適當調整體位。術者立于患者左側,持鏡助手立于患者兩腿之間,第一助手立于患者右側。采用5孔法施術。臍下4~5 cm處作為觀察孔(10 mm),左側肋緣下3 cm鎖骨中線處為主操作孔(12 mm),左側反麥氏點為術者副操作孔(5 mm),右側對稱點分別穿刺5 mm Trocar為助手操作孔,器械護士立于患者右側。根據腫瘤大小取上腹部正中切口作為標本取出口。常規腹腔探查,排除腹膜、網膜、臟器表面等遠處轉移情況,最后探查原發病灶,了解腫瘤位置、大小,明確手術范圍。將回盲部反向牽拉至頭側,橫行切開回盲部背側右髂總動脈上方約1.0 cm處腸系膜根部背側黃白交界線(小腸系膜根部背側投影線)(圖1)進入右腹膜后間隙,充分拓展Toldt間隙,向上銳性分離至胰頭(圖2),內側見腸系膜上靜脈右側。將回盲部放回原位,于回盲部腹側回結腸血管下方橫弧行自然皺褶(小腸系膜根部腹側投影線)(圖3)處切開,與右腹膜后間隙相通,暴露腸系膜上靜脈,沿腸系膜上靜脈尾側向頭側解剖并離斷回結腸血管、右結腸血管、胃結腸干各分支及中結腸血管分支(與尾側中間入路相似)(圖4)。擴大右半結腸切除術時,根部鉗夾離斷中結腸血管。于胃大彎血管弓外(擴大右半結腸切除術時于弓內)離斷胃結腸韌帶,進入小網膜囊,右側至結腸肝曲,左側至橫結腸左側,距腫瘤遠側大于10 cm。緊貼胰腺表面切開橫結腸系膜,與已解剖好的右結腸后間隙在胰腺前方相通(擴大右半結腸手術時,需完整清掃幽門下淋巴結,根部離斷胃網膜右血管);外側切開結腸系膜與側腹膜的附著。完成末端回腸、盲腸、升結腸、結腸肝曲及橫結腸近端的游離。體外吻合:腹正中做5 cm切口,取出游離腸管后,裸化腸系膜,切除末端約15 cm回腸,用直線切割閉合器行回腸、橫結腸功能性側側吻合,重新建立氣腹,沖洗腹腔,留置引流管,關閉切口,術畢。
1.3 觀察指標 觀察患者圍手術期情況,包括手術時間、術中出血量、術后排氣時間、恢復流質飲食時間、術后并發癥、住院時間等,術后病理情況,包括腫瘤性質、淋巴結清掃數量、腫瘤分期。
1.4 術后隨訪 采用門診與電話方式隨訪,記錄患者腫瘤復發情況及生活質量,隨訪截至2017年12月。

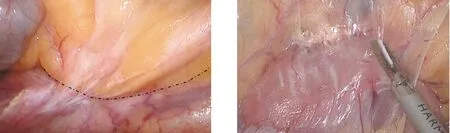
圖1 小腸系膜根部背側投影線 圖2 拓展Toldt間隙,向上銳性分離至胰頭
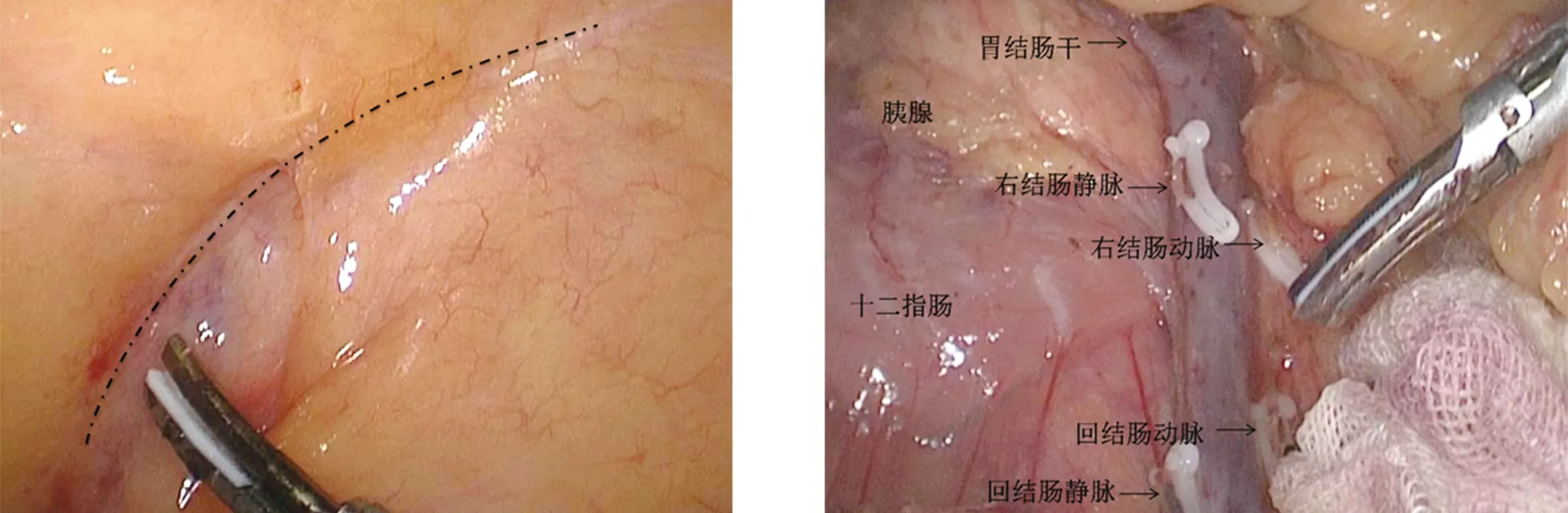
圖3 小腸系膜根部腹側投影線 圖4 腸系膜上動靜脈各分支
2 結 果
2.1 圍手術期結果 56例均順利完成手術,無一例中轉開腹。手術時間平均(163.8±42.5)min,術中出血量平均(113.3±21.3)mL,術后首次排氣時間平均(58.3±13.6)h,恢復流質飲食時間平均(68.5±19.6)h,術后平均住院(12.1±3.0)d,術后發生吻合口漏1例,淋巴瘺2例,吻合口出血1例,均保守治療后痊愈,無圍手術期死亡病例。
2.2 術后病理結果 腫瘤性質均為腺癌,清掃淋巴結數量(18.1±5.9)枚,腫瘤分期:Ⅰ期8例、ⅡA期19例、ⅡB期11例、ⅢA期12例、ⅢB期6例。
2.3 隨訪結果 根據術后病理分期規范化療。患者術后均獲得隨訪,隨訪6~24個月,中位隨訪13個月,復發轉移3例,死亡1例。
3 討 論
2009年德國學者Hohenberger等[4]在全直腸系膜切除術的基礎上提出了CME。人體胚胎發育過程中,升結腸后壁及升結腸系膜后葉與腹后壁腹膜融合,形成右Toldt融合筋膜。右側Toldt筋膜與右半結腸系膜前葉(后腹膜)包裹其內的神經、血管、淋巴脂肪組織構成了升結腸系膜,其與橫結腸系膜一起構成右半結腸系膜。右側Toldt融合筋膜切開后即進入右側Toldt間隙,此間隙是右半結腸癌手術的外科平面,其向左與左側Toldt間隙相通,向上在結腸肝曲附近水平分為胰前間隙、胰后間隙,向下與直腸后方的間隙相延續[6]。CME理念的提出對結腸癌手術技術的提高及標準化具有重要的推動作用,更符合腫瘤根治原則,改善結腸癌患者的預后,明顯降低結腸癌5年局部復發率,提高5年腫瘤相關存活率[4]。
右半結腸因血管解剖變異率高,CME手術難度大,尤其腹腔鏡手術缺乏觸覺,腹腔鏡右半結腸技術發展相對滯后。臨床上對于腹腔鏡右半結腸癌根治術的安全性、腫瘤根治性已得到初步證實[7]。但由于術中對游離間隙的把握、血管的游離及根部淋巴結的清掃要求較高,手術難度更高,對于腹腔鏡CME右半結腸癌根治術的入路選擇一直爭論不斷,仍無統一的標準入路,有外側方入路、中間入路、頭側入路、尾側入路及各種交互式、改良入路[8-15]。其中尾側入路又分尾側腹側面入路與背側面入路,尾側腹側面入路(即尾側中間入路)是由回盲部腹側回結腸血管下方橫弧行自然皺褶(小腸系膜根部腹側投影線)處切開進入右腹膜后間隙,是目前腹腔鏡CME右半結腸根治術的主流入路方法[11-12]。尾側背側面入路是將回盲部翻向頭側,于右髂總動脈上方1.0~2.0 cm黃白交界線(小腸系膜根部背側投影線)處切開進入右腹膜后間隙。腹側較背側入路容易走錯間隙,尤其初學者,在回結腸血管下方進入右結腸后間隙時,體瘦患者容易直接穿破結腸系膜,肥胖患者則由于系膜肥厚,血管隆起不明顯,解剖標志尋找困難,而較難進入正確的外科平面。但經背側入路解剖分離胰頭前間隙的胃結腸干分支,一旦出血,較腹側入路難以控制,因吸血時,手術空間及視野限制,影響止血操作,而在腹側處理血管,不存在這些問題,止血操作較簡單。結合這兩種入路優缺點,先于回盲部背側進入右腹膜后間隙,充分拓展Toldt間隙,再轉向腹側行腸系膜上靜脈及其分支解剖,操作更加合理。術中更容易準確進入右腹膜后間隙,擴展腹膜后間隙后再轉向腹側解剖腸系膜上靜脈,更易控制出血。因此,基于融合筋膜間隙的解剖,選擇尾側背側入路進入后腹膜間隙分離至胰頭及腸系膜上靜脈右側,然后轉向尾側腹側解剖血管分支進行根部淋巴結清掃更易于掌握,相較單純尾側腹側入路(即尾側中間入路),更容易進入后腹膜間隙,同時具有安全處理血管的優勢。
本手術團隊具有豐富的腹腔鏡手術經驗,在學習參考國內外多家醫院腹腔鏡右半結腸癌根治術的基礎上,實踐總結不同入路的優缺點,逐步開展回盲部腹側、背側聯合入路法腹腔鏡CME右半結腸癌根治術,本研究結果顯示,圍手術期并發癥發生率為7.1%(4/56),與尾側中間入路相似,手術安全、可行。在腫瘤根治方面,本研究平均清掃淋巴結(18.1±5.9)枚,達到腫瘤根治要求。我們的經驗表明回盲部腹側、背側聯合入路具有以下優勢:(1)自小腸系膜根部背側切開黃白交界線,更容易尋找、進入右側Toldt間隙;(2)先背側擴展右側Toldt間隙,再轉向腹側更容易顯露解剖血管,術中游離更安全,容易控制術中出血;(3)更利于清掃根部淋巴結,腫瘤根治性質量更高;(4)術中更少接觸、翻動腫瘤,無瘤原則質量更高,本組13例患者腫瘤位于回盲部,雖然術中未因腫瘤位置影響操作,但因術中需要向頭側牽拉回盲部,因此如果腫瘤較大,尤其已侵犯漿膜外的回盲部,建議選擇單純尾側中間入路或頭側入路;(5)操作更容易掌握,更利于初學者開展。

