人工氣胸下胸腔鏡在胸腺瘤切除術(shù)中的應用
劉宗昂,張?zhí)K寧
(中國醫(yī)科大學附屬盛京醫(yī)院第三胸外科,沈陽 110004)
胸腺瘤起源于胸腺上皮細胞,是成人最常見的縱膈腫瘤[1-2]。胸腺瘤具備惡性生物學行為,目前治療方式以手術(shù)切除為主,若合并重癥肌無力更需要及時手術(shù)治療[3]。隨著微創(chuàng)技術(shù)發(fā)展,胸腔鏡胸腺瘤切除成為主流術(shù)式[4]。人工氣胸作為胸腔鏡手術(shù)輔助手段,可以擴大手術(shù)操作空間,使手術(shù)視野暴露更充分。近年來,胸外科微創(chuàng)領域人工氣胸被越來越多應用,WHITSON等[5]報道了人工氣胸下應用胸腔鏡行胸腺瘤切除,取得了較好的效果。本研究比較人工氣胸下胸腔鏡胸腺瘤切除術(shù)與常規(guī)胸腔鏡胸腺瘤切除術(shù)的治療效果,旨在為臨床上胸腺瘤術(shù)式選擇提供參考。
1 材料與方法
1.1 臨床資料及分組
選取2015年1月至2017年12月我院胸外科胸腺瘤患者60例,男29例,女31例,年齡32~69歲,平均年齡 (53.87±7.86) 歲。術(shù)前均診斷為胸腺瘤,腫瘤直徑2~8 cm。其中術(shù)前無重癥肌無力癥狀44例,合并重癥肌無力癥狀16例[按照改良Osserman 分型[6]分為Ⅰ型 (單純眼肌型) 12例,Ⅱa 型 (輕度全身型) 2例,Ⅱb 型 (中度全身型) 2例]。術(shù)前診斷為胸腺瘤合并重癥肌無力癥狀患者均服用溴吡斯的明 (120~480 mg/d)。納入標準: (1) 術(shù)前病史、體征、影像學檢查符合胸腺瘤診斷標準; (2) 術(shù)前增強CT提示2 cm<腫瘤直徑<8 cm,且無明顯侵襲周圍臟器、大血管等影像學表現(xiàn); (3) 術(shù)后病理證實為胸腺瘤; (4) 合并重癥肌無力癥狀患者,符合改良Osserman分型Ⅰ~Ⅱ型; (5) 患者知情同意并簽署知情同意書。排除標準: (1) 合并重癥肌無力癥狀,符合改良Osserman分型Ⅲ、Ⅳ、Ⅴ型; (2) 術(shù)中由胸腔鏡轉(zhuǎn)為開胸; (3) 術(shù)前討論預判微創(chuàng)手術(shù)無法達到標準切除范圍或出血風險較大; (4) 既往有開胸手術(shù)史、心肺功能不全或考慮胸腔粘連嚴重; (5) 依從性差,不能配合治療。按照隨機數(shù)表法將患者分為人工氣胸組 (n=30)、對照組 (n=30)。2組患者年齡、性別、腫瘤直徑及是否合并重癥肌無力比較無統(tǒng)計學差異 (均P>0.05)。見表1。
1.2 手術(shù)方法
患者均采用全身麻醉雙腔氣管插管、單肺通氣,健側(cè)臥位。對照組采用常規(guī)胸腔鏡手術(shù)單操作孔法,于腋中線第6或第7肋間做1.0 cm進鏡孔,于腋前線3或4肋間做3~5 cm切口作為操作孔;人工氣胸輔助組采用三孔法,于腋中線第7肋間做進鏡孔置入密閉穿刺器,于腋前線5肋間、腋中線3肋間置入密閉穿刺器作為操作孔。接二氧化碳建立人工氣胸,壓力維持在8~10 mmHg (1 mmHg=0.133 kPa) 左右。入胸腔后2組均按以下方法進行手術(shù)操作:沿胸腺邊緣以鏡下抓持鉗提起縱膈胸膜,用超聲刀打開縱膈胸膜,從胸腺右下極開始,用超聲刀頓銳結(jié)合逐步向上游離。在頭臂靜脈前方識別胸腺靜脈,采用Hem-0-lock夾閉后超聲刀離斷。后由胸腺左下極起游離胸腺左葉,最后游離雙側(cè)胸腺上極,將胸腺完整切除。合并重癥肌無力癥狀患者胸腺全切后將前縱隔脂肪組織及異位胸腺一并剔除。游離過程中辨認保護頭臂靜脈、上腔靜脈、喉返神經(jīng)及雙側(cè)膈神經(jīng)。將標本置入標本袋后取出,創(chuàng)面止血后沖洗胸腔,于進鏡孔位置留置1枚胸腔引流管,術(shù)畢關胸。
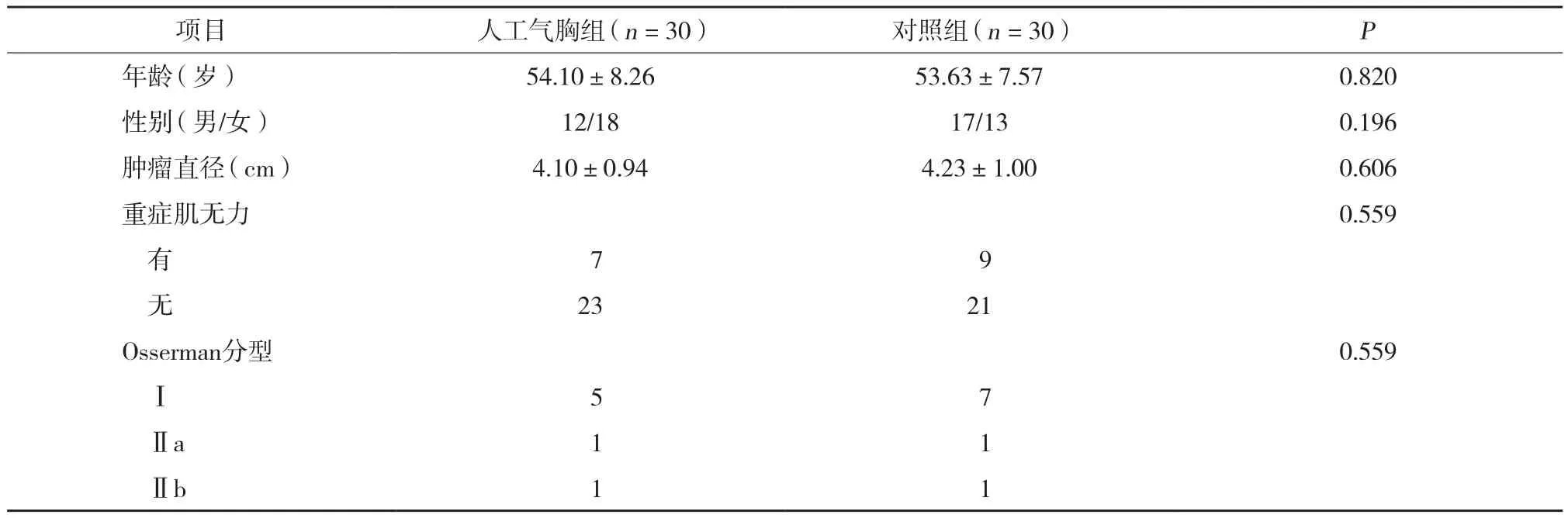
表1 2組患者一般資料比較
1.3 觀察指標
比較2組患者的手術(shù)時間、術(shù)中出血量、術(shù)后帶管時間、術(shù)后住院時間,術(shù)后第1、3、7天VAS評分[7]及術(shù)后并發(fā)癥。
1.4 統(tǒng)計學分析
2 結(jié)果
結(jié)果如表2所示,人工氣胸組手術(shù)時間及術(shù)中出血量少于對照組,差異有統(tǒng)計學意義 (t分別為-2.785、-3.673,P分別為0.007、0.001)。根據(jù)2015年WHO胸腺腫瘤分類標準[8],人工氣胸組術(shù)后病理分型:A型4例, AB型14例, B1型9例,B2型2例,B3型1例;對照組術(shù)后病理分型:A型5例,AB型12例,B1型8例,B2型4例,B3型1例。術(shù)后帶管時間、住院時間2組比較無統(tǒng)計學差異 (t分別為-0.240、1.113,P分別為0.811、0.270)。術(shù)后第1天及第3天人工氣胸組VAS評分低于對照組,差異有統(tǒng)計學意義 (t分別為-3.017、-2.060,P分別為0.004、0.044) ;而術(shù)后第7天2組VAS評分無統(tǒng)計學差異 (t= -0.654,P=0.516)。
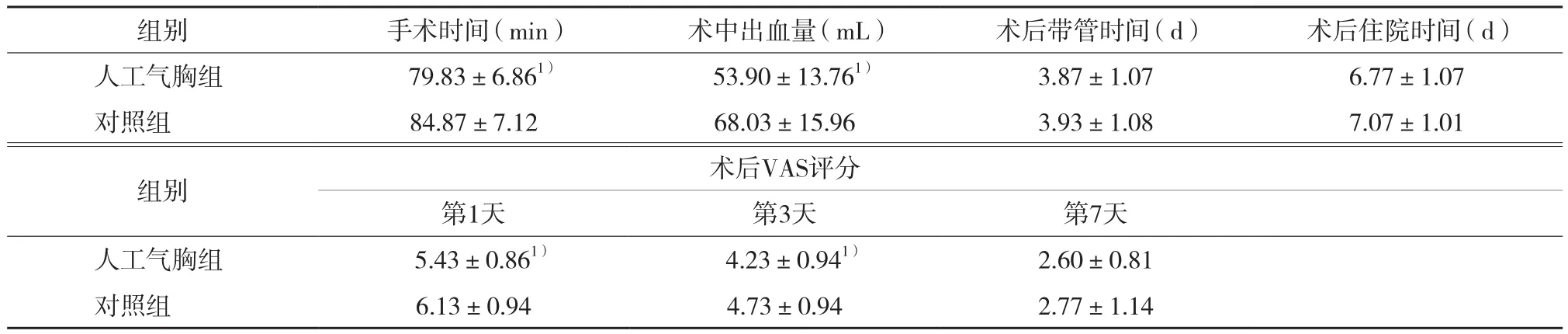
表2 2組患者術(shù)中、術(shù)后指標比較
人工氣胸組術(shù)后3例 (10%) 出現(xiàn)并發(fā)癥,肺不張、心率失常、腹脹各1例。對照組4例 (13.3%) 出現(xiàn)并發(fā)癥,肺部感染2例、肺不張1例、心率失常1例。2組并發(fā)癥發(fā)生率比較無統(tǒng)計學差異 (P=0.688) 。
3 討論
常規(guī)胸腔鏡手術(shù)對麻醉要求高,常因為雙腔氣管插管對位問題造成肺萎陷不良或萎陷時間過長,延長手術(shù)時間[9]。另一方面,由于前縱膈間隙小,內(nèi)含重要血管神經(jīng)[10],且心臟跳動及術(shù)區(qū)肺遮擋對胸腺手術(shù)干擾較大,需要頻繁更換手術(shù)器械而影響操作流暢性。應用人工氣胸能夠使肺完全萎陷,術(shù)野暴露充分,盡可能擴大手術(shù)操作空間,降低術(shù)中副損傷風險,同時主、副操作孔的位置角度使術(shù)中操作更加便利。有研究[11]報道了應用人工氣胸輔助胸腔鏡下行胸腺擴大清除術(shù)能夠?qū)崿F(xiàn)胸腺瘤、完整胸腺及雙側(cè)胸腺脂肪的完整清除,并認為此方法在暴露前縱膈方面優(yōu)勢明顯,減少了雙側(cè)膈神經(jīng)損傷及術(shù)中出血的發(fā)生率。
本研究結(jié)果顯示,人工氣胸組手術(shù)時間及術(shù)中出血量明顯少于對照組 (均P< 0.05) ,而術(shù)后帶管時間、住院時間、并發(fā)癥發(fā)生率與對照組無統(tǒng)計學差異 (均P> 0.05) ;人工氣胸組術(shù)后第1、3天VAS評分小于對照組 (均P< 0.05) ,而術(shù)后第7天與對照組比較無統(tǒng)計學差異 (P> 0.05)。術(shù)后VAS評分出現(xiàn)差異的原因認為可能是由于對照組單操作孔胸腔鏡手術(shù)操作孔切口長度較人工氣胸組的穿刺器切口長,同時單操作孔術(shù)中器械使用對肋間神經(jīng)卡壓明顯,術(shù)后患者疼痛感較人工氣胸組強烈;而拔出胸引管,切口逐漸愈合后則2組疼痛評分無明顯差異。
人工氣胸造成胸腔內(nèi)壓力增高,可造成靜脈回流障礙、中心靜脈壓升高、心輸出量減少、術(shù)中低血壓風險增加[12]。因此,二氧化碳分壓建議保持8~10 mmHg范圍內(nèi),避免引起術(shù)中循環(huán)障礙。同時術(shù)中嚴密心電監(jiān)測,保證患者安全。另外,人工氣胸輔助胸腔鏡手術(shù)建議盡量選擇超聲刀,一方面超聲刀便于鉗夾組織且止血效果可靠,另一方面超聲刀產(chǎn)生的氣霧濃度低,能減少術(shù)野模糊,提高手術(shù)連貫性;同時適時開啟穿刺器閥,使二氧化碳流通,也利于保持術(shù)野清晰,加快手術(shù)進度。
綜上所述,與傳統(tǒng)胸腔鏡手術(shù)比較,人工氣胸下胸腔鏡手術(shù)切除胸腺瘤在減少手術(shù)時間、控制術(shù)中出血量及減輕患者術(shù)后早期疼痛方面具有顯著優(yōu)勢,可作為一種新方法在臨床中推廣應用。但本研究病例數(shù)較少,臨床觀察時間較短,未對患者遠期預后進行分析,需要在今后的工作中進一步驗證。

