蚜蟲及大麥黃矮病毒誘導小麥對后期禾谷縊管蚜酶活性的影響
亢菊俠,楊 洋,孟琳欽
(1.楊凌職業技術學院 生物工程分院,陜西楊凌 712100;2.西北農林科技大學 植物保護學院,陜西楊凌 712100)
植物病毒-介體昆蟲-寄主植物三者之間存在著明顯的互作關系,植物病毒的侵染會影響植物體內多種生理活動,涉及光合作用、植物防御反應、能量傳遞等[1];介體昆蟲取食植物韌皮部汁液時,盡管僅對植物表皮造成微小的創傷,然而所分泌的唾液卻可能破壞植物細胞的結構并且誘導植物激活復雜的防御反應[2]。寄主植物的這些變化,影響著后期介體昆蟲的行為、生物學特征和體內生理生化代謝,是介體昆蟲種群動態變化和植物病毒病流行的主要決定因子[3]。相關研究得到了廣泛的關注。
對介體昆蟲來說,植物病毒是一種外來物質,昆蟲取食攜帶植物病毒的植物后,會產生防御或者調節反應。解毒酶和保護酶是昆蟲體內兩類重要酶系,在對抗逆境及維持昆蟲正常的生理生化代謝方面具有重要作用,常被用來作為評價昆蟲生理適應性的指標[4]。Xu等[5]報道了褐飛虱在水稻黑條矮縮病毒(RBSDV)病株上取食1代后,雌性成蟲體內的超氧化物歧化酶(SOD)、過氧化氫酶(CAT)活性分別比取食健康稻株褐飛虱提高了51. 84%和59. 29%,過氧化物酶(POD)也具有相同的變化趨勢。陳晨等[6]進一步研究取食感染RBSDV水稻不同時間后,褐飛虱和白背飛虱體內3種保護酶活性的變化,表明白背飛虱和褐飛虱成蟲及若蟲體內SOD、CAT、POD的活性隨取食時間延長而增加。曹增等[7]研究取食感染番茄黃化曲葉病毒(TYLCV)的番茄后,煙粉虱的生理防御反應,發現煙粉虱體內谷胱甘肽S-轉移酶(GSTs)和羧酸酯酶(CarE)活性先顯著上升后顯著下降,取食72 h后,三大保護酶SOD、POD、CAT的活性顯著升高;取食30 d后,保護酶活性持續顯著高于取食72 h及對照。上述試驗獲得感染植物病毒的植物時,都需要前期介體昆蟲進行取食傳毒,由于未設置無毒介體昆蟲前期取食組試驗,無法真正厘清是植物病毒的影響還是前期介體自身取食行為的影響,因此應進行進一步的研究。
大麥黃矮病毒(Barley yellow dwarf virus,簡稱BYDV),可以侵染100多種禾本作物,它引起的小麥黃矮病是一種世界性的病害,在全球各個國家均有發生。1960年,中國首次在陜西和甘肅發現小麥黃矮病,是中國北方麥區危害最重、發生最廣的病毒病之一,為目前流行最廣的四大病害之一,一般年份減產5%左右,流行年份減產30%以上[8]。大麥黃矮病毒按照蚜蟲的傳播特性、反映類型與寄主范圍等生物學特性可以劃分出不同的株系,周廣和等[8]已鑒定出GAV、PAV、GPV 和RMV 4 種株系,其中PAV由禾谷縊管蚜和麥長管蚜傳播。近些年,通過田間調查,中國PAV株系逐漸增多。前人研究發現,介體蚜蟲取食感染大麥黃矮病小麥后,對其生長發育與繁殖、取食行為及寄主選擇性均有積極的影響[9],但這些影響的生理生化機制尚不明確。
為了厘清前期介體取食和植物病毒對后來蚜蟲體內生理生化的影響,本研究以BYDV-PAV作為測試病毒,以其介體禾谷縊管蚜作為測試蚜蟲。以取食健康小麥作為對照組,以取食前期受到無毒蚜蟲危害的小麥作為蚜蟲誘導組,以取食前期受到有毒蚜蟲危害(通過RT-PCR鑒定,小麥成功感染BYDV-PAV病毒)作為蚜蟲和病毒誘導組,通過比較上述3種處理蚜蟲體內保護酶與解毒酶的活性差異,從而揭示BYDV-PAV及前期介體取食誘導對禾谷縊管蚜影響的生化機制,從而完善病毒與昆蟲互作的內在機制,并為BYDV與禾谷縊管蚜的防治提供參考。
1 材料與方法
1.1 供試材料
1.1.1 小麥種植 小麥品種為‘矮抗58’,由西北農林科技大學農學院陜西省作物雜種優勢研究與利用重點實驗室惠贈。播種前用清水浸泡小麥種子24 h,用一次性紙杯作為花盆,放入花盆體積2/3 的育苗基質,撒入浸泡好的小麥種子,每盆種4~5 顆種子,待小麥長出后只留3 株小麥,然后在其上再覆蓋1/3 的育苗基質,用噴壺噴水至浸透育苗基質,用頂端帶有紗網的透明塑料籠罩罩住,放入人工氣候箱(溫度25 ℃,相對濕度60%,光周期16L∶8D,下同)培育,待小麥長至一心一葉期備用。
1.1.2 供試毒源 BYDV-PAV毒源來自楊凌農場(34°17′48.5″N ,108°04′34.9″E)。采集到的顯癥小麥,利用RT-PCR 技術對其進行BYDV常見的3種株系鑒定[10-12](BYDV-PAV 引物為PAV-F:GTACAAGGCAAATGGCACGAC,PAV-R:GTTCTGCCTGTTTCCCAGCAT;BYDV-GAV引物為 GAV-F:ATGAATTCAGTAGGCCGTAGAAAT,GAV-R:CTATTTGGGAGTCATGTTGGCAAC;BYDV-GPV引物為 GPV-F:ATGAGTACGGTCGCCTTAGAA,GPV-R:TT- CGTCAAGCGTAACTGT;陽性對照由西北農林科技大學植物病毒學實驗室吳云峰教授饋贈),將擴增產物測序,BALST比對后,確認僅含PAV 株系。由實驗室長期飼養的無毒禾谷縊管蚜作為介體,蚜蟲獲毒后,轉移到盆栽小麥(‘矮抗58’)上,在人工氣候箱內上長期飼養。蚜蟲和小麥每隔2~3 代均進行BYDV上述3種株系檢測,確保蚜蟲和小麥僅感染大麥黃矮病毒PAV 株系。
1.1.3 供試蚜蟲 供試禾谷縊管蚜單頭采自西北農林科技大學北校區麥田(34°17′18.8″N , 108°04′06.0″E),在室內人工氣候箱內培養10 代以上。形成單克隆系。并進行RT-PCR 鑒定,其體內不含BYDV 任何株系,確保為無毒禾谷縊管蚜 備用。
1.1.4 酶活測定試劑 過氧化物酶(POD)試劑盒,過氧化氫酶(CAT)試劑盒,超氧化物歧化酶(SOD)試劑盒,酸性磷酸酶(ACP)測試盒,堿性磷酸酶(AKP)測試盒,乙酰膽堿酯酶(AchE)測試盒,均為南京建成生物工程研究所生產。
1.1.5 試驗儀器 infiniteM200全波長酶標儀,瑞士Tecan公司;BIC-300人工氣候箱,上海博迅實業有限公司醫療設備廠;DK-98-II A電熱恒溫水浴鍋,天津市泰斯特儀器有限公司。
1.2 方 法
1.2.1 試驗設計 用直徑9 cm、高8 cm的花盆種植4~5粒小麥種子,用頂端帶有紗網的透明塑料籠罩罩住,放入人工氣候箱,待小麥長到一心一葉期,保留3株。接入15頭(每株5頭)攜帶PAV株系禾谷縊管蚜3齡若蚜作為病毒和蚜蟲誘導組;接入15頭無毒禾谷縊管蚜3齡若蚜作為蚜蟲誘導組,不接蚜蟲的小麥作為對照組。每個處理重復3次。72 h后,剔除前期所接蚜蟲,接入30頭24 h內初生的無毒禾谷縊管蚜若蚜,待長至成蚜后,將30頭成蚜收集在無菌1.5 mL離心管內,速凍于液氮后,放入-80 ℃冰箱保存。同時收集病毒和蚜蟲誘導組花盆中的3株小麥葉片,進行RT-PCR鑒定, 確保3株小麥均感染BYDV-PAV病毒,收集到的蚜蟲才能進行下一步酶活測定。蚜蟲誘導組和對照組中的植物亦進行同樣操作,確保小麥體內不感染病毒。
1.2.2 酶原液制備及酶活測定 將待測蚜蟲從-80 ℃冰箱取出稱量,按質量∶體積=1∶9的比例加入無菌9 g/L的生理鹽水冰浴研磨,研磨成勻漿液后于4 ℃、2 500 r/min離心10 min,取上清即為酶原液。所有酶活性測定均按照南京建成酶活試劑盒的方法進行。
1.3 數據分析
采用SPSS 21.0 軟件對酶活數據進行單因素方差分析,并采用 S-N-K 法進行差異顯著性測驗。采用SigmaPlot 10.0軟件作圖。
2 結果與分析
2.1 蚜蟲及大麥黃矮病毒誘導對禾谷縊管蚜保護酶活性的影響
2.1.1 POD活性的變化 與取食健康小麥(對照組)相比,取食前期受無毒禾谷縊管蚜危害小麥(蚜蟲誘導組)和取食前期感染BYDV-PAV小麥(病毒和蚜蟲誘導組)禾谷縊管蚜體內POD 活性均顯著升高(P=0.000和P=0.046),上升幅度分別達到206.9%和49.3%;而與蚜蟲誘導組相比,病毒和蚜蟲誘導組禾谷縊管蚜體內POD 活性顯著下降(P=0.000),下降幅度達51.3%。說明前期蚜蟲的取食行為可誘導小麥抗性,使得后期蚜蟲體內的POD活性顯著升高,但PAV病毒存在時,可顯著降低這種影響 (圖1-A)。
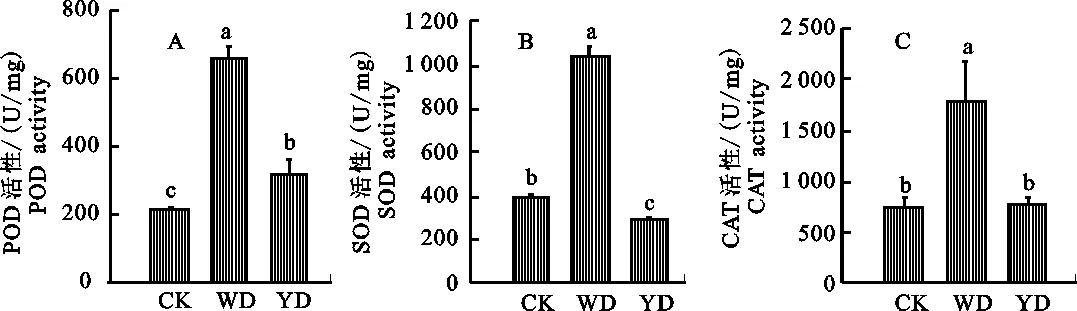
CK.對照組 Control group;WD.蚜蟲誘導組 Previous non-infection aphids induction group;YD.病毒和蚜蟲誘導組 Previous BYDV-infection aphids induction group;數據為“平均值±標準誤” The data was “mean±SE”;誤差棒上不同大寫字母表示用S-N-K法檢驗P<0.05水平差異顯著性,下同 Different uppercase letters on the error bars indicate significant difference atP<0.05 level by S-N-K test,the same below
圖1 蚜蟲及大麥黃矮病毒誘導下禾谷縊管蚜體內保護酶POD(A)、SOD(B)和CAT(C)的活性
Fig.1 Protective enzymes POD (A),SOD (B) and CAT(C) activities
ofRhopalosiphumpadiunder different treatments
2.1.2 SOD活性變化 與取食健康小麥(對照組)相比,取食前期受無毒禾谷縊管蚜危害小麥(蚜蟲誘導組)禾谷縊管蚜體內SOD活性顯著升高(P=0.000),上升幅度達到161.7%,而取食前期感染BYDV-PAV小麥(病毒和蚜蟲誘導組)禾谷縊管蚜體內SOD活性顯著下降差異(P= 0.015),下降幅度達27.8%;而與蚜蟲誘導組相比,病毒和蚜蟲誘導組禾谷縊管蚜體內SOD活性顯著下降(P=0.000),下降幅度達72.4%。說明前期蚜蟲的取食行為可誘導小麥抗性,使得后期蚜蟲體內的SOD活性顯著升高,且PAV病毒可顯著降后期蚜蟲體內SOD的活性 (圖1-B) 。
2.1.3 CAT活性的變化 與取食健康小麥(對照組)相比,取食前期受無毒禾谷縊管蚜危害小麥(蚜蟲誘導組)禾谷縊管蚜體內CAT活性顯著升高(P=0.010),上升幅度達到138.9%,而取食前期感染BYDV-PAV小麥(病毒和蚜蟲誘導組)禾谷縊管蚜體內CAT活性無顯著差異(P= 0.972);而與蚜蟲誘導組相比,病毒和蚜蟲誘導組禾谷縊管蚜體內CAT活性顯著下降(P= 0.010),下降幅度達57.5%。說明前期蚜蟲的取食行為可誘導小麥抗性,使得后期蚜蟲體內的CAT活性顯著升高,但PAV病毒存在時,可顯著降低這種影響 (圖1-C)。
2.2 蚜蟲及大麥黃矮病毒誘導對禾谷縊管蚜解毒酶活性的影響
2.2.1 ACP活性的變化 與取食健康小麥(對照組)相比,取食前期受無毒禾谷縊管蚜危害小麥(蚜蟲誘導組)禾谷縊管蚜體內ACP活性顯著升高(P=0.000),上升幅度達到190.8%,而取食前期感染BYDV-PAV小麥(病毒和蚜蟲誘導組)禾谷縊管蚜體內ACP活性顯著下降差異(P= 0.031),下降幅度達34.3%;而與蚜蟲誘導組相比,病毒和蚜蟲誘導組禾谷縊管蚜體內ACP活性顯著下降(P=0.000),下降幅度達77.4%。說明前期蚜蟲的取食行為可誘導小麥抗性,使得后期蚜蟲體內的ACP活性顯著升高,且PAV病毒可顯著降后期蚜蟲體內ACP的活性 (圖2-A) 。
2.2.2 AKP活性的變化 與取食健康小麥(對照組)相比,取食前期受無毒禾谷縊管蚜危害小麥(蚜蟲誘導組)禾谷縊管蚜體內AKP活性顯著升高(P=0.000),上升幅度達到138.9%,而取食前期感染BYDV-PAV小麥(病毒和蚜蟲誘導組)禾谷縊管蚜體內AKP活性無顯著差異(P= 0.170);而與蚜蟲誘導組相比,病毒和蚜蟲誘導組禾谷縊管蚜體內AKP活性顯著下降(P= 0.000),下降幅度達78.5%。說明前期蚜蟲的取食行為可誘導小麥抗性,使得后期蚜蟲體內的CAT活性顯著升高,但BYDV-PAV存在時,可顯著降低這種影響 (圖2-B)。
2.2.3 AchE活性變化 與取食健康小麥(對照組)相比,取食前期受無毒禾谷縊管蚜危害小麥(蚜蟲誘導組)和取食前期感染BYDV-PAV小麥(病毒和蚜蟲誘導組)禾谷縊管蚜體內AchE活性均無顯著差異(P>0.05)。說明前期蚜蟲的取食行為和PAV均不影響后期蚜蟲體內的AchE活性(圖2-C)。
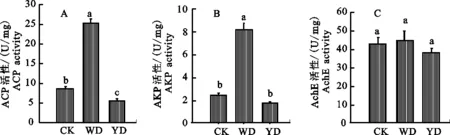
圖2 蚜蟲及大麥黃矮病毒誘導下禾谷縊管蚜體內解毒酶ACP(A)、AKP(B)和AchE(C)的活性Fig.2 Detoxifying enzymes ACP(A),AKP (B)and AchE(C) activities of Rhopalosiphum padi under different treatments
3 討 論
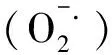
本研究結果表明,與取食健康植物相比,取食前期受到有毒蚜蟲危害的小麥后,禾谷縊管蚜體內保護酶SOD顯著降低,反應取食感染植物病毒的小麥導致禾谷縊管蚜體內有害物質H2O2減少釋放,說明其體內抗氧化能力大于取食健康小麥的蚜蟲,因此其適合度高于取食健康小麥的蚜蟲[17]。Luan等[20]發現B型煙粉虱在感染番茄黃化曲葉病毒的煙草上取食后,體內解毒酶活性顯著降低,認為昆蟲能夠通過降低解毒酶活性來減少能量消耗,由此增加其在帶毒寄主植物上的適合度。本研究也發現禾谷縊管蚜取食有毒小麥后,體內解毒酶ACP也顯著降低,與上述報道一致。Hu等[9]研究結果顯示,取食BYDV感染的小麥對蚜蟲的生長發育與繁殖有促進作用,本試驗從一定程度上解釋了上述結果產生的原因。但本研究結果與前人在南方水稻黑條矮縮病與褐飛虱/白背飛虱、煙粉虱與黃化曲葉病毒互作研究結果具有一定差異[6-7]。這可能是由于不同類型植物病毒與介體昆蟲互作關系具有不同的生理生化機制造成的。
李軍等[21]研究了前期蚜蟲危害后,后期蚜蟲的發育歷期、體質量差和相對日均體質量增長量的變化,發現對后期蚜蟲生長發育有顯著的抑制作用。本研究結果顯示,與取食健康植物相比,取食前期受到無毒蚜蟲危害的小麥后,禾谷縊管蚜體內保護酶SOD、POD、CAT及解毒酶ACP、AKP活性均顯著升高,說明前期蚜蟲取食誘導了小麥的抗性,導致后期禾谷縊管蚜體內抗氧化能力小于取食健康小麥的蚜蟲,并且通過升高解毒酶活性來誘導對植物的抗性,因此降低了其在前期蚜蟲危害后的寄主植物上的適合度。本試驗從一個側面解釋了李軍等[21]結果產生的原因。同時,與取食前期受到無毒蚜蟲危害的小麥相比,取食前期受到有毒蚜蟲危害的小麥后,禾谷縊管蚜體內保護酶SOD、POD、CAT及解毒酶ACP、AKP活性均顯著降低,說明小麥感染植物病毒可以克服蚜蟲危害造成的酶活性上升,使之更好地在帶毒植物上生存。
在長期的進化過程中,植物病毒—介體昆蟲—寄主植物三者間形成了復雜的互作關系,本試驗僅從實驗室條件下,對昆蟲體內的保護酶和解毒酶活性進行了研究。在大田中,由于還受到溫度、濕度等物理條件,以及其他生物的影響,因此要進行室外試驗,增加試驗的可信度。另外非常有必要在此基礎上對保護酶和解毒酶的基因表達量進行分析,并進一步利用轉錄組學方法進行研究,從而明確介體昆蟲對植物病毒和前期昆蟲取食更深層的基因適應機制。

