棉鈴蟲膨脹線粒體基因組的鑒定與分析
張屾 谷少華 李顯春

摘要以已公布的棉鈴蟲線粒體DNA序列對來自4頭棉鈴蟲雄蛹的DNA的三代測序數據進行篩選,獲得了11條與線粒體DNA有同源性的三代read序列,并根據其中的read 66003鑒定出了一種膨脹的線粒體基因組。該線粒體基因組大小為27 113 bp,其保守區(qū)域包含13個蛋白編碼基因、2個rRNA基因、22個tRNA基因以及1個AT富集區(qū),與已公布的棉鈴蟲線粒體基因組的結構相似。膨脹區(qū)域位于cox1基因編碼區(qū)內部,大小為11 467 bp,經預測含有一個完整的真核基因(依賴ATP的RNA解旋酶)以及多種轉座元件的片段,但與線粒體DNA無同源性,也無I類或Ⅱ類內含子存在的證據。對田間和室內棉鈴蟲DNA樣品的PCR擴增未能檢測到膨脹線粒體基因組的存在。以上結果表明膨脹片段可能是細胞核DNA序列通過偶然的水平轉移事件而整合到線粒體基因組中的,且該種膨脹方式的發(fā)生概率極低。本文報道的膨脹線粒體基因組為日后動物線粒體基因組學的研究提示了一種獨特的變異方式。
關鍵詞棉鈴蟲;線粒體基因組;膨脹;RNA解旋酶;轉座子
中圖分類號:S 435.622
文獻標識碼:A
DOI:10.16688/j.zwbh.2018223
線粒體是真核細胞中一種最基本的細胞器,一般認為其起源于細菌在真核細胞中的內共生作用[1],且保留了一套獨立于細胞核基因組之外的遺傳系統(tǒng),能夠進行自我復制和表達。在植物和動物中,盡管線粒體承擔的生物學功能相似,但其基因組卻向兩個極端對立的方向演化:植物線粒體基因組復雜、龐大,變異程度較大,富含大量非編碼序列和內含子;而動物的線粒體基因組較為保守,基因排布緊湊,非編碼區(qū)含量較少,一般不含內含子[2]。動物線粒體基因組大小通常在15~20 kb之間,包含13個蛋白編碼基因、22個轉運RNA(tRNA)基因、2個核糖體RNA(rRNA)基因和1個AT富集區(qū)(控制區(qū))[3]。盡管動物線粒體基因組在基因組成和結構上的保守性較高,但變異事件亦會偶爾發(fā)生,主要表現(xiàn)為基因的復制或缺失、基因重排以及非編碼區(qū)的擴張或收縮等方式。
基因的復制或缺失是動物中相對常見的線粒體基因組變異方式。例如,某些腔腸動物及箭蟲的線粒體基因組中缺失了幾個乃至全部的tRNA基因[45],在蛛形綱部分物種和癭蚊類昆蟲的線粒體基因組中則存在tRNA縮短的現(xiàn)象[67],而基因復制現(xiàn)象在螨、薊馬乃至脊椎動物的線粒體基因組中均有發(fā)現(xiàn)[810]。
進一步地,線粒體基因復制和缺失事件的積累可能導致基因重排現(xiàn)象的產生[11]。邱忠營[12]對153種直翅目昆蟲的線粒體基因組進行了比較基因組學分析,總結了其中12個物種的基因重排模式,其重排事件發(fā)生的概率較低,且多數為tRNA基因位置的顛換。線粒體基因重排極端化的一種表現(xiàn)是線粒體的片段化。鞭毛蟲、水母和虱目等的線粒體中均發(fā)現(xiàn)了片段化的現(xiàn)象,最典型的例子是體虱Pediculus humanus,其線粒體基因組由18個微型染色體(minichromosome)組成,每個染色體長3~4 kb,攜帶1~3個基因及一個控制區(qū)[1315]。
線粒體基因組非編碼區(qū)的變異主要源自內含子或重復元件的復制或丟失。線粒體基因組中的內含子分為Ⅰ類內含子(group Ⅰ intron)和Ⅱ類內含子(group Ⅱ intron)兩類,二者不同于真核細胞核基因組內的剪接體內含子,它們具備核酶的催化功能,能夠在不依賴剪接體的情況下完成自我剪接[1618]。Ⅰ類內含子多見于真菌線粒體,而Ⅱ類內含子則為植物線粒體基因組內含子的主要形式。內含子在動物線粒體中較為罕見,目前僅在海葵、珊瑚等低等后生動物中有報道。Beagley等[4,19]在繡球海葵Metridium senile線粒體細胞色素C氧化酶亞基Ⅰ(cox1)和NADH脫氫酶亞基5(ND5)編碼基因內部分別發(fā)現(xiàn)了一個Ⅰ類內含子,其中前者能夠自我成環(huán)并編碼一個核酸內切酶,而后者內部則含有編碼ND1和ND3的基因,且內含子自我剪接后二者能夠以雙順反子的形式進行轉錄。進一步的研究表明,線粒體ND5內含子在六射珊瑚綱的物種內普遍存在,且其內部的蛋白編碼基因復制數目在演化中逐步增加[20]。
相較于內含子,控制區(qū)或其他重復序列的變異在動物線粒體基因組中更常見且形式更豐富。Tang等[21]在寄生線蟲Thaumamermis cosgrovei中鑒定出兩種線粒體基因型,其差異源于基因或非編碼區(qū)的變異。軟體動物線粒體基因組的非編碼序列的擴張最為普遍,且個體間差異明顯。深海扇貝Placopecten magellanicus線粒體基因組的大小從30.7 kb至40.7 kb不等,基因組內有3個位點存在結構變異,每個位點至少存在6種不同形式的重復元件,導致了線粒體基因組在個體間的巨大變異[2224]。類似地,在另一種扇貝Pecten maximus的線粒體基因組中存在一類拷貝數可變的長約1.6 kb的重復元件,其重復次數的不同致使基因組大小在20.0 kb到25.8 kb之間波動[25]。赤貝Scapharca broughtonii的線粒體基因組大小約為50 kb,是后生動物中已知最長的線粒體DNA,其基因組內含有一個串聯(lián)重復單元以及一個可復制的非編碼區(qū),二者的變異是基因組擴張的原因[26]。Raimond等[27]利用RFLP技術測定了鼠婦Armadillidium vulgare的線粒體基因組大小(20~42 kb),結合電鏡觀察提出一種膨脹的線粒體基因組的存在形式:約14 kb的線粒體DNA單體發(fā)生復制和重排形成3個單體,其中一個以線性形式存在,另外兩個則連接成環(huán)。Boyce等[28]在3種象甲Pissodes spp.的線粒體DNA中發(fā)現(xiàn)了擴張的AT富集區(qū)(9~13 kb),同時在其側翼還存在數目不等的重復元件,這成為該屬昆蟲線粒體基因組變異的原因。綜上所述,動物線粒體在基因組成和結構上相對保守,變異事件形式有限、發(fā)生概率較小,其中基因重排和內含子插入事件多為可遺傳的,已成為物種固定的遺傳屬性,而重復元件的變異通常存在多樣性和隨機性,在物種內個體間存在差異。
棉鈴蟲Helicoverpa armigera屬鱗翅目Lepidoptera夜蛾科Noctuidae,是世界范圍內的一種重要農業(yè)害蟲,其線粒體基因組已在2010年公布,總長度為15 347 bp,具備典型的動物線粒體基因組結構[29]。本文利用三代DNA測序技術,鑒定出一條異常的棉鈴蟲線粒體DNA序列,其cox1基因內部插入了一段11 467 bp的疑似核基因組的片段,導致線粒體基因組顯著膨脹,為動物線粒體基因組學的研究提示了一種特殊的變異方式。
1材料與方法
1.1樣品及數據來源
棉鈴蟲線粒體基因組序列獲取自二代和三代全基因組DNA測序read。DNA樣品來自4頭蛹期的棉鈴蟲,對其進行全基因組DNA抽提和建庫測序。二代測序平臺為Illumina Hiseq 2000,三代測序平臺為PacBio SMART RS Ⅱ。原始測序數據下機后經過質量控制和融合,以二代數據對三代數據進行校正,校正后的數據用于篩選線粒體相關的read序列。
1.2線粒體基因組的注釋
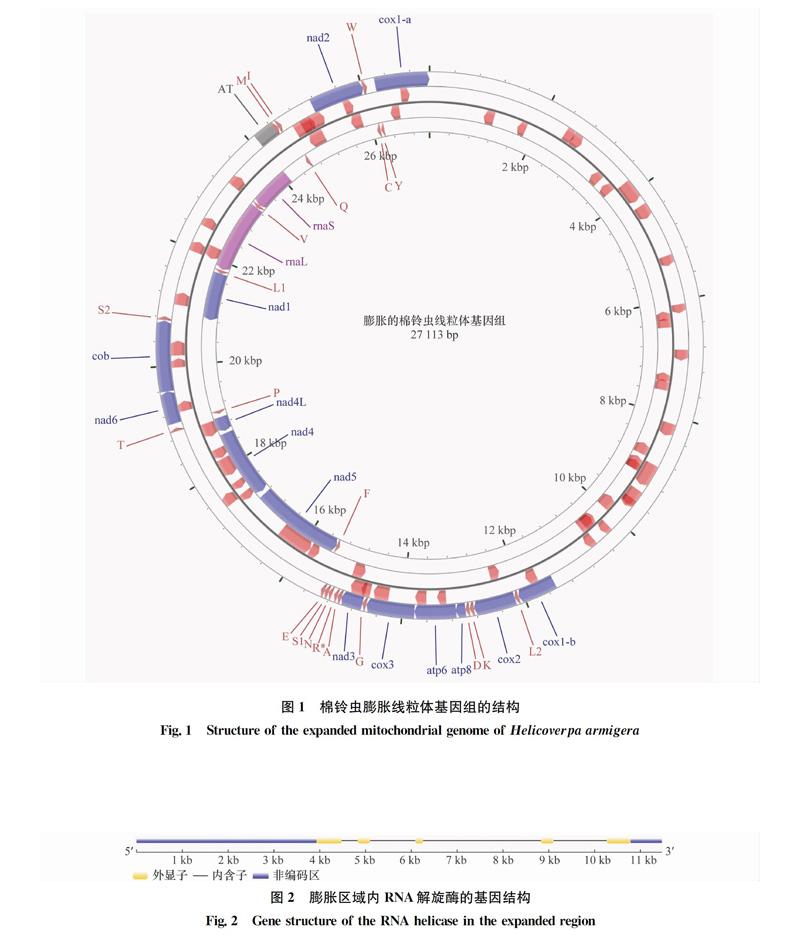
線粒體基因組首先以在線工具MFannot和RNAweasel[16](http:∥megasun.bch.umontreal.ca/RNAweasel/)進行蛋白編碼基因、rRNA基因以及tRNA基因的預測,隨后從Yin等[29]的報道中提取注釋信息,將之補充并整合到上述預測結果中,得到最終的線粒體注釋結果。線粒體基因組結構圖的繪制使用在線工具CGView Server V 1.0[30](http:∥stothard.afns.ualberta.ca/cgview_server/)。
1.3線粒體膨脹區(qū)域的分析
膨脹區(qū)域的分析通過BLASTn和BLASTx分別在NCBI的Nucleotide collection(Nt)和Nonredundent(Nr)數據庫中進行檢索。基因結構的作圖使用在線工具Gene Structure Display Server 2.0[31](http:∥gsds.cbi.pku.edu.cn/)。轉座元件的預測使用Repbase數據庫中的在線工具CENSOR[32](https:∥www.girinst.org/censor/)。I 類或Ⅱ類內含子的預測采用RNAweasel。
2結果與分析
2.1棉鈴蟲膨脹線粒體DNA的鑒定
以已公布的棉鈴蟲線粒體基因組序列(GenBank登錄號GU188273)作為query序列,檢索校正后的三代read,從中篩選出11條與線粒體DNA有同源性的read序列(表1)。序列比對結果顯示,11條read中有8條對query的覆蓋度較低(<60%),而另外3條超過90%,其中,僅有read 66003完整覆蓋線粒體基因組且首尾存在重疊,由此得到了一條膨脹的環(huán)狀線粒體DNA序列用于后續(xù)分析。
2.2棉鈴蟲膨脹線粒體基因組的注釋
膨脹的棉鈴蟲線粒體基因組大小為27 113 bp,其基因組結構如圖1所示。與已公布的棉鈴蟲線粒體基因組的比對結果顯示,膨脹線粒體基因組可分為保守區(qū)域和膨脹區(qū)域兩部分。保守區(qū)域中二者核苷酸序列相似度達到97%。通過注釋,在保守區(qū)域鑒定出了13個蛋白編碼基因(cox1,cox2,cox3,cob,nad1,nad2,nad3,nad4,nad4L,nad5,nad6,atp6,atp8)、2個rRNA基因(rnaL,rnaS)、22個tRNA基因(亮氨酸t(yī)RNA和絲氨酸t(yī)RNA分別有2個拷貝,其余18種氨基酸分別對應1個tRNA)以及1個AT富集區(qū)。其基因組成和排布方式與已公布的棉鈴蟲線粒體基因組基本一致,不同之處在于cox1基因被打斷為兩部分且缺失了約23 bp的編碼序列。膨脹區(qū)域是一個連續(xù)的、長度為11 467 bp的片段,與正常線粒體無同源性,存在于cox1基因編碼區(qū)之中。
2.3棉鈴蟲線粒體基因組膨脹區(qū)域的分析
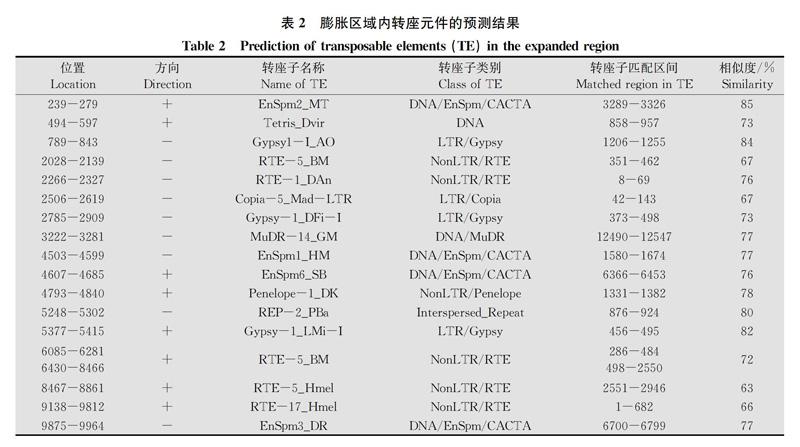
蛋白編碼基因檢索的結果顯示,膨脹區(qū)域內包含一個依賴ATP的RNA解旋酶基因(ATPdependent RNA helicase,GenBank登錄號XM_021342945)。該基因具有真核基因的結構,編碼區(qū)位于輕鏈的3 931-10 784 bp區(qū)間,包含5個外顯子,基因結構圖如圖2所示。
NCBI Nt數據庫的檢索結果顯示,與膨脹區(qū)域匹配度最高的subject為棉鈴蟲細菌人工染色體(bacterial artificial chromosome,BAC)序列(GenBank登錄號FO082297)。進一步地,使用Repbase預測膨脹區(qū)域轉座元件,結果如表2所示。其中較完整的一個元件注釋為非長末端重復反轉錄轉座子(Non long terminal repeat retrotransposable element,NonLTR/RTE)RTE5,在基因組中分為4個片段,總長度約2 800 bp,其主要部分位于膨脹區(qū)域的6 500-8 800 bp之間,即RNA解旋酶基因第三個內含子內部。其他轉座元件還涉及多種DNA轉座子、LTR反轉錄轉座子以及散布重復序列等,但均不超過1 kb,不具備完整的轉座子結構。此外,內含子預測的結果顯示,膨脹區(qū)域內既不含有I 類/Ⅱ類內含子的保守結構,也沒有編碼逆轉錄酶或核酸內切酶的基因,無法找到內含子存在的證據。
3討論
本文從棉鈴蟲全基因組三代測序原始數據中,篩選得到了與線粒體相關的序列。其中,read 99261和read 119177的read覆蓋度為100%,表明二者可能是正常線粒體DNA的片段;read 66003完整覆蓋subject,且在二代測序數據的輔助下能拼接成環(huán),因此我們借助該read鑒定出了膨脹的棉鈴蟲線粒體基因組;而其余read對subject的覆蓋度較低或存在片段倒位(表1),由于原始數據未經過拼接組裝,不存在拼接錯誤,因此我們推測這些序列并非是線粒體源的DNA,而是包含線粒體假基因的核基因組序列。線粒體基因組向核基因組遷移的現(xiàn)象廣泛存在。在動物中,線粒體基因通常以假基因形式存在于核基因組中,分布形式多變[3334],其中昆蟲基因組中的線粒體假基因已在蚱蜢、蚜蟲、天牛等類別的物種中得到研究[3537]。植物中線粒體DNA遷入核基因組的事件比動物更為普遍,核基因組能獲得線粒體基因并保留其功能[38],且線粒體基因組能以大片段乃至完整形式插入核基因組[39]。在本研究中,線粒體相關read的鑒定暗示棉鈴蟲核基因組中可能存在諸多的線粒體假基因,且假基因與真基因的相似度較高,但假基因的種類、拷貝數以及分布方式等問題尚未明確,仍有待進一步研究。Song等[40]的研究表明,細胞核基因組中的線粒體假基因會干擾DNA條形碼鑒定技術的準確性,這也提示我們未來使用DNA條形碼定量檢測棉鈴蟲種群時需注意排除線粒體假基因的干擾。
后生動物線粒體基因組通常編碼37個基因,長度一般不超過20 kb,非編碼序列含量很低。棉鈴蟲線粒體基因組前人已有報道[29],符合動物線粒體基因組的這些保守特征。本文通過高通量測序發(fā)現(xiàn)了一種不同于該報道的、異常膨脹的棉鈴蟲線粒體基因組,其大小達到27 113 bp。與已公布的序列相比,基因組內部發(fā)生了顯著的膨脹,膨脹原因主要是cox1基因編碼區(qū)中間插入了一段11 467 bp的序列。線粒體基因組的膨脹主要通過基因復制或非編碼區(qū)擴張的方式實現(xiàn)。為此,我們分析了膨脹序列的來源以及該區(qū)域內編碼基因、重復元件或內含子存在的可能性。如2.3所述,該片段在NCBI Nt數據庫中能夠匹配到棉鈴蟲BAC序列,卻與線粒體DNA無任何匹配,表明其并非線粒體基因組自身的復制或擴張,而更可能來源于核基因組。通過功能基因的注釋,發(fā)現(xiàn)膨脹區(qū)域包含一個完整的核基因組蛋白編碼基因(依賴ATP的RNA解旋酶),且具有外顯子內含子的真核基因結構。這進一步表明膨脹片段可能是一段核基因組序列通過水平轉移被整合進線粒體基因組的產物。
I 類內含子和Ⅱ類內含子不同于核基因組內的剪接體內含子,二者不依賴復雜的剪接體即可完成自我剪接,后者通常還具備逆轉錄酶、成熟酶或核酸內切酶的編碼區(qū)[16]。本研究中,利用核酸內切酶、逆轉錄酶保守結構域以及內含子預測工具均未在膨脹區(qū)域發(fā)現(xiàn)內含子存在的證據,這表明棉鈴蟲線粒體基因組的膨脹并非由內含子插入導致。我們進一步使用Repbase預測了膨脹線粒體基因組內轉座元件存在的可能性。結果表明,該區(qū)域內存在一個較完整的NonLTR類反轉錄轉座子以及諸多轉座元件的片段。這些轉座子序列大多不完整,且呈分散或嵌套分布,因此我們推測膨脹片段的祖先序列經歷了多次轉座事件,多數轉座子結構被破壞,僅殘留部分痕跡,而線粒體基因組中該膨脹部分的插入則可能是在上述轉座事件后發(fā)生的一次細胞核DNA水平轉移事件。
在植物中,核內DNA序列、尤其是轉座元件整合進入線粒體基因組的現(xiàn)象較為普遍[39],但在動物線粒體基因組中此類變異事件較為罕見,且對于簡單、緊湊的線粒體基因組,轉座子通常是有害的,在演化過程中易受凈化選擇(purifying selection)作用而被清除。針對本文中鑒定得到的棉鈴蟲膨脹線粒體基因組,我們曾嘗試在室內及田間收集的數十個棉鈴蟲DNA樣品中克隆該膨脹區(qū)域,但均未發(fā)現(xiàn)目的片段整合到線粒體基因組的證據。該膨脹的線粒體基因組序列是直接由DNA測序read得到的,不會摻入拼接錯誤,因此可以保證其存在的真實性,而其克隆證據的缺失一方面可能是因為膨脹序列的保守性較低,存在諸多變異形式,另一方面,更大的可能性在于此種線粒體膨脹事件發(fā)生的概率極低,且其破壞了cox1基因的編碼區(qū),對個體生存是不利的,很難被遺傳下去,只是發(fā)生在體細胞的一種偶然突變。盡管如此,本文報道的棉鈴蟲線粒體基因組的膨脹,仍可為日后的研究提示一種特殊的線粒體基因組變異方式。
參考文獻
[1]GRAY M W. Origin and evolution of mitochondrial DNA [J]. Annual Review of Cell Biology, 1989, 5:2550.
[2]張尚宏. 動物與植物線粒體基因組結構的差異—兩種進化途徑[J]. 動物學研究, 1995, 16(2):132145.
[3]黃族豪, 劉迺發(fā). 動物線粒體基因組變異研究進展[J]. 生命科學研究, 2010, 14(2):166171.
[4]BEAGLEY C T, OKIMOTO R, WOLSTENHOLME D R. The mitochondrial genome of the sea anemone Metridium senile (Cnidaria): introns, a paucity of tRNA genes, and a nearstandard genetic code [J].Genetics,1998,148(3):10911108.
[5]HELFENBEIN K G, FOURCADE H M, VANJANI R G, et al. The mitochondrial genome of Paraspadella gotoi is highly reduced and reveals that chaetognaths are a sister group to protostomes [J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(29):1063910643.
[6]MASTA S E, BOORE J L. Parallel evolution of truncated transfer RNA genes in arachnid mitochondrial genomes[J]. Molecular Biology and Evolution, 2008, 25(5):949959.
[7]BECKENBACH A T, JOY J B.Evolution of the mitochondrial genomes of gall midges (Diptera: Cecidomyiidae): rearrangement and severe truncation of tRNA genes [J]. Genome Biology and Evolution, 2009, 1(1):278287.
[8]SHAO Renfu, MITANI H, BARKER S C, et al. Novel mitochondrial gene content and gene arrangement indicate illegitimate intermtDNA recombination in the chigger mite, Leptotrombidium pallidum [J]. Journal of Molecular Evolution, 2005, 60(6):764773.
[9]SHAO Renfu, BARKER S C. The highly rearranged mitochondrial genome of the plague thrips, Thrips imaginis (Insecta: Thysanoptera): convergence of two novel gene boundaries and an extraordinary arrangement of rRNA genes [J]. Molecular Biology and Evolution, 2003, 20(3):362370.
[10]FUJITA M K, BOORE J L, MORITZ C. Multiple origins and rapid evolution of duplicated mitochondrial genes in parthenogenetic geckos (Heteronotia binoei; Squamata, Gekkonidae)[J].Molecular Biology and Evolution,2007,24(12):27752786.
[11]LAVROV D V, BOORE J L, BROWN W M. Complete mtDNA sequences of two millipedes suggest a new model for mitochondrial gene rearrangements: duplication and nonrandom loss[J].Molecular Biology and Evolution,2002,19(2):163169.
[12]邱忠營. 直翅目昆蟲線粒體基因組比較、譜系及進化研究[D]. 西安:陜西師范大學, 2016.
[13]BURGER G, FORGET L, ZHU Yun, et al. Unique mitochondrial genome architecture in unicellular relatives of animals [J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(3):892897.
[14]SMITH D R, KAYAL E, YANAGIHARA A A, et al. First complete mitochondrial genome sequence from a box jellyfish reveals a highly fragmented linear architecture and insights into telomere evolution [J]. Genome Biology and Evolution, 2011, 4(1):5258.
[15]SHAO Renfu, KIRKNESS E F, BARKER S C. The single mitochondrial chromosome typical of animals has evolved into 18 minichromosomes in the human body louse, Pediculus humanus [J]. Genome Research, 2009, 19(5):904912.
[16]LANG B F, LAFOREST M J, BURGER G. Mitochondrial introns: a critical view [J]. Trends in Genetics, 2007, 23(3):119125.
[17]HAUSNER G. Fungal mitochondrial genomes, plasmids and introns [J]. Applied Mycology and Biotechnology,2003,3(3):101131.
[18]BROWN G G, COLAS DES FRANCSSMALL C, OSTERSETZERBIRAN O. Group Ⅱ intron splicing factors in plant mitochondria [J]. Frontiers in Plant Science, 2014, 5(5):35.
[19]BEAGLEY C T, OKADA N A, WOLSTENHOLME D R. Two mitochondrial group I introns in a metazoan, the sea anemone Metridium senile: one intron contains genes for subunits 1 and 3 of NADH dehydrogenase [J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(11):56195623.
[20]MEDINA M, COLLINS A G, TAKAOKA T L, et al. Naked corals: Skeleton loss in Scleractinia[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(24):90969100.
[21]TANG Sha, HYMAN B C. Mitochondrial genome haplotype hypervariation within the isopod parasitic nematode Thaumamermis cosgrovei [J].Genetics,2007,176(2):11391150.
[22]SNYDER M, FRASER A R, LAROCHE J, et al. Atypical mitochondrial DNA from the deepsea scallop Placopecten magellanicus [J]. Proceedings of the National Academy of Sciences of the United States of America,1987,84(21):75957599.
[23]FULLER K M, ZOUROS E. Dispersed discrete length polymorphism of mitochondrial DNA in the scallop Placopecten magellanicus (Gmelin)[J]. Current Genetics, 1993, 23(4):365369.
[24]SMITH D R, SNYDER M. Complete mitochondrial DNA sequence of the scallop Placopecten magellanicus: evidence of transposition leading to an uncharacteristically large mitochondrial genome[J]. Journal of Molecular Evolution, 2007, 65(4):380391.
[25]RIGAA A, MONNEROT M, SELLOS D. Molecular cloning and complete nucleotide sequence of the repeated unit and flanking gene of the scallop Pecten maximus mitochondrial DNA: putative replication origin features [J]. Journal of Molecular Evolution, 1995, 41(2):189195.
[26]LIU Yunguo, KUROKAWA T, SEKINO M, et al. Complete mitochondrial DNA sequence of the ark shell Scapharca broughtonii: an ultralarge metazoan mitochondrial genome [J]. Comparative Biochemistry and Physiology Part D: Genomics and Proteomics, 2012, 8(1):7281.
[27]RAIMOND R, MARCAD I, BOUCHON D, et al. Organization of the large mitochondrial genome in the isopod Armadillidium vulgare [J]. Genetics, 1999, 151(1):203210.
[28]BOYCE T M, ZWICK M E, AQUADRO C F. Mitochondrial DNA in the bark weevils: size, structure and heteroplasmy[J]. Genetics, 1989, 123(4):825836.
[29]YIN Jiao, HONG Guiyun, WANG Aiming, et al. Mitochondrial genome of the cotton bollworm Helicoverpa armigera (Lepidoptera: Noctuidae) and comparison with other lepidopterans [J].Mitochondrial DNA Part A,2010,21(5):160169.
[30]GRANT J R, STOTHARD P. The CGView Server: a comparative genomics tool for circular genomes [J]. Nucleic Acids Research, 2008, 36:w181w184.
[31]HU Bo, JIN Jinpu, GUO Anyun, et al. GSDS 2.0: an upgraded gene feature visualization server [J].Bioinformatics, 2014, 31(8):12961297.
[32]KOHANY O, GENTLES A J, HANKUS L, et al. Annotation, submission and screening of repetitive elements in Repbase: Repbase Submitter and Censor [J]. BMC Bioinformatics, 2006, 7(1):474.
[33]HARTL D L. Mitochondrial pseudogenes: evolutions misplaced witnesses [J]. Trends in Ecology and Evolution, 2001, 16(6):314321.
[34]ZISCHLER H. Nuclear integrations of mitochondrial DNA in primates: inference of associated mutational events [J]. Electrophoresis, 2000, 21(3):531536.
[35]VAUGHAN H E, HESLOPHARRISON J S, HEWITT G M. The localization of mitochondrial sequences to chromosomal DNA in orthopterans [J]. Genome, 1999, 42(5):874880.
[36]SUNNUCKS P, HALES D F. Numerous transposed sequences of mitochondrial cytochrome oxidase ⅠⅡ in aphids of the genus Sitobion (Hemiptera: Aphididae)[J]. Molecular Biology and Evolution, 1996, 13(3):510524.
[37]KOUTROUMPA F A, LIEUTIER F, ROUXMORABITO G. Incorporation of mitochondrial fragments in the nuclear genome (Numts) of the longhorned beetle Monochamus galloprovincialis (Coleoptera, Cerambycidae)[J]. Journal of Zoological Systematics and Evolutionary Research, 2009, 47(2):141148.
[38]PALMER J D, ADAMS K L, CHO Y, et al. Dynamic evolution of plant mitochondrial genomes: mobile genes and introns and highly variable mutation rates [J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(13):69606966.
[39]陳志文, 王玉美, 聶虎帥, 等. 植物水平基因轉移研究進展[J]. 中國農業(yè)大學學報, 2018, 23(1):111.
[40]SONG H, BUHAY J E, WHITING M F, et al. Many species in one: DNA barcoding overestimates the number of species when nuclear mitochondrial pseudogenes are coamplified [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(36):1348613491.
(責任編輯:楊明麗)

