東北地區(qū)雞源多重耐藥大腸桿菌整合子的檢測(cè)
馮濤 何紀(jì)元 薛原
摘要[目的]了解東北地區(qū)雞源大腸桿菌耐藥性的流行特征以及整合子-基因盒系統(tǒng)的耐藥機(jī)制。[方法]在檢測(cè)耐藥性的基礎(chǔ)上,采用PCR方法對(duì)整合酶和整合子進(jìn)行檢測(cè)和克隆測(cè)序,并且對(duì)檢測(cè)結(jié)果和耐藥基因盒與GenBank數(shù)據(jù)庫(kù)的序列進(jìn)行比對(duì)和分析。[結(jié)果]413株分離菌中整合子檢出率為71.91%,整合酶 Ⅰ 和整合酶 Ⅱ 的檢出率分別為65.52%和54.48%,整合酶 Ⅲ未檢出。序列分析得出,共包含6種整合子,各自攜帶不同組合的基因盒。[結(jié)論]Ⅰ 型整合子在細(xì)菌耐藥性的傳播過(guò)程中發(fā)揮著至關(guān)重要的作用。
關(guān)鍵詞雞;大腸桿菌;耐藥性;PCR;整合子;基因盒
中圖分類(lèi)號(hào)S852.61文獻(xiàn)標(biāo)識(shí)碼A
文章編號(hào)0517-6611(2019)02-0083-03
doi:10.3969/j.issn.0517-6611.2019.02.024
雞主要為人類(lèi)提供食用價(jià)值和藥用價(jià)值,也有一些雞的種類(lèi)具有觀賞價(jià)值[1]。隨著抗菌藥物使用頻率的逐漸增加,大腸桿菌在臨床上的耐藥情況也越來(lái)越強(qiáng),在近幾年的研究中多重耐藥的情況也較多[2]。耐藥基因的傳播不僅對(duì)雞源的飼養(yǎng)有重要影響,而且對(duì)人類(lèi)生活也會(huì)產(chǎn)生間接影響。
整合子是一種可以移動(dòng)遺傳的物質(zhì),具有特異性結(jié)合和捕獲耐藥基因的能力,在整合酶的催化下完成表達(dá)過(guò)程[3]。整合子有2種途徑進(jìn)行表達(dá):一是可以與質(zhì)粒或者染色體連接,二是成為轉(zhuǎn)座子的組成部分,繼而完成其移動(dòng)和表達(dá)的過(guò)程[4]。整合子隨質(zhì)粒和轉(zhuǎn)座子的表達(dá)加速了耐藥基因水平以及垂直傳播,耐藥水平和多重耐藥性均有上升。整合子是一個(gè)組合基因,包括兩端高度保守序列和存在于二者之間的可變區(qū)域。在保守序列中含有整合酶基因、決定特異性的序列片段以及可變區(qū)的啟動(dòng)子,整合子可以通過(guò)編碼整合酶特異性來(lái)選擇結(jié)合特定的基因盒。筆者對(duì)東北地區(qū)不同雞源養(yǎng)殖場(chǎng)的大腸桿菌耐藥性和 Ⅰ 型整合子進(jìn)行了檢測(cè),旨在了解雞源大腸桿菌的整合子-基因盒系統(tǒng)的流行情況,為控制雞的多重耐藥性提供依據(jù)和研究方向。
1材料與方法
1.1菌株
大腸桿菌質(zhì)控菌株(菌株編號(hào)為ATCC25922),由中國(guó)獸醫(yī)藥品監(jiān)察所提供;試驗(yàn)用大腸桿菌413株,分離自東北不同地區(qū)雞養(yǎng)殖場(chǎng)。
1.2主要試劑
22種藥敏紙片,包括安普霉素(APR)、氨芐西林(AMP)、環(huán)丙沙星(CIP)、頭孢噻吩(KF)、頭孢他啶(CAZ)、阿米卡星(AK)、氯霉素(C)、阿莫西林/克拉維酸(AMC)、四環(huán)素(TE)、諾氟沙星(NOR)、亞胺培南(IPM)、氟苯尼考(FFC)、氨曲南(ATM)、氧氟沙星(OFX)、復(fù)方新諾明(SXT)、慶大霉素(N)、強(qiáng)力霉素(DO)、多黏菌素B(PB)、卡那霉素(K)、新霉素(NEO)、恩諾沙星(ENR)、阿莫西林(AMX),均由杭州天和微生物試劑有限公司提供;質(zhì)粒小量提取試劑盒、DNA 片段凝膠回收試劑盒均由愛(ài)思進(jìn)生物技術(shù)有限責(zé)任公司提供;水解酪蛋白瓊脂培養(yǎng)基(mueller-hinton,MH),由西隴科學(xué)股份有限公司提供;10×Buffer、dNTP、Taq 酶、DL2000 Marker、6×Loading Buffer、pMD18-T 載體、感受態(tài)細(xì)胞E.coli DH5α均由TaKaRa公司提供。
1.3藥敏試驗(yàn)
當(dāng)質(zhì)控菌株的抑菌環(huán)處于CLSI[5]的標(biāo)準(zhǔn)范圍內(nèi)時(shí),試驗(yàn)菌株的抑菌結(jié)果有效且穩(wěn)定。試驗(yàn)采用WHO推薦的Kirby-Bauer法[5]對(duì)413株大腸桿菌進(jìn)行藥敏試驗(yàn),按照抗生素的敏感性擴(kuò)散的抑菌環(huán)直徑來(lái)確定不同菌株的耐藥性。然后,采用耐藥、中介、敏感3種評(píng)定標(biāo)準(zhǔn)來(lái)標(biāo)定抑菌環(huán)的大小,最后進(jìn)行匯總分析。
1.4整合酶基因的檢測(cè)
PCR擴(kuò)增體系(25.00 μL)如下:2.50 μL 10×Buffer,2.00 μL dNTP,上、下游引物各1 μL、0.25 μL Taq酶,2.00 μL模板。按照參考文獻(xiàn)[6-8]設(shè)計(jì)引物序列。PCR擴(kuò)增程序如下:94 ℃預(yù)變性5 min;94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30個(gè)循環(huán);72 ℃延伸10 min。通過(guò)瓊脂糖凝膠電泳對(duì)擴(kuò)增出的PCR產(chǎn)物進(jìn)行驗(yàn)證。
1.5整合子的檢測(cè)
參照文獻(xiàn)[9]設(shè)計(jì)引物序列。PCR擴(kuò)增體系同“1.4”。PCR擴(kuò)增程序如下:94 ℃預(yù) 變 性 5 min;94 ℃變性30 s,55.4 ℃退火30 s,72 ℃延伸1 min,共30個(gè)循環(huán);72 ℃再延伸10 min。對(duì)擴(kuò)增出的PCR產(chǎn)物使用瓊脂糖凝膠電泳進(jìn)行驗(yàn)證。
1.6整合子-基因盒的克隆與測(cè)序
將整合子的陽(yáng)性PCR產(chǎn)物擴(kuò)增樣本用膠回收純化后與18-T載體連接,并轉(zhuǎn)入感受態(tài)細(xì)胞E.coli DH5α中克隆復(fù)制,將質(zhì)粒樣本送至哈爾濱博仕生物技術(shù)有限公司測(cè)序部進(jìn)行序列測(cè)定。將返回的核苷酸序列用DNASTAR軟件分析,與GenBank數(shù)據(jù)庫(kù)進(jìn)行比較。
2結(jié)果與分析
2.1大腸桿菌的耐藥性
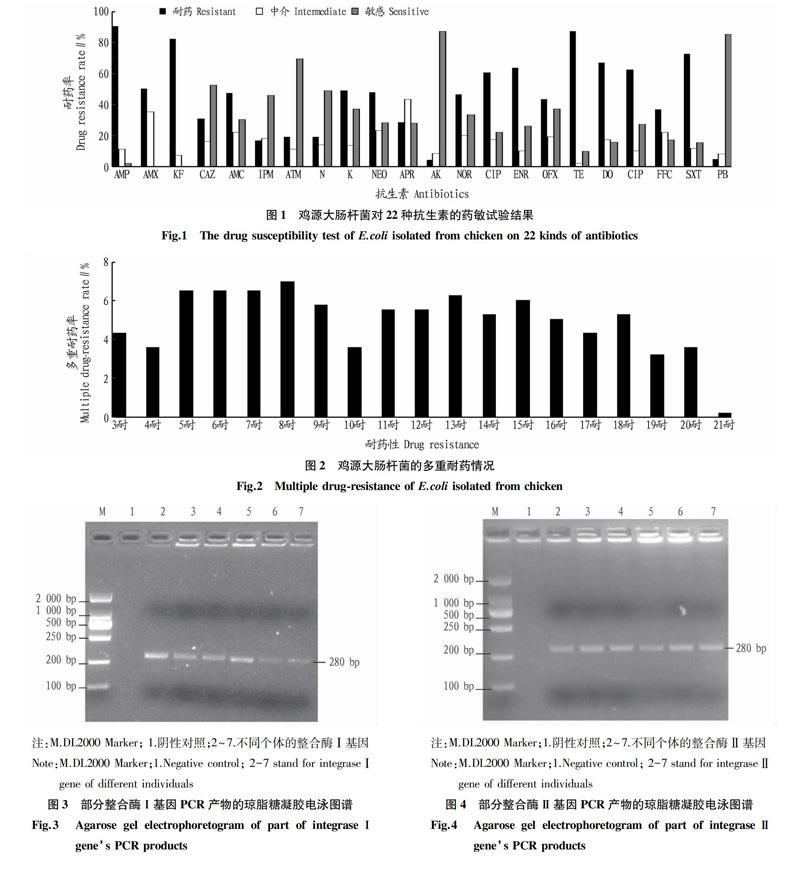
413株雞源大腸桿菌的耐藥情況表現(xiàn)比較復(fù)雜,結(jié)果見(jiàn)圖1。由圖1可知,對(duì)氨芐西林、頭孢噻吩和四環(huán)素3種抗生素的耐藥率都超過(guò)80%;對(duì)有些藥物的敏感性較強(qiáng),如多黏菌素B、氨曲南和阿米卡星,雞源大腸桿菌對(duì)這些抗生素的敏感性達(dá)70%。
在413株雞源大腸桿菌中,試驗(yàn)菌株中8重耐藥的比例最大,達(dá)7.02%。分離菌株的多重耐藥現(xiàn)象比較明顯,最少為3種,最多為21種,結(jié)果見(jiàn)圖2。
2.2整合酶基因的檢測(cè)
413株大腸桿菌中整合酶 Ⅰ 被檢出為陽(yáng)性的有271株,檢出率為65.52%,見(jiàn)圖3。整合酶 Ⅱ 的陽(yáng)性菌株有225株,陽(yáng)性率為54.48%,見(jiàn)圖4。整合酶 Ⅲ基因未檢出。
2.3整合子的檢測(cè)
413株雞源大腸桿菌中,Ⅰ 型整合子基因的PCR 產(chǎn)物片段出現(xiàn)多種不同大小的條帶,見(jiàn)圖5。413株大腸桿菌菌株中297株 Ⅰ 型整合子基因擴(kuò)增結(jié)果呈陽(yáng)性,檢出率為71.91%。
3討論
該試驗(yàn)中雞源大腸桿菌對(duì)采用的22種抗生素具有不同程度的耐藥性,多重耐藥可達(dá)21種,其中較高的是8重耐藥,耐8種抗生素的占總數(shù)的7.02%,3重及3重耐藥以上的耐藥菌株包括391株,所占比例可達(dá)94.68%。這些結(jié)果都表明東北地區(qū)雞源養(yǎng)殖場(chǎng)在治療普通疾病時(shí)具有較復(fù)雜的用藥過(guò)程,多重耐藥情況明顯,單一抗生素的耐藥性卻并不普遍,大腸桿菌在東北地區(qū)使用的抗生素種類(lèi)復(fù)雜,在不斷的選擇壓力下逐漸進(jìn)化為多重耐藥的菌株[10]。
該試驗(yàn)使用的PCR引物擴(kuò)增技術(shù)篩選 Ⅰ 型整合子和整合酶,以了解整合子的流行和傳播程度。檢測(cè)結(jié)果顯示,雞源大腸桿菌 Ⅰ 型整合子存在具有廣泛性和普遍性,413株大腸桿菌菌株中檢出 Ⅰ 型整合子297株,檢出率達(dá)到71.91%。通過(guò)GenBank核酸序列數(shù)據(jù)庫(kù)對(duì)比分析,發(fā)現(xiàn)雞源大腸桿菌Ⅰ 型整合子攜帶的基因盒組合形式有aadA1-aadA22-aadA23、aadA1-aadA2-dfrA1-dfrA12-drfA15、aadA5-dfrA17、aadA1-aadA2-aadA29-dfrA1-dfrA12-dfrA15、aadA2-aadA28-dfrA12和aadA2-dfrA16。該研究中的整合子中出現(xiàn)的基因盒 dfrA1、dfrA12、dfrA15、dfrA16和dfrA17可以編碼二氫葉酸還原酶; aadA1、 aadA2、aadA5、aadA22、aadA23、aadA28、aadA29能促進(jìn)腺苷轉(zhuǎn)移酶的表達(dá)。李琳等[11]對(duì)安徽地區(qū)的雞源大腸桿菌的整合子以及基因盒進(jìn)行了檢測(cè)和分析,結(jié)果表明試驗(yàn)的菌種中均檢測(cè)出 Ⅰ 型整合子,檢出率高達(dá)100%,其攜帶基因盒的種類(lèi)主要包括5種,有3種組合形式流行。楊聰?shù)萚12]對(duì)寧夏地區(qū)的雞源耐藥性大腸桿菌進(jìn)行了研究,結(jié)果發(fā)現(xiàn) Ⅰ 型整合子的檢出率為75%,其中aadA5-dfrA17基因盒在該研究中也有出現(xiàn)。該研究與國(guó)內(nèi)外研究[11-14]報(bào)道的大腸桿菌 Ⅰ 型整合子的檢出率十分相近,主要存在的基因盒包括aadA 和dfrA兩種 ,但基因盒的種類(lèi)及其組合方式存在較大差異,可能與整合子的地區(qū)分布以及不同地區(qū)的用藥差異有關(guān)。Ⅰ 型整合子在不同地區(qū)不同動(dòng)物源大腸桿菌內(nèi)廣泛存在,尤其是各地區(qū)雞源大腸桿菌的耐藥基因盒流行普遍,證實(shí)了在對(duì)雞等禽類(lèi)的飼養(yǎng)過(guò)程中用藥的不合理情況。
該研究對(duì)東北地區(qū)(包括黑龍江、吉林、遼寧)的雞源大腸桿菌樣本做了整合子-基因盒檢測(cè)試驗(yàn),結(jié)果發(fā)現(xiàn)雞源大腸桿菌整合子中 Ⅰ 型整合子的分布比較廣泛。與整合子的關(guān)系密切得主要為aadA和dfrA這2個(gè)基因,這2種基因也是在近幾年國(guó)內(nèi)外報(bào)道中整合子介導(dǎo)的最常見(jiàn)的抗藥基因型[15]。 Ⅰ 型整合子對(duì)細(xì)菌的耐藥性和多重抗藥率、抗藥譜具有十分重要的作用,是能夠直觀體現(xiàn)多重抗藥性的一項(xiàng)重要指標(biāo)。雞源大腸桿菌耐藥性產(chǎn)生的主要原因是由于臨床治療以及飼料中添加藥物導(dǎo)致,也有可能是由于環(huán)境污染(水源污染、土壤污染)所導(dǎo)致的耐藥性產(chǎn)生。在近幾年的國(guó)內(nèi)外研究進(jìn)展中,可以發(fā)現(xiàn)有些耐藥基因盒產(chǎn)生的原因主要是由于傳統(tǒng)的抗生素,而一些新型抗生素的耐藥基因盒在研究過(guò)程中很少出現(xiàn),由此可見(jiàn)這些基因盒的廣泛傳播主要依賴(lài)于長(zhǎng)時(shí)間的選擇壓力,而新型抗生素還未產(chǎn)生這種影響,但是整合子具有強(qiáng)大的從環(huán)境中獲取基因盒的能力,若不改善用藥情況,可能很快會(huì)造成新的耐藥基因盒的出現(xiàn)和廣泛傳播。因此,臨床用藥或在飼料中添加藥物時(shí),應(yīng)注意多種抗生素輪換使用,不要長(zhǎng)期大量使用某種藥物,以減少抗生素的依賴(lài)性,避免產(chǎn)生和擴(kuò)散細(xì)菌耐藥性,影響治療效果,造成經(jīng)濟(jì)損失和其他嚴(yán)重后果。
參考文獻(xiàn)
[1]朱建錄,劉先珍.烏骨雞的經(jīng)濟(jì)價(jià)值與飼養(yǎng)管理技術(shù)[J].畜牧獸醫(yī),2006(5):57-59.
[2] SKOCˇKOV A,KOLCˇKOV I,BOGDANOVICˇOV K,et al.Characteristic and antimicrobial resistance in Escherichia coli from retail meats purchased in the Czech Republic[J].Food control,2015,47:401-406.
[3] SCHWARZER A,KAESBERG A K,BERGMANN S,et al.Activity rhythms and use of nest boxes of juvenile mink in seminatural group housing[J].KVet Dent,2017,18: 13-22.
[4] POEY M E,LAVIN~A M.Integrons in uropathogenic Escherichia coli and their relationship with phylogeny and virulence[J].Microbial pathogenesis,2014,77: 73-77.
[5]張炳亮,王文文,楊國(guó)棟,等.洛陽(yáng)地區(qū)規(guī)模化豬場(chǎng)大腸桿菌耐藥基因檢測(cè)及耐藥性分析[J].黑龍江畜牧獸醫(yī),2018(5):125-128.
[6] DOLEJSKA M,CIZEK A,LITERAK I.High prevalence of antimicrobial-resistant genes and integrons in Escherichia coli isolates from Black-headed Gulls in the Czech Republic[J].Journal of applied microbiology,2007,103(1): 11-19.
[7]? KOELEMAN J G,STOOF J,VAN DER BIJL M W,et al.Identification of epidemic strains of Acinetobacter baumannii by integrase gene PCR[J].J Clin Microbiol,2001,39(1): 8-13.
[8] GOLDSTEIN C,LEE M D,SANCHEZ S,et al.Incidence of class 1 and? 2 integrases in clinical and commensal bacteria from livestock,companion animals,and exotics[J].Antimicrob Agents Chemother,2001,45(3): 723-726.
[9] DE LA TORRE E,COLELLO R,F(xiàn)ERNNDEZ D,et al.Multidrug resistance in Escherichia coli carrying integrons isolated from a pig farm with moderate antibiotic use[J].J Gen Appl Microbiol,2015,61(6): 270-273.
[10] 段俊秀.雞大腸桿菌的分離鑒定及耐藥性試驗(yàn)[J].中國(guó)畜牧業(yè),2015(5):55-56.
[11] 李琳,代興楊,汪瑩,等.安徽雞源大腸桿菌整合子-基因盒分布及同源性分析[J].中國(guó)獸醫(yī)科學(xué),2016,46(10):1277-1282.
[12] 楊聰,周學(xué)章,杜軍,等.寧夏地區(qū)雞源耐藥性大腸桿菌Ⅰ類(lèi)整合子的研究[J].中國(guó)獸醫(yī)雜志,2015,51(1):88-90.
[13] CHIRILA F,TABARAN A,F(xiàn)IT N,et al.Concerning increase in antimicrobial resistance in shiga toxinproducing Escherichia coli isolated from young animals during 1980-2016[J].Microbes Environ,2017,32(3):252-259.
[14] CHUNG Y S,SONG J W,KIM D H,et al.Isolation and characterization of antimicrobial-resistant Escherichia coli from national horse racetracks and private horse-riding courses in Korea[J].J Vet Sci,2016,17(2): 199-206.
[15] 劉玉芹,閆平,董淑珍,等.河北部分腹瀉仔豬源大腸桿菌整合子-基因盒的分子流行病學(xué)調(diào)查[J].黑龍江畜牧獸醫(yī),2018(8): 98-100.

