實時與瞬時彈性成像在肝纖維化評價中的應用
翟 哲,張超學
早期肝纖維化具有可逆性,所以早期評估肝纖維程度,盡早采取干預措施對于逆轉肝纖維化具有重要作用[1]。對于肝纖維化的評估,臨床目前多采用血清生化檢測、肝組織病理檢查及影像學檢查。傳統超聲對失代償期肝硬化的診斷價值已得到廣泛證實,但對肝纖維化程度及早期肝硬化的診斷價值則十分有限。肝穿刺病理活檢雖是診斷肝纖維化的金標準,但有取材小、可重復性差、有創、風險大等缺點,對于肝纖維化的診斷臨床有一定局限性[2]。瞬時彈性成像(FibroScan,FS)和實時組織超聲彈性成像(real-time tissue ultrasound elastography,RTE)分別通過測定肝臟硬度值和半定量分析組織或病變的彈性改變來診斷肝纖維化或肝硬化程度[3]。該研究旨在明確RTE與FS在慢性乙肝患者肝纖維化程度評價中的應用價值,現報道如下。
1 材料與方法
1.1 病例資料選取安徽醫科大學第一附屬醫院在2015年5月~2018年5月接診的210例慢性乙肝患者作為觀察組。納入標準:符合《慢性乙型肝炎防治指南(2015更新版)》[4]制定的慢性乙肝或慢性乙肝肝硬化診斷標準;經血清及病毒標志物檢測確診為乙型肝炎;本研究通過了醫院倫理委員會批準;患者自愿參與研究并簽署了知情同意書。排除標準:合并乙肝及乙肝肝硬化以外的肝病者(如甲肝、丙肝、丁肝、酒精性肝病、肝吸蟲感染性肝病、自身免疫性肝病等);合并與肝纖維化有關的肝外疾病(如腎功能衰竭、風濕病、糖尿病、系統性紅斑狼瘡等)。其中男115例,女95例,年齡19~62(37.51±12.87)歲。另選取同期進行健康體檢的120例健康志愿者作為對照組,入組對象無病毒性肝炎或脂肪肝病史,肝功能正常,無酗酒史或長期用藥史。男69例,女51例,年齡21~64(38.63±11.28)歲。兩組研究對象的性別構成比與年齡比較,差異均無統計學意義(P>0.05)。
1.2 方法儀器選用法國Echosens公司生產的FibroScan 502彩超儀(瞬時彈性成像)和Hitachi公司生產的HI Vision Preirus彩超儀(實時組織彈性成像)。兩組研究對象均行超聲RTE與FS檢查,觀察組患者在完成影像學檢查后,在超聲引導下進行穿刺,取肝組織進行病理學檢查。
1.2.1RTE檢查 受檢者取平臥位,右手上抬放于耳側,將探頭置于右肋間進行掃查,觀察右肝前葉情況。選擇合適切面轉換至SWE模式,使彈性成像取樣框位于右肝包膜下1 cm的肝實質處,注意避開肋骨陰影與肝內粗大管道結構。囑受檢者屏住呼吸3~5 s,當彈性應變曲線呈現5個穩定波形后凍結圖像。讀取相關變量:應變均值(MEAN)、標準偏差(SD)、峰度(KURT)、偏度(SKEW)、復雜度(COMP)、相關性(CORR)、均等性(ENT)、雜亂度(IDM)、藍色領域百分比(AREA),重復操作5次最終取平均值。根據測得相關數值,計算肝纖維化指數(LF Index)=0.043 AREA+4.520 KURT+0.033 MEAN-1.002 SKEW。
1.2.2FS檢查 受檢者取平臥位,右手上抬放于耳側,將換能器探頭置于右肋間進行掃查,探頭垂直于皮膚,固定測量位置。按下探頭按鈕開始進行圖像采集,通過軟件自動分析測定圖像采集是否成功,測定肝硬度值(LSM),成功測定10次后取中位數,若偏差超過中位數的1/3,或者操作成功次數不足60次,均視為無效,需重新測定采集。
1.2.3肝組織病理學檢查 超聲檢查后24 h內完成肝穿刺病理活檢。使用18 G一次性自動活組織穿刺針行經皮肝穿刺,穿刺位置與RTE檢查及FS檢查為同一部位,以獲取標本。獲取肝組織標本后,使用4%的甲醛進行固定,采集的肝組織標本長度不得短于1.5 cm,且包含的匯管區數量要≥6個。由兩名病理醫師獨立閱片,病理分期參考《病毒性肝炎防治方案》指定的慢性肝炎纖維化分期標準:無肝纖維化為F0期;匯管區纖維化擴大,局限竇周及小葉內纖維化為F1期;匯管區周圍纖維化,小葉結構保留,形成纖維間隔為F2期;纖維間隔形成,小葉結構紊亂為F3期;早期肝硬化為F4期。
1.3 觀察指標根據肝纖維化分期的不同,將觀察組患者分為5個亞組,對比對照組與觀察組各亞組的RTE與FS檢測結果;分析RTE、FS檢測指標與肝纖維化分期的相關性。
2 結果
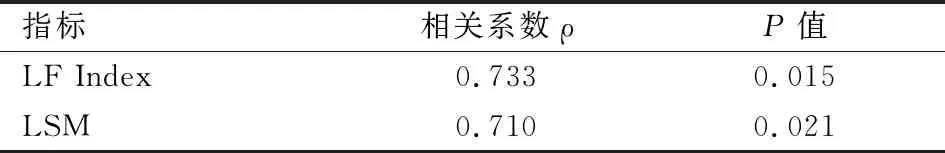
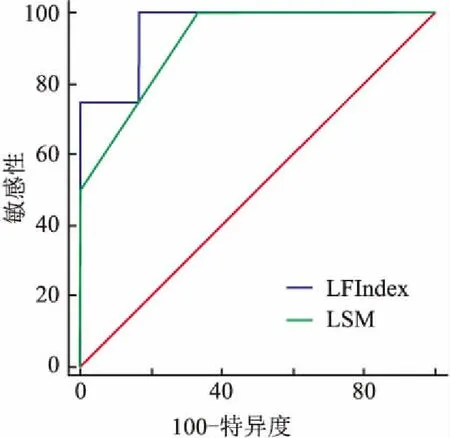
2.1 RTE檢測指標對比經肝組織病理活檢顯示,觀察組中F0期35例、F1期61例、F2期38例、F3期44例、F4期32例。對照組與觀察組各亞組的KURT、ENT、IDM、CORR比較,差異均無統計學意義(P>0.05);觀察組中,F0期患者的MEAN、SD、COMP、SKEW、AREA值與對照組比較,差異無統計學意義(P>0.05)。對照組與觀察組各亞組的MEAN、SD、COMP、SKEW、AREA值比較,差異均有統計學意義(P<0.05)。隨著肝纖維化分期的升高,MEAN呈現出下降趨勢(F0期>F1期>F2期>F3期>F4期),SD、COMP、SKEW、AREA值均呈現出升高趨勢(即F0期 2.2 LF Index、LSM水平與對照組比較,觀察組的LF Index值F0期 表1 對照組與觀察組各亞組的RTE檢測指標比較 與對照組比較:*P<0.05 表2 觀察組的LF Index、LSM水平比較 與對照組比較:*P<0.05 2.3 LF Index、LSM與肝纖維化分期的相關性相關性分析顯示LF Index、LSM與肝纖維化分期均呈正相關性(P<0.05)。見表3。 表3 LF Index、LSM與肝纖維化分期的相關性 2.4 ROC曲線下面積以F2期為分界點,LF Index和LSM值的ROC曲線下面積(AUC值)分別為0.892(95%CI:0.758~0.925)和0.905(95%CI:0.815~0.992),見圖1。以F3期為分界點,LF Index和LSM值的AUC值分別為0.886(95%CI:0.826~0.964)和0.872(95%CI:0.814~0.910),見圖2。 圖1 LF Index與LSM值的ROC曲線(以F2期為分界點) 影像學檢查主要通過觀察肝臟組織形態學變化來判定肝纖維化程度,臨床常用的檢查方式有超聲、MRI、CT等[5]。其中,超聲檢查是慢性肝炎影像學檢查中使用率最高的一種方法。 超聲彈性成像技術的發展為超聲量化評估肝纖維化程度開辟了新的途徑。目前,臨床用于評估肝纖維化程度的超聲彈性成像方法主要有FS與RTE兩種。歐洲和美國肝病學會均對FS在肝病診斷中的應用價值給予了充分肯定,并建議臨床采用FS等無創影像學手段作為肝組織活檢診斷肝纖維化程度的補充或替代手段[6]。有研究[7]提示,LSM值>10.8 kPa的慢性乙肝患者,發生肝纖維化的可能性更大,而<5.15 kPa的慢性乙肝患者無明顯纖維化改變,因此臨床可通過LSM值來初步篩查有必要實施抗病毒治療的患者。本次研究結果顯示,對照組與觀察組各亞組的LSM值比較,差異均有統計學意義,LSM值均隨著肝纖維化分期的升高而升高,并且LSM與肝纖維化分期呈正相關。在診斷價值方面,LSM值的AUC值分別為0.905和0.872(分別以F2期和F3期為分界點),AUC值均>0.85,說明LSM值對肝纖維化有較高的診斷價值。這一結果與李昶玥 等[8]國內外多篇文獻報道結論相符,說明FS對肝纖維化有較高的診斷敏感性,通過進行FS檢測LSM值可為臨床診斷肝纖維化和制定抗病毒治療方案提供指導。但FS仍有一定局限性,因FS是一維成像系統,取樣范圍局限,并且無法做常規超聲成像,常不能避開肝內大血管而對測量結果產生干擾。 圖2 LF Index與LSM值的ROC曲線(以F3期為分界點) 近年來發展起來的新一代RTE技術結合組織彌散定量分析軟件,能利用多元線性回歸方程計算出 LF Index值,更直觀便捷地評估肝纖維化程度。本次研究結果顯示:隨著肝纖維化分期的升高,MEAN呈現出下降趨勢(F0期>F1期>F2期>F3期>F4期),SD、COMP、SKEW、AREA以及LF Index均呈現升高趨勢(即F0期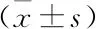
3 討論