晝夜節律鐘基因及TTFL 模型的發現歷程
任衍鋼 白冠軍 宋玉奇 路彥文
(陽泉師范高等專科學校 山西平定 045200)
生物鐘的研究源遠流長。據記載,早在公元前4 世紀, 亞歷山大大帝時期就有一位船長記錄羅望子樹葉晝夜開合的現象。 首次提到生物節律具有內源性(endogenous)的文獻是在1729 年,法國天文學家梅朗(Mairan J.O.)發現含羞草的羽狀復葉在完全黑暗的環境下仍然能保持24h 的開合周期, 這表明了生物的晝夜節律鐘是并不依賴于環 境 中 的 光 照 等 外 界 環 境 條 件[1]。 1918 年,希 曼斯基(Szymansid J.S.)發現,沒有外界光和溫度的變化,動物仍然保持24h 的周期活動。 20 世紀50年代前對生物鐘的研究是零星的、碎片化的,沒有進行概念層次上的探討。 1959 年, 時間生物學(chronobiology)創始人哈爾伯格(Halberg F.)首先引入“晝夜節律鐘(circadian rhythm)”術語。 circadian 這個詞來自拉丁語,由circa(大約)和diem(一天)合成,即晝夜的意思[2]。晝夜節律鐘內源性機制的揭示是從模式生物果蠅開始的。
1 per 基因的發現及TTFL 模型的提出
早在1935 年,德國生物學家漢斯(Hans K.)和歐文(Erwin B.)首次各自獨立地發現黑腹果蠅晝夜節律的存在。 1954 年,“生物鐘之父”英裔美籍科學家培騰德瑞(Pittendrigh C.)在觀察野生果蠅活動時發現, 果蠅在發育期總是在一天中特定的時間羽化。他通過觀察果蠅發育的一系列行為,認為生物鐘具有內源性且受遺傳物質控制, 而不是由外界環境主導[3]。 正是這些初始的研究啟迪后續學者在研究果蠅晝夜節律方面取得了劃時代的突破。 果蠅作為模式生物研究的優點是: 個體小、繁殖快、易在實驗室培養,染色體數目少,后代數量大,較容易發現突變類型,這就為發現控制晝夜節律鐘的基因提供了有利條件。首先是美國遺傳 學 家 康 諾 普 卡(Konopka R.)和 本 澤(Benzer S,康諾普卡是本澤的首位研究生)用甲基磺酸乙酯(EMS)處理黑腹果蠅(Drosophila melanogaster)誘導其基因組點突變,并在羽化期將其分離出來,然后調查2 000 只果蠅的晝夜節律鐘。結果發現,這2 000 只果蠅中,大多數是12 h 活動,12 h 休息;但有3 種突變體具有異常節律,一種(perS)是9 h的周期,一種(perL)是8 h 的周期,還有一種(per0)似乎沒有周期, 活動和休息的時間表現出隨機交替。他們用傳統的方法繪制出染色體圖,發現這些晝夜節律鐘突變型都處于X 染色體相同的位置,距白眼基因小于1 cM 的位點上,屬于等位基因,因與晝夜節律鐘有關,故命名為period(中文:周期;英文縮寫per)基因。 1971 年,他們公布了研究結果,首次證實生物鐘基因的存在[4]。這一發現被認為是步入生物鐘研究新時代的里程碑。
per 如何為生物鐘定時?1984 年,霍爾(Hall J.)和羅斯巴什(Rosbash M.)、楊(Young M.)2 個團隊成功地分離了per 基因。 他們發現,perS和perL都是點突變,導致一個氨基酸發生改變(甲基磺酸乙酯的作用機制是使DNA 上的一個堿基發生轉換,即A—G);per0則引入了一個終止密碼子,導致蛋白質的翻譯提前終止。 1988 年,霍爾和羅斯巴什發現per 基因編碼的蛋白質——PER 蛋白, 此蛋白呈現出夜間累積而白天降解的晝夜節律變化。1990 年, 在羅斯巴什實驗室工作的哈丁(Hardin P.E.)等,通過檢測果蠅腦內的mRNA 發現per基因轉錄的mRNA 也呈現晝夜變化, 而且per mRNA 峰值出現的時間要比PER 蛋白峰值出現時間早幾個小時。 他們依據per mRNA 和PER 蛋白都呈現的節律性變化,PER 過表達會抑制體內per mRNA 的翻譯,并且此抑制作用表現出細胞負反饋調節[5],提出了果蠅生物鐘的TTFL(Transcription-Translation Feedback Loop, 即轉錄–翻譯反饋環路)模型[1](圖1)。

圖1 1990 年提出的果蠅晝夜節律TTFL 模型
2 per 基因的調控及TTFL 模型的深化
PER 蛋白如何進入細胞核內起作用? 1992年, 羅斯巴什實驗室利用免疫電鏡技術對per 基因的表達進行了亞細胞定位,發現PER 蛋白是定位 在 細 胞 核 內 影 響 生 物 節 律 的[6]。 1994 年,楊 實驗室的普萊斯(Price J.L.)發現,位于果蠅2 號染色體上的一個基因也與晝夜節律鐘有關, 這是繼per 基因后,發現的第2 個生物鐘基因——timeless基因(中文:永久;英文縮寫tim),其編碼正常晝夜節律鐘所需的TIM 蛋白。 他們發現,per 基因與tim 基因表達的時間基本一致, 并發現當TIM 蛋白結合PER 蛋白之后,2 種蛋白質才能進入細胞核,在那里抑制per 基因的活性,這樣圖1 的模型更清晰(圖2)。

圖2 基于1994 年發現的tim 基因而深化的TTFL 示意圖
這種調控機制雖然解釋了細胞中PER 蛋白質水平與晝夜節律鐘同步的變化, 但蛋白質水平變化的頻率如何控制? 1997—1998 年,楊和他在洛克菲勒大學的團隊在果蠅3 號染色體上發現了另一個基因——doubletime 基因(中文:雙重時間或快步;英文縮寫dbt)也參與了晝夜節律鐘的活動,它所編碼的DBT 蛋白可延緩PER 蛋白的累積。DBT 是一種蛋白激酶,在細胞質內對PER 進行磷酸化,使其穩定性降低,從而易于與TIM 結合。 兩者結為異二聚體后性能穩定,進入細胞核[7]。 當TIM 被降解后,PER 會從復合物中暴露出來,被DBT 磷 酸 化, 促 使PER 蛋 白 在 細 胞 核 內 降 解[8]。這就進一步解釋了PER 蛋白的水平變化如何與24 h 周期相匹配(圖3)。

圖3 基于1997 年發現的dbt 基因而深化的TTFL 示意圖
激活per 和tim 基因的起始點是什么?這個秘密首先是在模式生物小鼠身上揭開的。 1994 年,日本出生的美籍神經科學家高橋(Takahashi J.)和他的團隊發現,在數周持續的光照下,一種失去晝夜節律鐘的純合突變小鼠會轉錄一種mRNA,翻譯成CLOCK(時鐘)蛋白,并與另一個基因DNA鏈結合,激活per 基因。 1998 年,霍爾和羅斯巴什等通過遺傳基因篩選, 在果蠅3 號染色體上也找到了與小鼠clock 基因同源的dClock 基因(中文:鐘,縮寫為Clk 或jrk 基因)。 他們發現,dClock 基因突變會延長TTFL 環路的周期, 并且這些突變導致果蠅PER 和TIM 蛋白含量降低,這在果蠅中不僅激活per 基因,而且激活tim 基因[9]。此外,研究人員還在3 號染色體上發現了一種被稱作cycle(中文:循環,縮寫為cyc)的基因(與小鼠的bmal基因同源),它翻譯成的蛋白能與CLOCK 蛋白結合形成二聚體激活per 和tim 基因。
幸運的是另一個一直困惑科學家的問題也幾乎同時得到解釋, 這就是環境光強度對晝夜節律鐘的影響。 1996 年,塞加爾(Sehgal A.)實驗室發現果蠅TIM 蛋白可被光降解, 在光照之后PERTIM 蛋白復合體的數量很快地下降。 1997—1998年, 霍爾實驗室的科學家在對果蠅的研究中進一步發現,CRY 蛋白(Cryptochrome,亦叫隱花色素,發現于20 世紀50 年代,由于含量低,直到1993年科學家才用遺傳學克隆的方法在擬南芥中證實)能與PER/TIM 復合體中的TIM 作用, 促進TIM 蛋白的降解,這樣可以防止TIM 蛋白與PER 蛋白結合抑制tim 和per 基因,從而減少抑制蛋白的數量[10]。 由此可見,DBT 蛋白和CRY 蛋白起到了相反的調控TIM-PER 異二聚體的作用,隱花色素被認為具有起搏器的作用。 這樣也很好地解釋晝夜節律鐘內因與外因的關系, 即生物鐘在外界環境影響下如何調控晝夜節律鐘的自行運轉(圖4)。
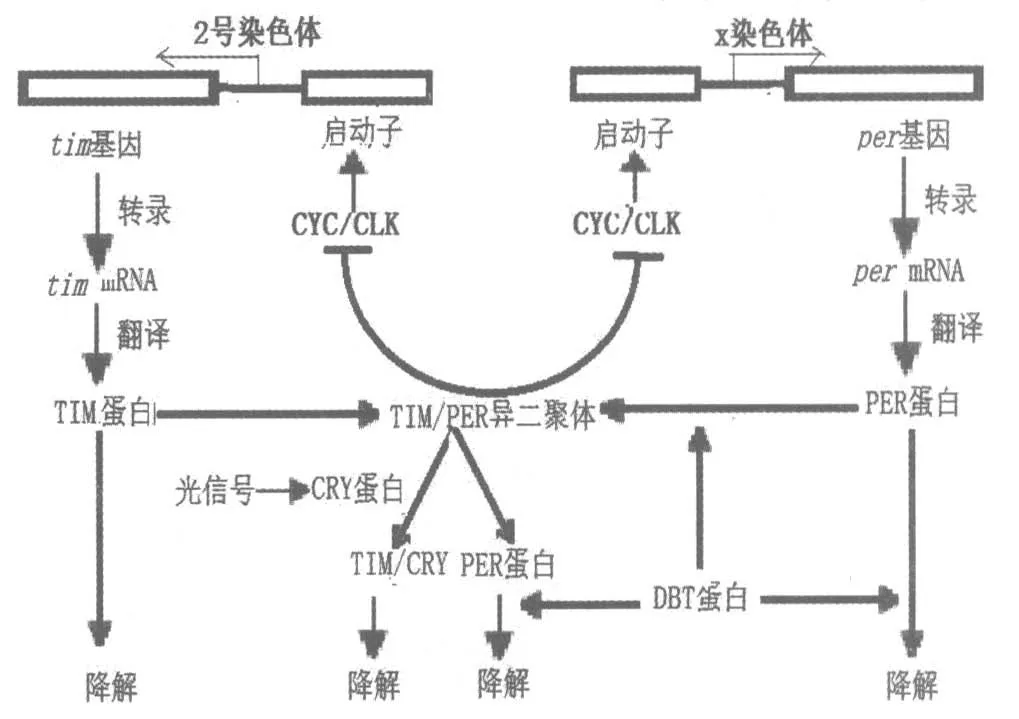
圖4 基于1998 年發現的cyc 和cry 基因而深化的TTFL 示意圖
在發現上述果蠅生物鐘反饋調控的同時,還發現了另一個生物鐘反饋環路, 這是基于一對等位基因vrille(中文:旋轉,縮寫為vri)的發現。1997 年, 喬治 (George H) 和泰拉科爾(Terracol R.) 在用甲基磺酸乙酯誘變技術分析果蠅胚胎發育時, 發現有一個轉錄因子涉及晝夜節律鐘的活動。 1999 年,伯勞(Justin Blau)發現該轉錄因子影響CLK/CYC 復合體的功能, 這個轉錄因子就是VRI 蛋白。 這其中還涉及到另一個轉錄因子是PDP(Pyruvate dehydrogenase phosphatase 的 縮 寫,即丙酮酸脫氫酶磷酸酶)。 PDP 對clk 基因轉錄有正向的激活作用, 而VRI 對dClk 有負向的抑制作用,當然也對CLK/CYC 復合體起到抑制作用。 這樣,由于CLK/CYC 的抑制,PER/TIM 降低了CLK/CYC 的抑制作用, 除per-tim 回路外, 還有一個dClk 回路(這里d 是表示英文果蠅的第1 個字母)(圖5)。

圖5 果蠅per-tim 和dCLK 回路簡圖[11]
3 果蠅與其他模式生物晝夜節律鐘研究的相互促進
需要指出的是,TTFL 模型的揭示決不是僅限于對果蠅的研究, 而是與其他模式生物的研究相互印證的。 哈丁等在1990 年提出的TTFL 模型并沒有解決是mRNA 翻譯的蛋白質直接作用還是通過其他生化信號間接影響的問題。 1994 年,阿倫森(Aronson B.D.)等通過對面包霉(Neurospora crassa)的研究才確定是PER 蛋白能自動調節自己的轉錄[12]。 在晝夜節律鐘的研究中,除果蠅外,模式生物小鼠的貢獻同樣顯著。 1994 年,科學家用類似研究果蠅節律基因突變的篩選方法首先描述了小鼠晝夜節律基因的突變。 1997 年,受此影響突變的基因成為第1 個被克隆的哺乳動物生物鐘基因。隨后,小鼠晝夜節律基因的研究獲得迅速的進展, 這些基因與晝夜節律基因果蠅基因的相似性(指核苷酸序列)也被鑒定出來。 科學家發現,它們之間一些功能是相同的,但亦存在一些差異[13]。例如在小鼠中,CRY 蛋白是與PER 蛋白結合,形成PER/CRY 復合體,而不是像果蠅那樣,與TIM蛋白結合,形成TIM/CRY 復合體。 故果蠅是間接激活per 基因的轉錄, 但在小鼠中則是抑制該基因的表達,兩者作用相反。圖6 是從20 世紀70 年代始至20 世紀末果蠅和小鼠在晝夜節律鐘研究中的比較圖。從圖中可見,生物鐘的研究主要體現在表型和生理學、基因克隆2 個方面。 在表型、生理學方面,科學家發現了果蠅一系列的突變體、外側神經元起搏點和外部振蕩器; 而在小鼠中則發現了視交叉上核的中心作用、 獨立的視網膜時鐘和外部振蕩器等; 在基因克隆方面則是克隆了一系列的突變基因, 果蠅與小鼠晝夜節律鐘的基因克隆幾乎都集中在20 世紀90 年代下半期, 基因克隆技術的應用, 成為了揭開生物鐘分子機制的關鍵[14](圖6)。

圖6 1970—2000 年果蠅與哺乳動物晝夜節律基因研究中的重要事件[14]
表1 是有關學者對小鼠與果蠅中其他涉及到晝夜節律鐘基因突變的表型作出的相互比較,這也證明了TTFL 模型具有共性。
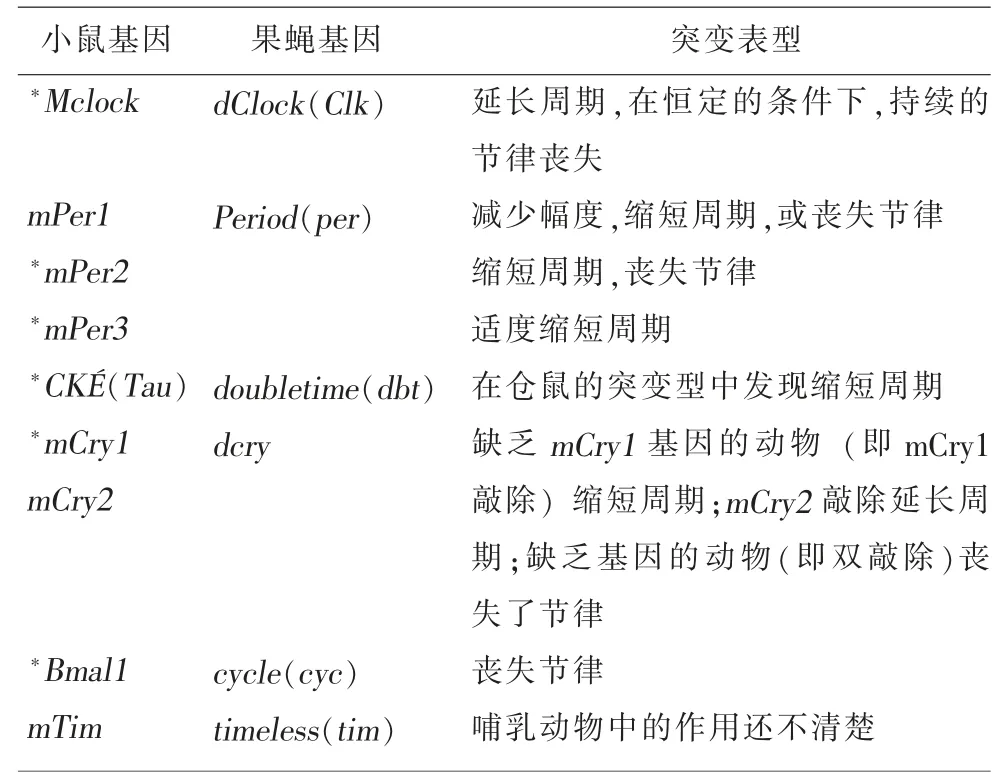
表1 果蠅與小鼠晝夜節律鐘基因突變基因和表型的相互比較[13]
需要補充的是,進入21 世紀以后,科學家的興趣逐漸從對模式生物果蠅晝夜節律鐘的研究轉移到模式生物小鼠上, 主要成果在Bmal 基因研究方面:2000 年,邦杰(Bunger M.K.)通過第1 個Bmal1基因敲除發現,BMAL1 蛋白對節律維持必不可少;2006 年,孔德拉托夫(Kondratov R.V.)進一步發現,Bmal1 基因敲除會使小鼠生命縮短;2015年,利普頓(Lipton J.O.)發現BMAL1 蛋白S42 位點被S6k1 周期磷酸化調控蛋白質合成。 此外,2006 年,正 雄(Masao D.)和 平 山(Hirayama J.)在發 現CLOCK 蛋 白 是 一 種 組 蛋 白 乙 酰 酶[15]。 2008年,阿舍(Asher G.)發現SIRT1 通過去乙酰化參與對per2 基因的調控[16]。 可見,模式生物小鼠對TTFL 模型的貢獻并不亞于果蠅。
綜上所述, 生物鐘研究有利于準確地揭示生命現象的規律及內在機制,通過研究生物鐘,如今已產生了時辰生物學、 時辰藥理學和時辰治療學等新學科,這不僅在醫學上有著重要的意義,而且對生物學的基礎理論研究起著巨大的促進作用。果蠅晝夜節律鐘分子機制及負反饋機制的發現,為科學家研究其他生物和人類生物鐘起到了先導作用。TTFL 模型的揭示主要是運用了基因克隆技術和基因與蛋白質晝夜間的振蕩表達的量化分析及各種模式生物之間的相互印證。霍爾、羅斯巴什和楊因發現控制晝夜節奏的分子機制分享了2017 年的諾貝爾生理學或醫學獎。 當然,生物鐘中還有許多秘密有待進一步揭開, 期待科學家的下一個研究成果。

